ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
Andrade, C.C. (UEG-UNUCET) ; Mendonça, M.A.G. (UEG-UNUCET) ; Mendonça, T.L.F. (UEG-UNUCET) ; Signini, R. (UEG-UNUCET) ; Costa, M.B. (UEG-UNUCET)
Resumo
A quitosana possui várias aplicações, porém ainda está limitada quanto a sua solubilidade. Portanto, novas rotas sintéticas estão sendo feitas objetivando melhorar tanto nas suas propriedades físico-químicas, quanto nas biológicas. A guanilação de quitosanas vem ganhando destaque, por juntar dois grupos com grandes possibilidades reacionais. O trabalho visa comparar duas rotas sintéticas para determinar a que possui melhor rendimento ou mais facilmente obtém-se o produto. O processo de comparação por rendimentos precisa passar por ajustes, seja na parte de purificação ou nos cálculos realizados. Dentre elas a que se demonstra ser mais simples de ser realizada é a guanilação via síntese de tioureia, uma vez que se comparada a outra metodologia não apresentará a formação de intermediários.
Palavras chaves
Quitosana; Quitosana-guanilados; Guanidinas
Introdução
A pesquisa por novos fármacos se fundamenta na busca por novos protótipos e no planejamento de modificações estruturais da molécula, a fim de se adquirir novas substâncias com potencial bioatividade, visando à alta seletividade da ligação sem se perder sua atividade biológica (ANDRICOPULO, 2009). A quitosana por ser o principal derivado da quitina, conserva algumas de suas características como a biocompatibilidade e atoxidade, porém apresenta melhoras quanto a sua solubilidade, principal desvantagem do uso da quitina, na qual em pH alcalino os grupos aminos livres podem ser protonados, tornando o polissacarídeo solúvel (VINSOVA; VAVRIKOVA, 2011). A maior limitação do uso de derivados de quitosana em tratamentos intravenosos está na sua faixa de solubilidade muito limitada, uma vez que apresentam sua solubilidade em meio acido, e o pH fisiológico gira em torno de 7,4, havendo a grande possibilidade de se formar o sólido do composto quando o mesmo entrar em contato com a corrente sanguínea. Visando superar essa limitação, os pesquisadores vêm buscando reações com quitosana para a síntese de novos derivados que apresentam uma melhora em suas propriedades e sobre sua faixa de solubilidade (ZHAO‐SHENG et al., 2012). Entre as reações existentes, podem-se destacar as de fosfatação, sulfatação, carboxialquilação, quaternização, e guanilação, dentre outras (ROBERTS, 1992). A guanidina pode ser encontrada em muitos produtos naturais, isoladas principalmente de algas, esponjas, etc. O grupo guanidínico apresenta uma alta basicidade, que o torna totalmente protonado a um pH fisiológico (ZHAO-SHENG et al., 2012). O grupo funcional guanidina desempenha um papel importante em sistemas biológicos, pois está presente em muitos compostos e apresenta uma vasta gama de atividades farmacológicas (LEVALLET et al., 1997). Seu uso abrange várias áreas, tais como engenharia de cristais, química supramolecular, líquidos iônicos, área alimentícia, inseticidas, entre outras (ALONSO-MORENO et al., 2014; ISHIKAWA, 2009). Compostos sintéticos ou naturais que apresentam em sua composição o grupo funcional guanidina, estão relacionados com várias atividades biológicas, como por exemplo, o inibidor da gripe. Logo, devido a sua aplicação no campo da química medicinal, cresceu-se notoriamente o interesse na conversão das mais variadas aminas a guanidina (OHARA et al.,2009; CUNHA et al., 2005; CUNHA et al., 2000). O uso de derivados guanidínicos está relacionado às suas características físico-químicas: alta basicidade, polaridade e hidrossolúvel, bem como a quantidade e tipos de substituintes empregados (NGAMGA et al. , 2007; NGAMGA et al., 1994). O núcleo da guanidina pode ser formado a partir de várias transformações químicas, como a partir de tioureias, isotioureias, cianamida, carbodiimidas, carboxamida e amidina de ácidos sulfônicos. A principal base de formação das guanidinas é por meio da síntese com tioureias, que devem ser protegidas para evitar dificuldades sintéticas e quanto a sua purificação, sendo que sua desvantagem está relacionada ao uso de sais de mercúrio, reagente extremamente tóxico (ALONSO-MORENO et al., 2014; ISHIKAWA, 2009). Vários derivados quitosânicos tem surgido com modificação via reações de guanilação, visando à melhora se sua faixa de solubilidade e atividade bactericida. A literatura já demostra que tal síntese vem apresentando uma melhor ação bactericida e possível melhor faixa de solubilidade (HU et al., 2007; SOGIAS et al., 2010; SUN et al., 2010; ZHAI et al., 2011; ZHAO-SHENG et al., 2012). Entre os núcleos mais utilizados para a realização da guanilação da quitosana, o uso de tioureias e amidina de ácidos sulfônicos tem ganhado um destaque maior, seja por apresentarem reações rápidas e de elevados rendimentos, ou mesmo pela facilidade de obtenção e modificação de suas estruturas. Portanto, este trabalho objetiva a síntese de quitosana-guaniladas tendo como produtos bases tioureias e amidina de ácidos sulfônicos, e a determinação de qual metodologia apresente melhor viabilidade e rendimento.
Material e métodos
A parte experimental foi executada na Unidade Universitária de Ciências Exatas e Tecnológicas (UnUCET) da Universidade Estadual de Goiás (UEG). Os reagentes e solventes P. A. (E. Merck, Aldrich Chemical Co., Fluka, Grupo Química, Vetec, Ecibra e Quimex) foram utilizados sem purificação prévia. Síntese via amidina de ácidos sulfônicos Preparo do Ácido – amino-imino-metanossulfônico (AAIMS) A 27 mL de anidrido acético P.A., sob agitação constante e banho de gelo, adicionou-se 10 mL de peróxido de hidrogênio 35%, gota a gota. O banho de gelo e a agitação foram mantidos por 30 minutos. Logo após, adicionou-se 10 mL de etanol absoluto no meio reacional. Procedeu-se com agitação vigorosa por mais 30 minutos. Esta solução foi denominada solução 1. Paralelamente, preparou-se uma solução de tioureia 1 (1,6 g; 5,6 mmol) solubilizada em 50 mL de etanol absoluto resfriando a solução para uma temperatura inferior a 10°C. Esta solução foi denominada solução 2. Adicionou-se, em seguida, a solução 2 à solução 1 gota a gota com monitoramento da temperatura (45 - 55°C). A reação foi mantida por 3 horas sob agitação vigorosa e constante. Após, o produto foi colocado sob recristalização até a formação de um sólido. Reação com a quitosana Foram solubilizados 500 mg de quitosana em 40 mL de ácido acético 0,5%, seguido de neutralização parcial com 150 µL de trietilamina (4 x 150 mL). O pó de AAIMS foi adicionado gradualmente (4 x 150 mg) ao precipitado de quitosana, sob agitação constante. A solução foi, então, dialisada contra água destilada por 5 dias e depois congelada e liofilizada. Síntese via Tioureia Preparação da Tioureia Em um balão de fundo redondo com capacidade para 50 mL, colocou-se 490,28mg (3,6 mmol) de isopropil-2-piridinil-amina, que foi solubilizado em 15 mL de Benzeno. A solução foi colocada em banho de gelo com agitação por 5 minutos. Em seguida, adicionou-se, lentamente, 587,52 mg (3,6 mmol) de isotiocianato de benzoíla. Após 5 minutos, retirou-se o banho de gelo e deixou-se em agitação a temperatura ambiente por 24 horas. O processo reacional foi acompanhado via CCD. Após o término da reação, o composto foi seco em evaporador rotativo e purificado por recristalização em acetato de etila e éter de petróleo. Reação com Quitosana Solubilizou-se 570mg (3,5 mmol) de quitosana em 20mL de ácido acético 1%, com agitação constante por aproximadamente 10 minutos até formar um gel. Em seguida, adicionou-se uma solução de carbonato de sódio 1% até que o pH estivesse na faixa de 8-9. Posteriormente, adicionou-se a tioureia (570mg; 1,96 mmol) na solução, e em seguida, 2mL de uma solução de trietilamina, e 20mL de agua destilada. Posteriormente, a reação foi mantida sob refluxo, em banho de óleo, com a temperatura entre 50-70°C. A reação foi acompanhada por CCD. Após 4 dias, a reação foi finalizada e purificada por diálise durante 5 dias. Após este período, a amostra foi congelada e seca por um processo de liofilização.
Resultado e discussão
Após ambas as reações, os compostos obtidos passaram por um processo de
purificação denominado de diálise, que consiste de um processo físico-
químico em que a amostra é colocada em uma membrana microporosa, e inserida
em um recipiente com solvente (comumente água destilada). Este sistema busca
equilíbrio até o ponto em que a concentração de ambos os lados da membrana
seja a mesma (FERREIRA, 2011). Posteriormente, os compostos serão colocados
na geladeira até seu congelamento e liofilizados.
Foram feitas três sínteses via amidina de ácidos sulfônicos (AAIMS1, AAIMS2,
AAIMS3) e duas sínteses via tioureias (TIO+QUI1, TIO+QUI2), com diferentes
massas moleculares, com exceção da AAIMS1 e TIO+QUI2 que são referentes ao
mesmo composto, porém, por metodologias sintéticas diferentes.
O cálculo do rendimento foi realizado levando em consideração a
funcionalização total do reagente limitante da reação, que em todos os casos
fazem referência ao reagente colocado para reagir com a quitosana.
Como é possível observar na tabela abaixo, os valores dos rendimentos não
apresentam um padrão quanto à síntese utilizada, uma vez que os valores
estão muito discrepantes. Entretanto, os dois últimos compostos apresentaram
valores mais aceitáveis, uma vez que a quitosana utilizada não havia sido
purificada, ou seja, ainda havia partes do polímero que apresentavam o grupo
acetil, inviabilizando ambas as reações.
Mesmo assim, ao levarmos em consideração as etapas reacionais necessárias
para a síntese do mesmo composto final, a reação via tioureia se mostrou
mais eficiente, por não necessitar da síntese de um intermediário para
depois realizar a reação. E por apresentar uma etapa a menos, também reduz o
risco de perda da amostra, aumentando assim o rendimento final.
Entretanto, mesmo que não estejam desmistificados os processos de
purificação e de síntese da amostra, para a determinação dos rendimentos,
ambos os compostos foram identificados por técnicas espectrométricas.
Na tabela abaixo estão representadas as absorções no IR de dois compostos,
sendo que estes estão representados na figura abaixo juntamente com sua rota
sintética.
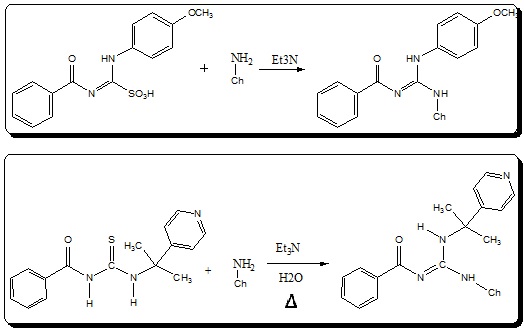
Esquema das duas vias da reação de guanilação
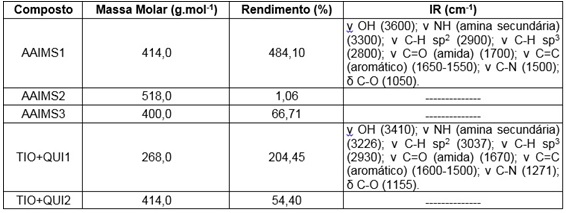
Informação obtidas dos compostos
Conclusões
O presente trabalho concluiu que em questão de etapas reacionais e simplicidade de realização da síntese, o composto final obtida via tioureia obteve maior destaque, porém o mesmo não pode ser verificado quanto aos valores de rendimento. Logo, necessita-se de melhorar os métodos de purificação da amostra e compreender melhor as especificações de cada uma das vias da síntese.
Agradecimentos
Á CAPES pelas bolsas fornecidas e a Universidade Estadual de Goiás por todo o suporte fornecido.
Referências
ALONSO-MORENO, C.; ANTIÑOLO, A.; CARRILLO-HERMOSILLA, F.; OTERO, A.; Guanidines: from classical approaches to efficient catalytic syntheses. Chemical Society Reviews, v. 43, n. 10, p. 3406-3425, 2014.
ANDRICOPULO, A. D.; SALUM, L. B.; ABRAHAM, D. J.; Structure-based drug design strategies in medicinal chemistry. Current Topics in Medicinal Chemistry, v. 9, n. 9, p. 771-790, 2009.
CUNHA, S.; COSTA, M.B.; NAPOLITANO, H.B.; LARIUCCI, C.; VENCATO, I.; Study of N-benzoyl-activation in the HgCl2-promoted guanylation reaction of thioureas. Synthesis and structural analysis of N-benzoyl-guanidines, Tetrahedron Letters, 2000, v. 57, p.1671-1675
CUNHA, S.; RODRIGUES JR, M. T.; DA SILVA, C. C.; NAPOLITANO, H. B.; VENCATO, I.; LARIUCCI, C.; The first synthesis of pyridinium<i> N</i>-benzoylguanidines by bismuth-and mercury-promoted guanylation of<i> N</i>-iminopyridiniumylide with thioureas. Tetrahedron, v. 61, n. 44, p. 10536-10540, 2005.
Ferreira, A. M. G. Efeito de alta pressão na diálise de uma solução de uma proteína com sal. 2011. 93f.. Dissertação (Mestrado em Engenharia Química) - Universidade de Aveiro, Departamento de Química, Portugal.
HU, Y.; DU, Y.; YANG, J.; KENNEDY, J. F.; WANG, X.; WANG, L.; Synthesis, characterization and antibacterial activity of guanidinylated chitosan. Carbohydrate Polymers, v. 67, n. 1, p. 66-72, 2007.
ISHIKAWA, T.; Superbases for organic synthesis: guanidines, amidines, phosphazenes, and related organocatalysts. New York: wiley, 2009.
LEVALLET, C.; LERPINIERE, J.; KO, S. Y.; The HgCl< sub> 2</sub>-promoted guanylation reaction: The scope and limitations. Tetrahedron, v. 53, n. 14, p. 5291-5304, 1997.
NGAMGA, D.; FANSO FREE, S. N. Y.; TANE, P.; FOMUM, Z. T.; MILLAURINE, A.; A new guanidine alkaloid from seeds of<i>Millettialaurentii</i>. Fitoterapia, Fitoterapia, v. 78, n. 3, p. 276-277, 2007.
NGAMGA, D.; FREE, S. N. F.; FOMUM, Z. T.; MARTIN, M. T.; BODO, B.; A new guanidine alkaloid from Millettialaurentii. Journal of Natural Products, v. 57, n. 7, p. 1022-1024, 1994.
OHARA, K.; VASSEUR, J.J.; SMIETANA, M.; NIS-promoted guanylation of amines. Tetrahedron Letters, v. 50, n. 13, p. 1463-1465, 2009
ROBERTS, G.A.F.; Chitin chemistry. London: Macmillan, 1992.
SOGIAS, I. A., KHUTORYANSKIY, V. V., & WILLIAMS, A. C. Exploring the factors affecting the solubility of chitosan in water.Macromolecular Chemistry and Physics, v. 211, n. 4, p. 426-433, 2010.
SUN, S., AN, Q., LI, X., QIAN, L., HE, B., & XIAO, H. Synergistic effects of chitosan–guanidine complexes on enhancing antimicrobial activity and wet-strength of paper. Bioresource technology, v. 101, n. 14, p. 5693-5700, 2010.
VINSOVA, J.; VAVRIKOVA, E.; Chitosan derivatives with antimicrobial, antitumour and antioxidant activities-a review. Current pharmaceutical design, v. 17, n. 32, p. 3596-3607, 2011.
ZHAI, X., SUN, P., LUO, Y., MA, C., XU, J., & LIU, W. A simple way to fabricate cell penetrating peptide analogue‐modified chitosan vector for enhanced gene delivery. Journal of Applied Polymer Science, v. 121, n. 6, p. 3569-3578, 2011.
ZHAO‐SHENG, C.; YUE‐MING, S.; CHUN‐SHENG, Y.; XUE‐MEI, Z.; Preparation, characterization, and antibacterial activities of para‐biguanidinyl benzoyl chitosan hydrochloride. Journal of Applied Polymer Science, v. 125, n. 2, p. 1146-1151, 2012.


















