ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
Silva, H.V.C. (UFPE) ; Silva, I.M. (FIBJ) ; Albuquerque, J.F.C. (UFPE)
Resumo
Com o objetivo de descobrir novas moléculas para o tratamento de determinadas doenças, muitos pesquisadores vêm dedicando-se há anos neste propósito. Dentre estas novas moléculas está a tiazolidina. Diversos estudos já comprovaram que a tiazolidina e seus derivados, como a tiazolidina-2,4- diona, possuem uma gama de atividades biológica e farmacológica, por serem altamente bioativas. O objetivo deste trabalho foi sintetizar um novo composto tiazolidinico, o 2-hidroxi-3-bromo-5-cloro-tiazolidina-2,4-diona, a partir de uma reação de condensação da tiazolidina-2,4-diona (Ju-32) com 2- hidroxi-3-bromo-5-clorobenzaldeído na posição 5 do anel tiazolidínico. Neste trabalho foi determinada a estrutura química e analisada a configuração por método físicos convencionais e também as constantes físicas.
Palavras chaves
tiazolidina; tiazolidina-2,4-diona; arilideno
Introdução
Desde o século XIX pesquisadores vêm se preocupando em descobrir novas moléculas com atividade biológica dirigida a cura de determinadas doenças. Estas tentativas resultaram em diversos medicamentos eficientes colocados a disposição das pessoas portadoras de determinadas doenças. Entre estas pesquisas os núcleos heterocíclicos são alvos desses estudos por terem diversos sítios reativos em várias posições de seus anéis. Entre estes núcleos é destacada a tiazolidina que tem um anel heterocíclico de cinco átomos capaz de receber os mais diversos substituintes. Estas substituições conferem ampla atividade biológica à molécula e são objetos de várias pesquisas. As tiazolidinas são compostos formados por um anel pentagonal contendo os heteroátomos enxofre e nitrogênio. Seus derivados apresentam diversas características que as tornam ativas para antitumorais, anticonvulsivantes, antimicrobianas, citotóxicas, etc. (El-Gaby et al., 2009; Lesyk et al., 2011; Devinyak et al., 2014). Um dos seus derivados destacados é a tiazolidina-2,4-diona, que contém vários sítios ativos no anel heterocíclico, podendo sofrer diversas substituições (Verma, et, al., 2008). Essas propriedades garantem um grande número de atividades, podendo ser citadas a atividade antimicrobiana, antifúngica, pesticida, amebicida, narcótica, anticonvulsante, antineoplásica, hipoglicemiante e anti- inflamatória (Lima, et al., 1998, Gouveia, et al., 2009). Com modificações estruturais na molécula original é possível criar uma série de derivados análogos e analisar a influência que a troca de algum átomo ou grupo de átomos pode exercer sobre a atividade farmacológica (Lemke, 2013). Este trabalho teve o objetivo de sintetizar o composto 2-hidroxi-3-bromo-5-cloro- tiazolidina-2,4-diona (Ju-604) e determinar sua estrutura.
Material e métodos
Em um balão de fundo redondo de 25 mL sob agitação magnética e temperatura ambiente, foram adicionados 5 mL de ácido acético e 0,100 gramas (0,000857 moles) de tiazolidina-2,4-diona, utilizando três gotas de piperidina como catalisador. A reação foi mantida sobre a bancada com agitação contínua e após 12 minutos, foi adicionado gota a gota, 0,2013 gramas (0,000601 moles) do reagente 2-hidroxi-3-bromo-5-clorobenzaldeido previamente dissolvido em 2 mL de ácido acético. A mistura reacional permaneceu na capela de exaustão por 12 horas ininterruptas. Todo o processo reacional foi acompanhado por cromatografia de camada delgada, usando o sistema hexano/acetato na proporção 6:4. A placa cromatográfica foi revelada na luz UV em 254 nm. Após a constatação do término da reação, a mistura contida no balão foi transferida para um béquer de 50 mL e colocada em banho de gelo, onde, mesmo com este recurso, o conteúdo do béquer não cristalizou nem mostrou mudanças aparentes em seu estado. A mistura foi evaporada naturalmente e, após um dia de espera o conteúdo do béquer apresentou a formação de pequenos cristais amarelo-amarronzados. O produto foi colocado num funil de Buckner sinterizado e deixado todo o solvente escoar naturalmente, para evitar a perda de cristais. Após essa filtração natural o material foi lavado com água, três vezes consecutivas para retirar todo o ácido acético e posteriormente lavado com etanol. Os cristais foram colocados para secar na estufa a 37 ºC. Após três horas, não havia mais vestígios de água. Os cristais foram transferidos para um frasco de penicilina, onde foram devidamente pesados e calculado o rendimento. Logo após, pequenas amostras foram coletadas para a medição do ponto de fusão, o cálculo do Rf, e determinação da solubilidade a frio e a quente.
Resultado e discussão
O composto 2-hidroxi-3-bromo-5-cloro-tiazolidina-2,4-diona (Ju-604) Fig. 1
formou cristais finos em forma de agulhas e coloração marrom-amarelado. Após
seco em estufa a 37 °C pesou 0,1231 gramas rendimento de 43 %. As constantes
físicas foram determinadas: ponto de fusão 176,8 °C e Rf: 0,48 sistema
(Hexano/Acetato 0,6:0,4). O produto apresentou solubilidade a frio em
tetracloreto de carbono, tolueno, éter etílico, THF, acetato de etila,
dioxano, etanol, acetona, ácido acético e metanol. O espetro de
Infravermelho (IV), Ressonância Magnética Nuclear de Hidrogênio e de Carbono
treze (RMN1H; RMN13C); Massa e Análise elementar contribuíram para a
determinação da estrutura. O espectro de IV (cm–1, KBr 1 %,) mostrou os
principais picos em 3233, para (N–H); as carbonilas em1720 e 1734 cm–1 O
espectro de RMN1H (300 MHz, DMSO-d6, δ, ppm) apresentou sinais de
hidrogênios em, 12,15 (s, NH); 8,03 (s, CH=) 5,47 (s, 1H, OH); 7,32 (s 1H4,
Ar) 7,515 (s, 1H5, Ar). Para o RMN13C e DEPT (75,5 MHz, DMSO-d6, δ, ppm), os
sinais foram 166,12 C=O(2) 165,7 (C=O(4); 147,35 (s, 1H CH=C), 123,4;
156,28; 163,5; 114,3; 132,4; 127,4 (aromáticos). No (IV) o composto foi
caracterizado pelas absorções das carbonilas, de CH= e do NH. No NMR1H foram
evidentes os picos em 8,03 referente a dupla ligação C=C. Esta absorção foi
suficiente para indicar a conformação Z do composto. Isto foi provado porque
o outro confórmero E tem absorção em campo mais baixo. As absorções do NH,
OH e do anel aromático foram evidentes. No carbono treze as absorção das
carbonilas da dupla ligação carbono-carbono e também do anel aromático foram
bem claras. para a identificação de todos os carbonos. O espectro de massa
apresentou o PM em 334,5736. A análise elementar evidenciou a estrutura com
os dados C 35,91; H 1,52 e N 4,20 %.
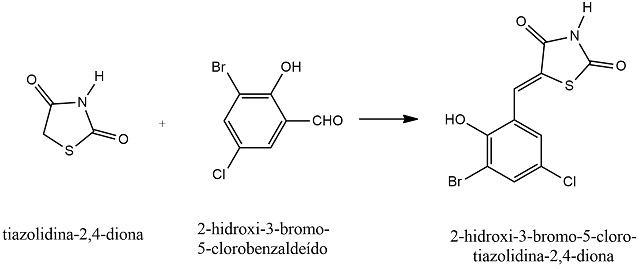
Sínte do derivado tiazolidínico 2-hidroxi-3-bromo- 5-cloro-tiazolidina-2,4-diona (Ju-604)
Conclusões
O composto 2-hidroxi-3-bromo-5-cloro-tiazolidina-2,4-diona (Ju-604) foi sintetizado conforme os padrões da literatura. As constantes físicas foram determinadas. O rendimento da reação foi de 43 %, sendo considerado baixo em relação a outras reações dessa série. Este fato pode se justificar pelo fato dos reagentes usados estarem um pouco antigos. Sua estrutura química foi determinada por métodos físicos de Infravermelho e de Ressonância Magnética Nuclear de Hidrogênio e de Carbono treze. Sua análise elementar também foi determinada. Este composto está sendo submetido aos testes microbiológicos.
Agradecimentos
Ao PIBIC/CNPq pela bolsa de Iniciação científica concedida, pelo apoio dado, pelo projeto de pesquisa aprovado. A Central analítica do Departamento de Q. Fundamental
Referências
1.Devinyak, O. Havrylyuk, DZimenkovsky, . B. and Lesyk, “Computational Search for Possible Mechanisms of 4-Thiazolidinones Anticancer Activity: The Power of Visualization,” Molecular Informatics, vol. 33, no. 3, pp. 216-229, 2014.
2.El-Gaby, M. S. A.; El-Hag Ali, G. A. M.; El-Maghraby, A. A.; El-Rahman, M. T.; Abd Mohamed, H. M.; Helal, M. H .M. Synthesis, characterization and in vitro antimicrobial activity of novel 2-thioxo-4-thiazolidinones and 4,40-bis (2-thioxo-4-thiazolidinone-3-yl)diphenylsulfones, Eur. J. Med. Chem. 2009, 44, 4148-4152.
3.Gouveia, F. L.; Oliveira, R. M. B.; Oliveira, T. B.; Silva, I. M.; Nascimento, S. C.; Sena, K. X. F. R.; Albuquerque, J. F. C. Synthesis, antimicrobial and cytotoxic activities of some 5-arylidene-4-thioxo-thiazolidine-2-ones, Eur J Med Chem. 2009, 44, 2038-2043.
4.Lemke, T.L Williams, D.A. Roche, V. F. Zito S.W. “Foyes’s of Medicinal Chemistry” Wolters Kluwer; Lippincott Williams & Wilkins, pp 1-1500, 2013.
5.Lesyk, . R. B. Zimenkovsky, B. S. Kaminskyy, D. V.. Kryshchyshyn, A. P Havryluk, D. Y. Atamanyuk, D. V. Yu Subtel’na, I. . Khyluk, D. V “Thiazolidinone motif in anticancer drug discovery. Experience of DH LNMU medicinal chemistry scientific group,” Biopolymers and Cell, vol. 27, no. 2, pp 107-117, 2011.
6.LIMA, J. G. Some chemical Aspects of the ring thiazolidine-2,4-dione. Ver. Univ. Rural, Sér. Ciênc. Exatas e da Terra, 18/20 (1/2)
7.Verma, A.; Saraf, S. K. 4-Thiazolidinone and a biologically active scaffold, Eur. J. Med. Chem. 2008, 43, 897-905.


















