ISBN 978-85-85905-15-6
Área
Química Orgânica
Autores
Silva, H.V.C. (UFPE) ; Silva, I.M. (FIBJ) ; Albuquerque, J.F.C. (UFPE)
Resumo
Os compostos tiazólicos são uma importante classe de derivados heterocíclicos que apresentam vasta atividade biológica e farmacológica. Seus diversos produtos são potencialmente portadores ativos de ações antimicrobianas, anti-inflamatórias, anticonvulsivantes, hipoglicemiante, antimicrobiana, anti-inflamatória, analgésica, antifúngicas, ant-HIV entre outras. Seu anel aromático de cinco membros pode ser substituído em todos os átomos do ciclo sendo mais comumente substituído nas posições dois e quatro. O derivado [4-(4-Clorofenil)-tiazol-2-il]-(2,4-dicloro-benzilideno)-amina (Ju-429) faz parte de uma perspectivas da síntese de um produto bioativo e foi idealizado trocando estas duas posições por novos substituintes. Sua estrutura química foi comprovada por métodos físicos espectrométricos.
Palavras chaves
Tiazol; derivados tiazólicos; base de Schiff
Introdução
Os derivados tiazólicos são descritos por Siddiqui et al., (2009), como composto heterocíclico com um átomo de nitrogênio e outro de enxofre e duas duplas ligações no heterociclo do anel aromático de cinco membros. Seus derivados apresentam amplo espectro de atividade biológica e farmacológica entre estas anticâncer, antibacteriana, antidepressiva, anti-inflamatória e outras, (Vicini et al., 2003; Holla et al., 2003; Souza et al., 2005). Vários medicamentos contendo o núcleo tiazóllco fazem parte de uma gama de produtos já comercializados tais como, Sulfatiazol (antimicrobiano), ritonavir (medicamento antirretroviral), Abafungin (antifúngico) e Tiazofurin (antineoplásico). O potencial bioativo dessas moleculas tem sido ampliado com modificações do anel tiazol contribuindo também para reduzir a toxicidade (Siddiqui et al., 2009). Em geral, a atividade inibitória contra bactérias Gram-negativas foi maior do que para as bactérias Gram-positivas mostrando excelente atividade antimicrobiana comparado com medicamentos padrão. O 1-(tiazol-2-il)pirazolina mostrou excelente atividade contra bactérias Gram-negativas e boa atividade contra bactérias Gram-positivas. Pela relação estrutura-actividade (SAR) foi possível concluir que tanto o grupamento químico pirazolina quanto o tiazol foram essenciais para a atividade antimicrobiana (Abdel-Wahab, et al., 2009) A atividade antifúngica foi avaliada contra três cepas fúngicas, Candida albicans, Cryptococcus neoformans e Aspergillus flavus, estes compostos exibiram atividade antifúngicas de boa a excelente (Bharti et al., 2010). O objetivo deste estudo foi sintetizar o composto [4-(4-Clorofenil)-tiazol-2-il]-(2,4- dicloro-benzilideno)-amina (Ju-429) e determinar sua estrutura quimica e posteriormente avaliar sua atividade microbiológica.
Material e métodos
Em um balão de fundo redondo de 25 mL, foram adicionados 0,100 g (4,7×10-4 mol) de 4-(4-clorofenil)-2-aminotiazol (Ju-419), previamente sintetizado e 15 mL de metanol. A solução permaneceu em agitação magnética a temperatura ambiente por 5 minutos. Logo após esse período, foram adicionados 0,083 g (4,7×10-4 mol) de 2,4-diclorobenzaldeido, o pH foi então ajustado entre 4-5 e a reação permaneceu a temperatura ambiente durante 10 minutos. Após esse período foi transferida para o banho de óleo e aquecida a 100 °C. A mistura reacional foi mantida em agitação magnética e refluxo e acompanhada por cromatografia de camada delgada até o seu término sendo visualizada em luz UV 254 nm. Após quatro horas foi constatado o final da reação, o conteúdo do balão foi transferido para um béquer, que foi devidamente etiquetado e deixado em repouso até cristalização, que ocorreu dois dias depois. Os cristais foram filtrados usando um funil sinterizado e deixando que o solvente escoasse naturalmente sem vácuo para evitar que alguns cristais finos passassem pelo filtro. Após todo o escoamento do solvente os cristais foram lavados com água destilada três vez para retirar todo ácido clorídrico que estava presente no meio reacional. Em seguida o material foi lavado com etanol por três vezes usando o vácuo. O produto foi levado à estufa com a temperatura controlada em 37 ºC, durante três horas até não haver mais vestígios de água. Depois de seco, os cristais foram transferidos para um pequeno frasco de vidro onde foram devidamente pesados. O rendimento foi calculado e submetido aos testes de solubilidades. Uma pequena quantidade dos cristais foi encaminhada à central analítica para determinação dos espectros de Infravermelho, Ressonância Magnética Nuclear de Hidrogênio e de Carbono treze e Massa.
Resultado e discussão
O composto (Ju-429) (Fig. 1), após filtração e cristalização em acetona
apresentou os seguintes dados: ponto de fusão 223-224 ºC, Rf 0,44 no sistema
(CHCl3/MeOH 0,96:0,04) e rendimento de 23 %. Este baixo rendimento foi
atribuido ao método que ainda não está perfeitamente ajustado. Segundo a
literatura estas reações apresentam rendimentos bem maiores na faixa de 64 a
90 % (Raj et al., (2007). Outro fator importante foi citado por (Chimenti et
al., 2011) que usou o 2-propanol como solvente, isto deixou o produto final
precipitado sem a necessidade de purificação adicional. O Infravermelho νmax
(KBr, cm-1) mostrou bandas de estiramentos (v) de deformação axial entre
1630-1595 cm-1, caracteristicas do grupo azetina C=N (RAJ et al., 2007).
Outras bandas em 1562-1492 cm-1 do grupo C=C aromático (Bharti et al.,
2010). A ausência de banda em 1750-1700 cm-1 confirma a conversão do grupo -
CHO do benzaldeido em grupo -N=CH, (Bharti et al., 2010). As principais
absorções foram –NH2 3385-3312; (C-H) Ar 3120; C=N 1595; (C=C) Ar 1497; C-N
1178; C-S-C 1049; C-Ar 823; Ar-Cl 724. No RMN1H Os prótons aromáticos
mostraram absorções em 8,20 ppm com diferentes multiplicidades (Kumar et
al., 2007). O grupo N=CH-Ar foi evidenciado entre 4,92 ppm e N=CH em 4,74 (s
1H); C=CH; 5,60 (s 1H); fenil: 7,39-7,36 (d 2H, J=8,99); 7,20-7,17 (d, 2H
J=8,99); Benzilideno 7,61 (d, 1H J=8,39); 7,51 (dd, 1H J=8,39, J=2,09) Hz;
7,66 (s, 1H). O RMN13C mostrou deslocamentos em 159,62 ppm, referente o
grupo imino (CH=N), da base de Schiff evidenciando a substituição no grupo
amina do composto inicial (Ju-419) e confirmando a formação da base de
Schiff e do anel tiazol-2,4-dissubstituido. Outros sinais: 169,17 N=C-N;
113,46 HC-S; 148,22 C=C-N; 159,62; CH=N. Aromáticos 137,25; 133,18; 132,86;
132,13; 129,48; 127,78.
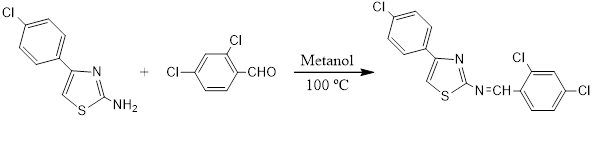
Síntese do composto [4-(4-Clorofenil)-tiazol-2- il]-(2,4-dicloro-benzilideno)-amina (Ju-429)
Conclusões
O composto [4-(4-Clorofenil)-tiazol-2-il]-(2,4-dicloro-benzilideno)-amina (Ju- 429) foi obtido seguindo indicações da literatura. O produto sintetizado teve todos os dados necessários determinados, ponto de fusão, rendimento, solubilidade e Rf. Sua estrutura química foi identificada por espectrometria de Infravermelho, Ressonância Magnética Nuclear de Hidrogênio, de Carbono treze e massa. Os picos de RMN1H; RMN 13C mostraram absorções para todos os hidrogênios e carbonos enfatizando a dupla ligação CH=C e o grupo imino (CH=N), carbonilas e aromáticos. O peso molecular foi confirmado pelo Massa.
Agradecimentos
Ao PIBIC/CNPq pela bolsa de Iniciação científica concedida, pelo apoio dado, pelo projeto de pesquisa aprovado. A Central analítica do Departamento de Q. Fundamental
Referências
ABDEL-WAHAB, B. F.; ABDEL-AZIZ, H. A.; AHMED, E. M. Synthesis and antimicrobial evaluation of 1-(benzofuran-2-yl)-4-nitro-3-arylbutan-1-ones and 3-(benzofuran-2-yl)-4,5-dihydro-5-aryl-1-[4-(aryl)-1,3-thiazol-2-yl]-1H-pyrazoles, European Journal of Medicinal Chemistry. v 44. p 2632–2635, 2009
BHARTI S.K.; NATH G.; TILAK R.; SINGH S.K. Synthesis, anti-bacterial and anti-fungal activities of some novel Schiff bases containing 2,4-disubstituted thiazole ring, European Journal of Medicinal Chemistry, v 45, p 651-660, 2010.
CHIMENTI, F.; BIZZARRI, B.; BOLASCO, A.; SECCI, D.; CHIMENTI, P.; GRANESE, A.; CARRADORI, S.; D’ASCENZIO, M.; LILLI, D.; RIVANERA, D.. Synthesis and biological evaluation of novel 2,4-disubstituted-1,3-thiazoles as anti-Candida spp. Agents. European Journal of Medicinal Chemistry, v 46, p 378-382, 2011.
HOLLA, B. S.; MALINI, K. V.; RAO, B. S.; SAROJINI, B. K.; KUMARI, N. S. Synthesis of some new 2,4-disubstituted thiazoles as possible antibacterial and anti-inflammatory agents, European Journal of Medicinal Chemistry, v 38, p 313-318, 2003.
KUMAR, A.; RAJPUT, C. S.; BHATI, S. K..Synthesis of 3-[4'-(p-chlorophenyl)-thiazol-2'-yl]-2-[(substituted azetidinone/thiazolidinone)-aminomethyl]-6-bromoquinazolin-4-ones as anti-inflammatory agent. Bioorganic & Medicinal Chemistry, v 15, p 3089-96, 2007
RAJ, V. K. K.; NARAYANA, B.; ASHALATHA, B. V.; KUMARI, N. S.; SAROJINI, B. K. Synthesis of some bioactive 2-bromo-5-methoxy-N’-[4-(aryl)-1,3-thiazol-2-
SIDDIQUI, N.; ARSHAD, M. F.; AHSAN, W.; ALAM, M. S.. Thiazoles: A Valuable Insight into the Recent Advances and Biological Activities, International Journal of Pharmaceutical Sciences and Drug Research, v 1, p 136-143, 2009.
SOUZA, M. V. N.; FERREIRA, S. B.; MENDONÇA, J. S.; COSTA, M.; REBELLO, F. R.. Métodos de obtenção e aplicações sintéticas de tiazóis, uma importante classe de compostos heterocíclicos. Química. Nova, v 28, 2005.
VICINI, P.; ZANI, F., COZZINI, P.; DOYTCHINOVA, I.. Hydrazones of 1,2-benzisothiazole hydrazides: synthesis, antimicrobial activity and QSAR investigations. European Journal of Medicinal Chemistry, v. 37, p. 553-564, 2003.


















