ISBN 978-85-85905-15-6
Área
Alimentos
Autores
Gulão, E.S. (UNIVERSIDADE FEDERAL DO RIO DE JANEIRO) ; Garcia-rojas, E.E. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Rocha-leão, M.H.M. (UNIVERISDADE FEDERAL DO RIO DE JANEIRO)
Resumo
A formação de complexos coacervados vem sendo amplamente estudada para aplicação de ingredientes funcionais nos alimentos. Neste estudo foi avaliada a influência do pH (12,0-1,0) e concentração da gelatina (0,1, 0,2, 0,3, 0,4 e 0,5% m/m) na interação com o carboximetilcelulose (0,1% m/m) através da turbidez e diâmetro de partícula. O pH exerceu forte influência na interação entre os polímeros caracterizando prevalência de ligação eletrostática, tendo início abaixo do ponto isoelétrico da proteína (9,0), sendo observada formação máxima no pH 4,0. A concentração de mínima de proteína foi suficiente para saturar as moléculas do polissacarídeo, sendo a proporção 1:1 a mais favorável. A partir da microscopia observamos que o coacervado possui estrutura globular com núcleo único e homogêneo.
Palavras chaves
Coacervação; Polímeros; Microencapsulação
Introdução
As proteínas e os polissacarídeos classificam-se como biopolímeros e sua interação exerce influência direta sobre aspectos macroscópicos do alimento, tais como: fluidez, textura, estabilidade e sensação bucal. A interação entre ambos tende geralmente a ser instável, gerando o fenômeno de separação de fases, podendo ocorrer de duas maneiras distintas: através da incompatibilidade termodinâmica (segregação) ou separação de fases segregativa; ou ainda pela complexação (coarcevação complexa), conhecida como separação de fases associativa (CAPITANI et al., 2006). Os complexos coacervados possuem diferentes aplicações, como por exemplo: na separação de proteínas, como espessantes, estabilizantes em alimentos, na imobilização de enzimas e principalmente na microencapsulação nas indústrias de alimentos, cosméticos e medicamentos (HUANG et al., 2012). A formação dos coacervados pode ser influenciada por fatores intrínsecos do polímero, como a estrutura e densidade das cargas, bem como por fatores extrínsecos, como o pH, força iônica e temperatura (TURGEON et al., 2007). O pH é o principal fator por influenciar a atração eletrostática das cargas, principalmente quando proteínas e outras biomoléculas estão inseridas no sistema, pois estes componentes normalmente são originados de dissociação ou associação com prótons, podendo depois sofrer variação com o pH (LINDHOUD et al., 2007). A maior parte das interações que ocorrem no processo de coacervação complexa é do tipo eletrostática, por isso é necessário que os valores de pH do meio de reação estejam abaixo do ponto isoelétrico (pI) das proteínas, onde se apresentam suficientemente protonadas, para que ocorra a reação de complexação com polissacarídeos aniônicos (CAPITANI et al., 2006). A gelatina do tipo A (GE) é uma proteína solúvel obtida a partir da hidrólise parcial do colágeno sobre condições ácidas e possui ponto isoelétrico entre 8.0 e 9.0 (SILVA et al., 2015). A gelatina é um polímero natural, biodegradável, biocompatível e não tóxico. Sua composição típica contém 14% de umidade, 84% proteína e 2% de cinzas (RIX, 1990). As gelatinas possuem caráter anfótero, ou seja, apresentam carga negativa acima de seu ponto isoelétrico e positiva abaixo dele, permitindo seu emprego na técnica de microencapsulação por coacervação. A gelatina tem sido utilizada em aplicações na indústria de alimentos, fotográfica, cosmética e farmacêutica (BINSI et al., 2009). Na indústria de alimentos é utilizada principalmente mo um coloide estabilizante, sendo agente de aeração e emulsificante (BINSI et al., 2009). A carboximetilcelulose (CMC) é um hidrocolóide obtido através da reação entre a celulose e o monocloroacetato de sódio, tendo como principal característica a capacidade de formar géis. Devido as suas propriedades, tais como: capacidade de retenção de água, solubilidade em água fria e quente, aumento da viscosidade da solução, resistência a óleos, gorduras e solventes orgânicos, adesividade e habilidade para formar filmes, o CMC possui uma ampla aplicação na formulação de muitos produtos alimentícios (KÄISTNER, 1996). Portanto, o objetivo deste trabalho foi avaliar a influência do pH e concentração de proteína na formação de complexos coacervados formados entre a gelatina do tipo A e o carboximetilcelulose de média viscosidade através da turbidez e diâmetro de partícula.
Material e métodos
MATERIAL A gelatina do tipo A desidratada (G2500) e a carboximetilcelulose de média viscosidade (C4888-500) foram obtidas a partir da empresa Sigma- Aldrich (St. Luis, USA). Neste experimento foram utilizados reagentes analíticos e água deionizada (ORG 3000, Ideoxima, São Paulo, Brasil). MÉTODOS Preparo das soluções: A carboximetilcelulose foi pesada em balança analítica (Adventurer AR 2140, Ohaus, Nova Jersey, EUA) para preparo de uma solução contendo concentração fixa de 0,1% m/m e solubilizada em água deionizada, utilizando agitador magnético (TE-0851, Tecnal, São Paulo, Brasil) durante 3 horas. Diferentes concentrações de proteína foram previamente pesadas para preparo de soluções contendo: 0,1, 0,2, 0,3 e 0,5% m/m, sendo assim, a proporção proteína / polissacarídeo variou de 1:1 à 5:1, sendo 1 parte de proteína para uma parte de polissacarídeo até 5 partes de proteína para uma parte de polissacarídeo, respectivamente. Titulação turbidimétrica: A turbidez dependente do pH foi avaliada com o auxílio de um espectrofotômetro (SP-2000, Bel Photonics, São Paulo, Brasil) em um comprimento de onda de 540 nm, seguindo a metodologia de Weinbreck et al. (2004). O espectrofotômetro foi calibrado para 100% de transmitância com água deionizada. A turbidez foi definida como: T= -In(I/I0) sendo I a intensidade da incidência da luz e I0 a intensidade da luz que passou pela amostra. A solução contendo a definida razão de proteína / polissacarídeo teve seu pH ajustado com HCl, 0,5 mol/L e NaOH 0,25 mol/L, com o auxílio de um agitador magnético. Após a adição de uma pequena gota de HCl, o pH desta solução foi monitorado com auxílio de um pHmetro de bancada (DM 22, Digimed, São Paulo, Brasil) e em seguida um alíquota de 2 mL foi retirada para aferição do valor de turbidez. Todas estas titulações foram aferidas em temperatura ambiente (aproximadamente 25 ºC) com quatro replicatas, sendo o intervalo entre as aferições de aproximadamente 1 minuto. Diâmetro de partícula As análises de diâmetro partícula foram realizadas com auxílio do instrumento Zetasizer nano (Nano-ZS, Malvern Instruments, Worcestershire, Reino Unido). As amostras foram acondicionadas e analisadas em função do pH (7,0 – 1,0). Microscopia óptica A fase líquida superior das amostras foi removida com uma pipeta e posteriormente foi obtida uma alíquota de 200 μl do precipitado para ser observado por meio de um microscópio óptico (Eclipse E-200, Nikon, Tóquio, Japão) amplificado 40x com câmera acoplada (Evolution VF, MediaCybernetics, Pensilvânia, EUA).
Resultado e discussão
Observando a Figura 1A podemos perceber que o pH e a concentração de
proteína possuem forte influência na interação entre a proteína e o
polissacarídeo. Os dados sugerem que quanto maior a concentração de
proteína, menor era a turbidez indicando a menor interação entre os
polímeros, ou seja, uma concentração de 0,1 % GE, com mesma proporção do
polissacarídeo, é suficiente para saturar as moléculas do mesmo, como também
foi observado por Weinbreck et al. (2003) que ao avaliar a formação de
complexos coacervados entre o isolado proteico do soro de leite (WPI) e a
goma arábica, observou que conforme foi aumentada a concentração de proteína
e consequentemente a concentração total dos biopolímeros no sistema,
observou a diminuição da formação de complexos coacervados. Segundo Priftis
e Tirrell (2012) quando a concentração da proteína está em excesso, sugere-
se que as moléculas que não se ligaram ao polissacarídeo, estejam solúveis
na solução superando a quantidade de moléculas ligadas, logo, não sendo
capaz de proporcionar o aumento da turbidez.
Abaixo do pH 9,0 observamos um aumento gradativo da turbidez, sendo
este pH denominado como pHc (pH crítico) onde ocorre a fase de formação de
complexos solúveis. Estes complexos solúveis são formados próximos ao PI da
proteína (FUJIMOTO et al., 2002), onde ocorre fraca interação eletrostática
e alta carga líquida entre os biopolímeros, enquanto na fase de coacervado
existe forte interação eletrostática e baixa carga líquida (MCCLEMENTS et
al., 2009). Próximo ao pH 5,5 ocorre um aumento abrupto da turbidez, e a
solução passou do aspecto transparente ao turvo (pHØ1). Esta fase é
conhecida pelo surgimento da fase de coacervado ou de separação de fases,
onde o polissacarídeo apresenta-se com cargas negativas e a proteína com
carga positiva, ocorrendo interação eletrostática e formação de
macromoléculas (TURGEON et al., 2003; DE KRUIF et al., 2004). Próximo ao pH
4.0, a turbidez apresentou seu valor máximo tornando a solução completamente
turva. O aumento da turbidez indica a formação de uma suspensão coloidal
aparentemente estável de biopolímeros suficiente para promover a dispersão
de luz (BENGOECHEA, JONES, et al., 2011). Próximo ao pH 2,0 iniciou-se o
processo de dispersão da fase de complexado acarretando na diminuição da
turbidez (pHØ2). Neste pH a proteína e o polissacarídeo não apresentam
cargas opostas o que cessaria a interação eletrostática. Resultados
similares foram observados por Bengoechea, Jones, et al. (2011) e Weinbreck
et al. (2003)ao avaliarem a formação de complexos coacervados entre
lactoferrina/pectina e WPI/goma arábica, respectivamente, observando um
aumento máximo da turbidez próximo ao pH 4,0 e ocorrendo a diminuição
abrupta da mesma próximo ao pH 2,0.
Na Figura 1B podemos reafirmar a forte influência do pH através do
diâmetro de partícula das amostras. Abaixo do pH 6,0 observamos um
significativo aumento do diâmetro caracterizado pelo início da interação
eletrostática entre a proteína e o polissacarídeo, apresentando os maiores
diâmetros de partícula próximo ao pH 4,0, onde pudemos observar
anteriormente os maiores valores de turbidez. Com a acidificação do meio,
próximo ao pH 3,0, observamos um decréscimo nos valores de diâmetro de
partícula e abaixo do pH 2,0 as partículas possuem diâmetro aproximado aos
valores apresentados no pH 7,0, pH em que não ocorre a formação de
precipitados insolúveis. O índice de polidispersão que fornece informações
sobre a homogeneidade da distribuição das partículas na amostra foi abaixo
de 0,2, o que indica a formação de sistemas monodispersos (SOUZA et al.,
2012). Na Figura 2A podemos observar as mudanças visuais da turbidez em
relação ao pH das amostras na proporção 1:1 GE/CMC.
Através da microscopia óptica das amostras contendo 1:1 GE/CMC no pH 4,0
(Figura 2B) podemos observar cápsulas globulares apresentando estrutura
homogênea, contendo núcleo único na fase polimérica. Apesar dos mecanismos
para identificação dos biopolímeros nos processos de coacervação não estarem
bem elucidados, sugere-se que a carboximetilcelulose tenha formado uma
camada ao redor da proteína, devido a capacidade natural dos polissacarídeos
de encapsulação (AUGUSTIN e HEMAR, 2009).
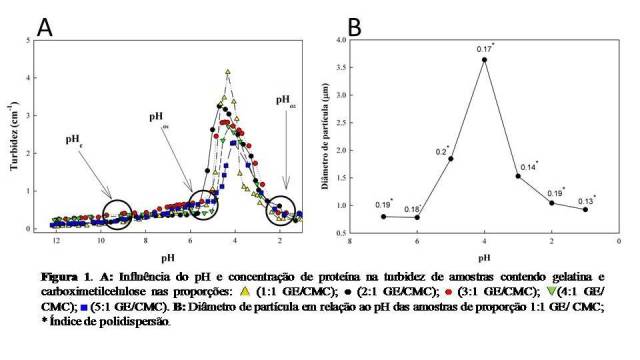
Turbidez das diferentes proporções em função do pH e concentração de GE e diâmetro de partícula da proporção 1:1 em função do pH.
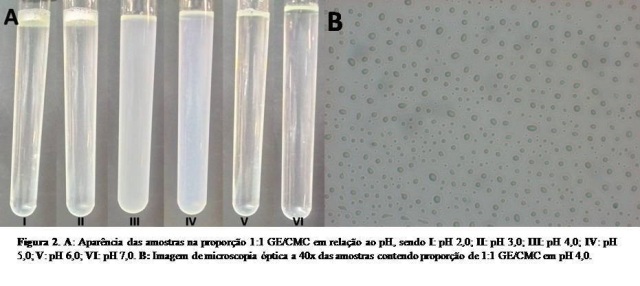
A: Aparência das amostras na proporção 1:1 GE/CMC em relação ao pH; B: Imagem da microscopia óptica dos coacervados na proporção 1:1 GE/CMC, pH 4,0.
Conclusões
Este estudo demonstrou que a interação entre a gelatina e a carboximetilcelulose pode resultar na formação de complexos solúveis ou insolúveis em função do pH e da concentração de proteína. Através dos valores de turbidez e diâmetro de partícula verificamos que menores concentrações de proteína (0,1 %) em igual proporção ao polissacarídeo propiciaram melhor formação de coacervado, sendo estes caracterizando por microcápsulas de núcleo único e homogêneo. O pH exerceu forte influência na interação entre os polímeros, havendo maior interação abaixo do ponto isoelétrico da proteína, caracterizando uma interação eletrostática. Os coacervados formados entre a gelatina e a carboximetilcelulose podem ser uma alternativa para incorporação de ingredientes funcionais em diferentes sistemas alimentares, bem como para controlar aspectos macroscópicos dos alimentos, aplicando as funcionalidades de dois diferentes polímeros em uma mesma estrutura.
Agradecimentos
Referências
AUGUSTIN, M. A.; HEMAR, Y. Nano- and micro-structured assemblies for encapsulation of food ingredients.Chemical Society Reviews, v. 38, n. 4, p. 902-912, 2009.
BENGOECHEA, C.; JONES, O. G.; GUERRERO, A.; MCCLEMENTS, D. J. Formation and characterization of lactoferrin/pectin electrostatic complexes: Impact of composition, pH and thermal treatment. Food Hydrocolloids, v. 25, n. 5, p. 1227-1232, 2011.
BINSI, P. K.; SHAMASUNDAR, B. A.; DILEEP, A. O.; BADII, F.; HOWELL, N. K. Rheological and functional properties of gelatin from the skin of Bigeye snapper fish: Influence of gelatin on the gel-forming ability of fish mince. FoodHydrocolloids, v. 23, p. 132-145, 2009.
CAPITANI, C. D.; PACHECO, M. T. B.; PILOSOF, A. M.; PÉREZ, O. E. Caracterização e comportamento dinâmico dos complexos de carboximetil celulose com proteínas do soro de leite. Brazilian Jornal of Food Technology, v. 3, p. 29-35, 2006.
DE KRUIF, C. G.; WEINBRECK, F.; DE VRIES, R. Complex coacervation of proteins and anionic polysaccharides.CurrentOpinion in Colloid& Interface Science, v. 9, n. 5, p. 340-349, 2004.
FUJIMOTO, J.; DE OREIS, E.; PETRI, D. F.; FILHO, S. Formação de multicamadas de polissacarídeos e proteína. Química Nova, v. 25, n. 5, p. 757-761, 2002.
HUANG, G.Q.; SUN, Y.T.; XIAO, J.X.; YANG, J. Complex coacervation of soybean protein isolate and chitosan.Food Chemistry, v. 135, p. 534–539, 2012.
KÄISTNER, U., HOFFMANN, H., DÖNGES R. AND HILBIG, J. Structure and solution properties of sodium carboxymethyl cellulose.Colloids Surfaces A: Physicochem. Eng. Asp, v.123-124, p.307-328, 1997.
LINDHOUD, S.; DE VRIES, R.; NORDE, W.; STUART, M. A. C. Structure and stability of complex coacervate core micelles with lysozyme. Biomacromolecules, v. 8, n. 7, p. 2219-2227, 2007.
MCCLEMENTS, D. J.; DECKER, E. A.; PARK, Y.; WEISS, J. Structural design principles for delivery of bioactive components in nutraceuticals and functional foods. Critical Reviews in Food Science and Nutrition, v. 49, n. 6, p. 577-606, 2009.
PRIFTIS, D.; TIRRELL, M. Phase behaviour and complex coacervation of aqueous polypeptide solutions.Soft Matter, v. 8, n. 36, p. 9396, 2012.
RIX, A. Gelling and whipping agents. In Jackson, E. B. Sugar Confectionery Manufacture. New York: Van Nostrand Reinhold, Glasgow; Blackie, 1990.
SILVA, B. C.; OLIVEIRA, M.; FERREIRA, J. G. L.; SIERAKOWSKI, M. R.; SIMAS-TOSIN, F. F.; ORTH, E. S.; RIEGEL-VIDOTTI, I. C. Polyelectrolyte complexes from gum arabic and gelatin: Optimal complexation pH as a key parameter to obtain reproducible microcapsules. Food Hydrocolloids, v. 46, p. 201-207, 2015.
SOUZA, P. M. S., LOBO, F. A., ROSA, A. H.; FRACETO, L. F. Development of nanocapsules of poly-ε-caprolactone containing herbicide atrazine.Química Nova, 35, 132-137, 2012.
TURGEON, S. L.; SCHMITT, C.; SANCHEZ, C. Protein–polysaccharide complexes and coacervates.Current Opinion in Colloid & Interface Science, v. 12, n. 4-5, p. 166-178, 2007.
WEINBRECK, F.; DE VRIES, R.; SCHROOYEN, P.; DE KRUIF, C. Complex coacervation of whey proteins and gum arabic. Biomacromolecules, v. 4, n. 2, p. 293-303, 2003.
WEINBRECK, F.; NIEUWENHUIJSE, H.; ROBIJN, G. W.; DE KRUIF, C. G. Complexation of whey proteins with carrageenan. Journal of Agricultural and Food Chemistry, v. 52, n. 11, p. 3550-3555, 2004.


















