ISBN 978-85-85905-15-6
Área
Alimentos
Autores
Santos, W.G.S. (UNEMAT) ; Leão, M.F. (UNEMAT E UFRGS) ; Mello, I.S. (UNEMAT) ; Martins, A.M. (UNEMAT) ; Bisinoto, J.M. (UNEMAT)
Resumo
O objetivo do estudo foi analisar a contribuição da enzima pectinase em diferentes concentrações na elaboração de bebida alcoólica fermentada de jabuticaba quanto a seus aspectos organolépticos. Foram realizadas análises físico-químicas e microbiológicas, além da verificação do crescimento da levedura no final da fermentação, visando avaliar a qualidade do produto obtido a partir deste fruto. Os resultados demonstraram que quanto menor a quantidade de pectinase adicionada, melhor é o fermentado produzido. Assim, a formulação com apenas 2 mL de enzima produz menos acidez no produto formado, sendo considerado o melhor resultado. As demais análises (carboidrato, pH, turbidez) confirmaram que a formulação 1% (2 mL) de pectinase se comporta melhor na produção de bebidas fermentadas deste fruto.
Palavras chaves
Jabuticaba; Pectinase; Fermentado
Introdução
Na produção de bebidas alcoólicas algumas frutas do cerrado se destacam por possuir “boa qualidade sensorial”, e mesmo que não tenham uma produção em grande escala no Brasil, podem também favorecer o crescimento econômico para pequenos produtores rurais. Rodrigues (2011) destaca a jabuticaba como um fruto “típico do cerrado com propriedades sensoriais, funcionais e antioxidantes”. Por ser um fruto também muito doce e por ser proveniente de locais tropicais, há uma grande produção e sua industrialização vem crescendo cada vez mais. A jabuticaba é conhecida por seu formato arredondado de cor preta e com um sabor doce, assim ocasionando uma boa apreciação do produto natural ou transformado em algum subproduto. A jabuticaba apresenta em sua composição vitamina C com valores médios de 23 mg por 100 g de polpa e minerais, em que se destacam o ferro, cálcio, fósforo e potássio (OLIVEIRA et al., 2003). Sendo o principal componente da polpa de jabuticaba a água com 86,72% da massa total, em média. Os sólidos totais perfazem 13,28%, sendo que destes, 1,91% correspondem aos sólidos insolúveis e 11,37% correspondem aos sólidos solúveis (CHIARELLI, NOGUEIRA e VENTURINI FILHO, 2005). É rica em nutrientes e principalmente em açúcar. Sua casca fina e polpa grossa fazem com que o rompimento seja facilitado na casca, isso pela quantidade de sólidos solúveis compostos pela fruta gerando um problema que é a pequena vida de prateleira do fruto in natura (OLIVEIRA et al., 2003). Existe a necessidade de se desenvolver novos fermentados para diminuir a perda de jabuticaba, por ter uma curta vida de prateleira (ASQUIERI et al., 2004). Conforme o Decreto nº 6.871, de 04 de junho de 2009 do Ministério da Agricultura, Pecuária e do Abastecimento (MAPA) regulamentado pela Lei nº 8.918, de 14 de julho de 1994, “fermentado de frutas é a bebida com graduação alcoólica de quatro a quatorze por cento em volume, a vinte graus Celsius, obtida da fermentação alcoólica do mosto de fruta sã, fresca e madura.” (BRASIL, 2009, p. 20). A principal etapa da elaboração de bebidas fermentadas alcoólicas é a fermentação, realizada na maioria das vezes por leveduras da espécie Saccharomyces cerevisiae (IVORRA et al., 1999). O etanol é o principal produto resultante da fermentação e um dos mais importantes componentes de uma bebida fermentada alcoólica. Durante a fermentação, alguns compostos além do etanol como o gás carbônico e glicerol, são produzidos pela levedura em concentrações mínimas e também são importantes para aspectos característicos de bebidas fermentadas pois alteram o sabor e o aroma, tendo como responsáveis os aldeídos, alcoóis superiores e ácidos orgânicos. A presença de outros metabólitos diminui a qualidade dos fermentados alcoólicos causando a formação de odores desagradáveis, como o gás sulfídrico, ácido acético e mercaptanas (DIAS et al., 2010). Para o auxílio da obtenção de uma bebida fermentada com melhores propriedades, a enzima pectinase é bastante utilizada na industrialização desse produto por ser responsável em degradar as substâncias pécticas, aquelas que geram a forma gelatinosa em frutos com isso algumas características tornam a bebida fermentada com melhor aparência e sabor (UENOJO, 2007). As pectinases são produzidas por plantas, fungos filamentosos, bactérias e leveduras. Tem função de despolimerizar ou desesterificar compostos pécticos através da hidrólise das interações glicosídicas ao longo da cadeia carbônica. Essas enzimas são muito utilizadas em indústrias de processamento de frutos por ter um papel no amadurecimento, na clarificação e diminuição da viscosidade dos frutos. Utilizada também na fermentação de chás, auxilia no processamento da polpa de tomate, enriquecimento proteico de alimentos infantis processamento de óleos essenciais e indústrias vinícolas (UENOJO, 2007). Essas enzimas foram as pioneiras a serem utilizadas no comércio de processamento de vinhos e sucos de frutas em meados de 1930 (BATH, 2000, KASHYAP, KAUL e TEWARI, 2000) e apenas na década de 60 os pesquisadores descobriram como utiliza-las de forma mais eficiente, (KASHYAP e KAUL e TEWARI, 2000). A presença de pectinase com maiores atividades de pectina liase e menores atividades pectina metil esterase são mais viáveis, pois têm a capacidade de diminuir a liberação de metanol doas ácidos poligalactuônicos metilados durante o processamento de vinho (JAIANY, SAXENA e GUPTA, 2005). Para que se produza bebidas fermentadas de frutas as moléculas estruturais da parede celular necessitam de transformação em um princípio de semi-fluído, com presenças de paredes celulares suspensas em um líquido citoplasmático. Enzimas são utilizadas para hidrolisar moléculas estruturais de pectina e hemicelulases. A pectina presente nas frutas gera uma ampliação na viscosidade, dificultando a filtração e reduzindo o rendimento (MAHLER, 1997). Problema este que pode ser solucionado pela adição da enzima do tipo pectinase (LANZARINI e PIFERI, 1989).
Material e métodos
A preparação da bebida fermentada alcoólica foi realizada no Laboratório de Processamento de Alimentos da Universidade do Estado de Mato Grosso, em Barra do Bugres-MT. Os frutos foram adquiridos em chácaras de alguns produtores na região. Adaptado de Olivier et al. (2008), as jabuticabas foram coletadas e congeladas durante 4 dias. Imergiu-se as frutas em água para higienização e sanitização com adição de hipoclorito de sódio 15 ppm durante 15 min. Colocou-se em um recipiente e maceradas manualmente durante 40 min. A filtragem foi feita com auxílio de uma peneira retirando as cascas e as sementes. Utilizando o refratômetro mediu-se o Brix do mosto obtendo o resultado de 12,5 ºBrix. Efetuou-se a chaptalização do mosto para 18,5 ºBrix, utilizando 120 g de açúcar tipo cristal. Para a eliminação de possíveis contaminações no mosto, aqueceu-se as amostras a 75 ºC, logo resfriou-se a 30 ºC. Dividiu-se 200 mL para cada fermentador, utilizando um béquer de 500 mL e um funil. Com auxílio de uma balança de precisão e um béquer de 10 mL, pesou-se 1 g de levedura Saccharomyces cerevisiae e adicionou nos fermentadores A, C, D, E, F, e G. Resfriou-se o mosto nos fermentadores a 15 ºC dentro de um refrigerador e logo após, com auxílio de uma pipeta, adicionou-se a enzima pectinase com as formulações: 5% na amostra B, 1%, 2%, 3%, 4% e 5%, respectivamente para amostras C, D, E, F e G. A enzima foi adquirida através da empresa FARINATECH, que fica no estado de Santa Catarina. É uma enzima com atividade pecnolítica. Utilizou-se 7 garrafas polietileno transparentes de 500 mL, tampas com o furo de aproximadamente 0,25 cm de diâmetro e soro elástico de 30 cm, tudo esterilizado a 100 ºC durante 15 min. Montou-se os fermentadores passando o soro elástico dentro da tampa, ficando 1 cm na parte interior da garrafa e o restante para ser posteriormente colocado em um erlenmeyer com água para a conversão de CO2 em ácido carbônico. Para a não interferência da luz na fermentação solar, as garrafas foram embaladas com papel alumínio. Permaneceu acondicionado durante 10 dias. Após esta etapa, 20 mL de cada amostras foi colocada em tubos e levada a centrifugação durante 5 min. A parte líquida foi passada para os tubos de vidros, e a carga de levedura suspensa foi levada ao secador, onde permaneceu por uma hora. Foram pesadas e feitas a determinação do peso da levedura presente no fermentado descontando o peso dos tubos. Para analisar a composição físico-química das bebidas fermentadas obtidas foram analisadas as seguintes características: acidez titulável, pH, º Brix, teor alcoólico, contagem de levedura e turbidez. As análises foram feitas no Laboratório de Química da UNEMAT de Barra do Bugres, conforme a metodologia descrita do Instituto Adolfo Lutz (2008). A determinação da presença ou ausência de Coliformes e Salmonella spp (BRASIL, 2006) no mosto de fermentado de jabuticaba antes da fermentação foram feitas no laboratório de análises microbiológicas da empresa Barralcool.
Resultado e discussão
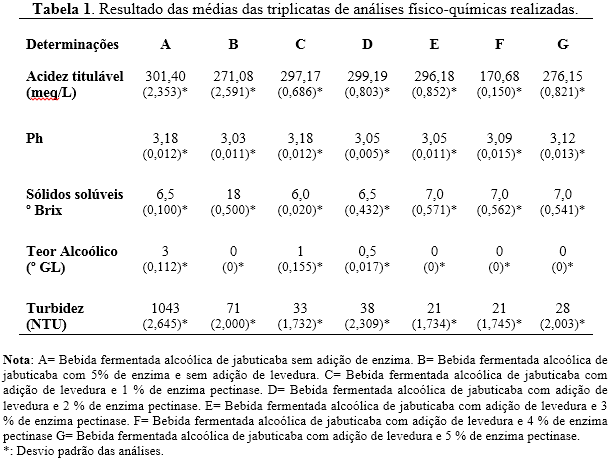
Na Tabela abaixo está expressa os valores obtidos das análises físico-
químicas obtidas referentes a acidez titulável, pH, sólidos solúveis, teor
alcoólico e turbidez. Referente à acidez titulável, os padrões exigidos pela
legislação para vinhos de mesa, permitem um conteúdo mínimo de 55 meq/L e
máximo de 130 meq/L (BRASIL, 1988). No fermentado de doce de jabuticaba, foi
encontrado 106,3 meq/L (ASQUIERI et al., 2004), muito baixo comparado ao
valor do fermentado alcoólico de jaca, em que a acidez foi de 220 meq/L
(ASQUIERI, RABÊLO e SILVA, 2008). O mais semelhante foi o encontrado para
fermentado de jabuticaba, mas sem adição de enzima pectinase, com valor de
210 meq/L (CHIARELLI, NOGUEIRA e VENTURINI FILHO, 2005). A acidez titulável
do fermentado alcoólico está fora do padrão da legislação para vinhos, que é
de 55 a 130 me/L, mas está próximo dos valores encontrados por Silva et. al.
(2008). O valor encontrado pode ter influência do crescimento de bactérias
que produzam ácido acético, sendo que essas se encontram bem adaptadas em
condições de produção de bebida fermentada de frutos (VARNAM e SUTHERLAND,
1997). O níveis de pH das amostras são considerados ácidos e mantiveram nos
intervalos de 3,03 a 3,18, sendo resultados agradáveis para a não
contaminação por bactérias pois essas são sensíveis esses níveis de pH.
Valores de pH acima de 4,5 apresentam elevado risco o crescimento de
microrganismos patogênicos como Yersinia enterocolítica, Listeria
monocytogenes, Salmonella spp., E. Coli, dentre outros (JAY, 2005). Todos os
valores encontrados de pH estão próximos dos valores obtidos por alguns
autores que produziram bebidas fermentadas. A bebida fermentada de jaca
feita por Assis Neto et al. (2010) obtiveram resultados de pH de 3,8, Lopes
e Silva (2006) fabricaram uma bebida fermentada de figo com valor de pH a
3,8, Portz e Mendonça (2002) obtiveram resultados de 3,6 para um vinho misto
de goiaba e taperebá. Os teores de sólidos solúveis da bebida fermentada B,
obteve valor de 18 ºB, valor este considerado alto ocorrido por não ser
adicionada levedura nesta amostra, adicionado apenas a enzima pectinase.
Segundo Hashizume (2001), para alcançar uma boa quantidade de pectina é
necessário fazer uma boa maceração para sua maior obtenção e quanto mais
pectina, maior o seu trabalho em conversão. A formulação A, não houve adição
de enzima e a conversão de açúcares para etanol foi realizada apenas pela
levedura. Nas demais formulações houve um aumento de sólidos solúveis
conforme foi elevando a quantidade de enzima adicionada. Em todas as
formulações houve um decréscimo considerável na fermentação. A amostra que
mais foi identificado álcool, foi na amostra A, apenas com adição de
levedura. O valor obtido foi de 3 °GL. A amostra C obteve valor de 1 °GL,
amostra D com 0,5 °GL e as outras amostras foi detectado apenas traços de
presença de etanol. Todos os valores obtidos pela fermentação da bebida de
jabuticaba obtiveram valores muito abaixo quando comparado com outras
pesquisas encontradas na literatura. Corazza et al. (2001) estudaram a
produção de fermentado de laranja a partir do suco integral chaptalizado até
26 °Brix. A bebida obteve características de 10,6 ºGL e 7,0 °Brix, valores
aproximados aos do vinho tinto (10,3 °GL e 6,5 °Brix), constatando a
referente facilidade na fermentação feita por leveduras selecionada. Os
valores de turbidez foram surpreendentes. Houve uma notável diferença entre
as amostras com adição da enzima pectina com a amostra sem adição de enzima.
O processo de centrifugação aumentou ainda mais a perceptividade dos
resultados, reduzindo a carga de levedura e cargas vegetais ainda presentes
no fermentado. As amostras apresentaram diferenças em sua cor e viscosidade,
onde as com maior porcentagem de enzimas ficaram menos viscosas e com
coloração mais leve, e a amostra que não foi adicionada enzima, apresentou
cor mais opaca. Com relação à turbidez, a pectinase adicionada nas amostras
hidrolisou alguns compostos que causam a suspensão no vinho. Esses
hidrolisados foram os sólidos suspensos e também partículas coloidais que
causam um efeito de “opaco” por fazer o desvio da refração da luz em seu
meio. Substâncias péctica, também influenciam na turbidez e viscosidade das
bebidas, pois são responsáveis pela gelatilização, e no caso das
jabuticabas, estão presentes em grandes quantidades nas cascas e quando
ocorre a maceração elas são liberadas. A enzima com atividade pectolítica
hidrolisa essas moléculas reduzindo assim a viscosidade e a turbidez do
fluido. Comparando esses resultados com os obtidos para esse trabalho, nota-
se que para todos os fermentados de jabuticaba com adição de enzima foi
insatisfatório comparado ao alcançado pela Zortea (2011), em que os seus
resultados finais após a filtragem foram melhores tornando seu método
eficiente. Mas pensando no fato que esta veio a analisar vinhos prontos, que
possivelmente já passaram por alguma clarificação antes de serem
comercializados, alguns desses valores tonam-se compatíveis aos obtidos
neste trabalho. Os dados encontrados demonstram que a amostra C apresentou-
se melhor quando estudada em referente ao teor de ácidos voláteis, sendo a E
sendo a segunda e a G, a menos propícia para comportamentos de bebidas
fermentadas. Pois quanto menor este teor de acidez volátil melhor é o
produto formado. Pode-se notar também que quando menor o teor de pectinase
no sistema fermentativo melhor se torna o processo. Também é justo também
relacionar que a quantidade de mosto e o ambiente, volume, temperatura podem
influenciar no catalisador, já que esta enzima tende a acelerar a
fermentação. Com isso quando colocada em excesso no meio podem ser formados
outros componentes químicos no meio reacional não interessante para o
processo de bebidas, como por exemplo, ácido acético e os ácidos butíricos e
butanóicos. Isso se deve ao fato de que o vinho está contido por água, como
seu constituinte maior, álcool etílico e por cerca de 200 componentes, que
se destacam os ácidos orgânicos. Sendo ele o ácido málico, tartárico,
cítrico, acético, propanóico, carbônico e outros. A acidez do vinho divide-
se por acidez total, acidez fixa e acidez volátil destacados por Castilhos e
Del Bianchi (2011). E os ácidos voláteis presentes são os ácidos acéticos,
propanóicos e butanóicos. Estes são produzidos por reações químicas que
ocorrem durante a maturação dos fermentados e serve como um indicador de sua
qualidade como destacado por Clark et al, (2006). Quanto ao crescimento da
levedura Sacharomices cerivasie a amostra A que continha somente levedura
sem adição da enzima demonstrou mais crescimento da mesma durante o processo
de fermentação. Já a amostra B que continha somente pectinase sem a levedura
pode ter formado extrato de fermentação, mas não propriamente houve
fermentação a partir da Saccharomices cerivasie. A amostra D com 2% de
pectinase demonstrou o maior teor de multiplicação da levedura adicionada
para o processo de fermentação, sendo D>E>C>G>F, nas amostras quando
adicionadas pectinase e levedura. Não foi constatado nenhum crescimento de
Coliformes e Samonella no mosto de fermentado de jabuticaba sendo que este
se encontra dentro das normas de regulamento técnico para a fixação dos
padrões de identidade e qualidade para fermentado de fruta (MAPA, 2008).
Segundo Coultate (2004) fatores que influenciaram para os resultados serem
negativos na contagem de contaminantes é que a maioria dos microrganismos
tem sua reprodução danificada na presença de meio ácido e com valores de pH
baixos, como ocorreu com o mosto de fermentado de jabuticaba. Conforme
relata Nascimento, Nunes e Nunes (2011), a segurança microbiológica ainda é
garantida pelo tratamento térmico dado ao produto. O que ocorreu no
procedimento de preparo, em que o mosto foi aquecido até 75 °C para
eliminação dos microrganismos assim como o processo de sanitização, eficaz
contra o crescimento principalmente de coliformes.
Análises físico-químicas da bebida fermentada elaborada acidez titulável, pH, sólidos solúveis (°Brix), teor alcoólico (°GL) e turbidez.

A ilustração mostra a degradação de cor que ocorreu por influencia da enzima pectinase adicionada no mosto.
Conclusões
A bebida fermentada de jabuticaba elaborada obteve características ácidas e baixo teor de etanol por meio de uma possível conversão de metanol para aldeído, interferindo na qualidade final do produto. O meio de sulfitagem seria uma opção para evitar a ocorrência dessa anomalia, fazendo com que ocorra uma seleção apenas de leveduras que converte açúcares em metanol. A quantidade de enzima interferiu para a também ocorrência desse problema, sendo proposto que faça dosagem de quantidades menores e maiores estudos para a interação que ocorre entre fermentação e a atividade pectolítica. O baixo pH esteve dentre os valores encontrados nas literaturas, não sendo identificado nenhum problema quanto a esse parâmetro. O valor contido ainda foi satisfatório para a redução dos riscos de crescimento de Coliformes totais e Salmonella. Quanto as propriedades visuais de cor e turbidez, as enzimas se demonstraram eficazes na clarificação das bebidas, tornando-as mais brilhosas a cada amostra com níveis mais altos de pectinase. Para que ocorra ainda maior extração de pectina da jabuticaba, é necessário também que aumente a maceração do mosto, liberando também os compostos fenólicos contidos nas cascas da jabuticaba, responsáveis pelas propriedades de cor, sabor e odor dos frutos. Aos parâmetros microbiológicos, não houve contaminação por bactérias patógenas, comprovando a eficácia dos procedimentos de sanitização e aquecimento do mosto para eliminação desses microrganismos. Conclui-se então que a enzima pectinase tem influência na redução da coloração, turbidez e viscosidade do vinho. A quantidade excessiva de enzima influencia na eficiência da fermentação na conversão de etanol. A análise de acidez volátil demonstrou que a amostra com apenas 1% de pectinase se mostrou com menos excesso de acidez frente às demais. Pelas análises realizadas, a amostra que levemente se adequou as normas e as literaturas, foi à contida com porcentagem de 1% de enzima.
Agradecimentos
Agradecemos ao apoio recebido dos familiares, à UNEMAT pela formação que recebemos e à Usina Barrálcool que gentilmente viabilizou a realização das análises microbiol
Referências
ASQUIERI, E. R.; DAMIANI, C.; CANDIDO, M. A.; ASSIS, E. M. Vino de jabuticaba (Myrciaria cauliflora Berg): Estudio de las características físicoquímicas y sensoriales de los vinos tinto seco y dulce, fabricados com la fruta integral. Alimentaria, n. 355, p. 111-122, 2004.
ASSIS NETO, E. F., BRAGA, A. C. C., SOUZA, J. H. P. Elaboração de bebida alcoólica fermentada de jaca (Artocarpus heterophyllus Lam.). Revista brasileira de tecnologia agroindustrial. Ponta Grossa - Paraná. ISSN: 1981-3686 / v. 04, n. 02: p. 186-197, 2010.
BRASIL. Decreto n. 6.871 de 4 de junho de 2009 regulamenta a lei n. 8.918 de 14 de Julho de 1994, que dispõe sobre a padronização, a classificação, o registro, a inspeção, a padronização e a fiscalização de bebidas. Diário Oficial da República Federativa do Brasil, Brasília, DF, 5 de jun. 2009. p. 20.
BRASIL. Padrões Microbiológicos Sanitários Para Alimentos do Regulamento Técnico aprovado revogada(o) por: Resolução RDC nº 171, de 04 de setembro de 2006. Disponível em: <http://portal.anvisa.gov.br/wps/wcm/connect/a47bab8047458b909541d53fbc4c6735/RDC_12_2001.pdf?MOD=AJPERES>. Acesso em: 12 jul. 2013.
CASTILHOS M. B. M, e DEL BIANCHI, V. L. Caracterização físico-química e sensorial de vinhos brancos da região noroeste de são paulo. Universidade Estadual Paulista “Júlio de Mesquita Filho” (UNESP). Revista Holos. São José do Rio Preto/SP, 2011.
CHIARELLI, C. H. R.; NOGUEIRA, P. M. A.; VENTURINI FILHO, W. G. Fermentados de Jabuticaba (Myrciaria cauliflora Berg): Processos de produção, características e rendimento. Brazilian Journal of Food Technology, v. 8, n. 4, p. 277-282, 2005.
CLARK, S.; BARNETT, N.W.; ADAMS, M.; COOK, I.B.; DYSON, G.A.; JOHNSTON, G. Monitoring a commercial fermentation with proton nuclear magnetic resonance spectroscopy with the aid of chemometrics. Analytica Chimica Acta 563: 338–345, 2006.
CORAZZA, M. L.; RODRIGUES, D. G.; NOZAKI, J. Preparação e caracterização do vinho de laranja. Química Nova, São Paulo, v. 24, n. 4, p. 449-452, 2001.
COULTATE, T. P. Alimentos: a química de seus componentes. 3 ed. São Paulo: Artmed, 2004.
DIAS, D. R.; PANTOJA, L.; SCHWAN, R. F. Fermentados de frutas. In: FILHO, W. G. V. Bebidas alcoólicas: Ciência e tecnologia – Vol. 1. 1. ed. São Paulo: Editora Edgard Blücher, 2010. p. 85-111.
DIAS, D. R.; SCHWAN, R. F.; LIMA, L. C. O. Metodologia para elaboração de fermentado de cajá (Spondias mombin L.). Ciência e Tecnologia de Alimentos, v. 23, n. 3, p. 342-350, 2003.
HARRISON, J., S. Yeast production. Progress in industrial microbiology. London, Colchester and Beccles, Cap. 4, p. 129-178, 1971.
HASHIZUME, T. Fabricação de Vinhos de Frutos – Manual Prático. 1. ed. Ital: Campinas. 2001, 9 p.
INSTITUTO ADOLFO LUTZ. Normas Analíticas do Instituto Adolfo Lutz: Métodos químicos e físicos para análise de alimentos. 4.ed. São Paulo: IAL, 2008.
JAY, J. M. Microbiologia de Alimentos. 6. ed. Traduzido por: Eduardo Cesar Tondo [et al.]. Porto Alegre: Artmed, 2005.
JAYANI, R. S.; SAXENA, S.; GUPTA, R. 2005. Microbial pectinolytic enzymes: A review. Process Biochemistry,2005. 40:2931-2944.
LOPES, V. V. R; SILVA, F. L. H. Elaboração de fermentados a partir do figo-da-india. Revista de Biologia e Ciências da Terra. ISSN 1519-5228. 2006.
MAEDA, R. N.; ANDRADE, J. S. Aproveitamento do camu-camu (Myrciaria dúbia) para produção de bebida alcoólica fermentada. Acta Amazônica. v. 33, n. 3, p. 489-497, 2003. Disponível em: <http://dx.doi.org/10.1590/S0044-59672003000300014>. Acesso em 20 de Nov. de 2013.
MAPA. Ministério de Agricultura, Pecuária e Abastecimento. Regulamenta a Lei no 8.918, de 14 de julho de 1994, que dispõe sobre a padronização, a classificação, o registro, a inspeção, a produção e a fiscalização de bebidas. Diário Oficial, 2009.
NASCIMENTO, A. M. do C. B. do; NUNES R. G. F. L.; NUNES L. A. P. L. Elaboração e avaliação química, biológica e sensorial de conserva de maxixe (Cucumis Anguria L.). ACTA Tecnológica, Vol. 6, nº 1, p. 123-136, Jan/Jun. 2011.
OLIVEIRA, L. A. et al. Caracterização tecnológica de jabuticabas ´Sabará´ provenientes de diferentes regiões de cultivo. Revista brasileira de Fruticultura, v. 25, n. 3, p. 347-400 2003.
OLIVIER, M. N., CERUTTI, E. C., TOMIM, G. C., FREITAS, M. B., ROTILI, M. C. C., GREGÓRIO, N. P. Aplicação da enzima pectinase na vinificação. Arq. Ciênc. Saúde Unipar, Umuarama, v. 12, n. 2, p. 133-138, maio/ago. 2008.
PORTS, P. S; MENDONÇA, O. P. Caracterização do vinho misto de goiaba e taperebá. Revista EMBRAPA, 2002.
RODRIGUES, Ariane Costa. 2011. Influência do modo de preparo do mosto sobre o perfil químico de fermentado alcóólico de jabuticaba (Myrciaria caulíflora Berg.) Disponível em: <http://www.ufvjm.edu.br/site/defar/files/2012/06/A.C.R.2011.1.pdf>. Acesso em 25 de Nov. de 2013.
SILVA, M. C. Avaliação da qualidade microbiológica de alimentos com a utilização com metodologias convencionais e do sistema simplate. 2002. Dissertação (mestrado), Ciência e Tecnologia de Alimentos, Escola Superior de Agricultura Luiz de Queiroz, Piracicaba-SP, 2002.
VARNAM, A. H.; SUTHERLAND, J. P. Bebidas: Teconlogía, química y microbiologia. Zaragoza: Acribia, 1997.
ZORTÉA, M. Influência da filtração sobre terras de diatomácea na cor, turbidez e presença de leveduras em vinhos tintos. Instituto Federal de Educação, Ciência e Tecnologia do Rio Grande do Sul. Bento Gonçalves – RS, 2011.


















