ISBN 978-85-85905-15-6
Área
Bioquímica e Biotecnologia
Autores
Leite, T.A. (UFC) ; Ponte, L.F.A. (UVA) ; Souza, B.W.S. (UFC) ; Silva, A.L.C. (UFC)
Resumo
A frutalina é uma lectina extraída das sementes de fruta-pão (Artocarpus incisa) e purificada por cromatografia de afinidade. Este estudo teve como objetivo desenvolver uma matriz cromatográfica usando a frutalina imobilizada em agarose para purificar imunoglobulinas A (IgA1) do colostro humano. Frações da frutalina foram imobilizadas em agarose ativada com brometo de cianogênio, em diferentes intervalos de tempo. Uma fração do colostro (rica em IgA) foi aplicada nas colunas de agarose-frutalina e na matriz comercial Immobilized jacalin. As matrizes imobilizadas com a lectina foram capazes de reter e purificar IgA1 do colostro. No entanto, a matriz imobilizada por 12 horas com a frutalina apresentou um desempenho cromatográfico na purificação de IgA1 similar ao da matriz comercial testada.
Palavras chaves
Frutalina; Artocarpus; Imunoglobulinas A
Introdução
As lectinas são ferramentas biotecnológicas potencialmente atraentes, pois além de serem moléculas estruturalmente estáveis, são abundantes na natureza, relativamente fácieis de purificar, são altamente específicas para determinados carboidratos, são susceptíveis a modificações químicas e conjugação como outras macromolécular (KUMAR et al., 2012). Por se ligarem especificamente a carboidratos que desempenham papéis importantes em reconhecimento biológico, as lectinas têm sido utilizadas em diferentes aplicações, incluindo a purificação de glicoconjugados em escala preparativa por cromatografia de afinidade (SATISH; SUROLIA, 2001). A frutalina é uma hololectina -D-galactose ligante presente em sementes de fruta-pão de caroço (Artocarpus incisa L.). Essa glicoproteína que possui cerca de 2% de carboidratos em sua estrutura e apresenta em torno de 98% de identidade com a jacalina. Estudos de modelagem molecular mostraram que a estrutura tridimensional da frutalina recombinante expressa em E.coli é homóloga a estrutura da jacalina (NEPOMUCENO, 2008). Esse estudo apontou que a frutalina é um tretâmero formado por quatro monômeros unidos por ligações covalentes, com quatro sítios de ligação a galactose e uma massa molecular de aproximandamente 48 KDa. Quanto as suas propriedades biológicas, pesquisas mostraram que a frutalina é altamente eficaz no reconhecimento e ligação seletiva a células neoplásica mamárias humanas (FERREIRA, 2001) e de tireoide (MILHOME, 2003). A frutalina também é um potente ativador mitogênico de linfócitos humanos e é capaz de se ligar a imunologlobulinas A (BRANDO-LIMA et al., 2006). O objetivo desse trabalho foi desenvolver uma nova matriz cromatográfica para purificar imunoglobulinas A1 (IgA1) do colostro humano utilizando a frutalina.
Material e métodos
O extrato total da farinha de sementes de A. incisa foi submetido à cromatografia em coluna de D-gal equilibrada com NaCl 0,15 M, que também foi utilizado para eluír proteínas não ligantes. A frutalina retida na matriz foi eluida com galactose 100 mM em NaCl 0,15 M. Em seguida, essa fração foi dialisada contra ácido acético 0,1 M e água ultrapura, e liofilizada para utilização posterior. A avaliação da atividade, pureza, integridade e o padrão conformacional da frutalina foram feitos por ensaios de atividade hemaglutinante, eletroforese (PAGE-SDS) e por dicroísmo circular (CD)conforme Moreira et al (2008). O processo de imobilização da frutalina foi baseado na metodologia descrita por March et al. (1974) com adaptações. Nesta etapa, foram usadas amostras (4 mg da proteína /mL de matriz) na imobilização em agarose ativada com brometo de cianogênio. Essas amostras foram adicionadas as matrizes ativadas e mantidas sob agitação. Foram testados diferentes tempos de imobilização (2, 6 e 12 horas) visando otimizar e validar o processo. Em seguida, as matrizes foram centrifugadas e alíquotas do sobrenadantes foram para a leitura da absorbância a 280 nm e determinação do percentual de imobilização da frutalina nas matrizes ativadas. Por fim, essas matrizes foram empacotadas em suportes cromatográficos, lavadas o tampão de equilíbrio e utilizadas na purificação de IgA1 do colostro humano. O colostro foi adicionado nas matrizes agarose-frutalina testadas e as IgAs retidas foram eluída com D-galactose 0,1 M. A pureza das frações IgA purificadas foram avaliadas por PAGE-SDS e Western blotting. O custo, o rendimento e a eficiência das matrizes agarose-frutalina foi comparada a da matriz comercial utilizada para o mesmo fim.
Resultado e discussão
A lectina presente no extrato total da farinha de semente de A. incisa foi
facilmente purificada usando uma coluna de D-gal (fig. 1A). A fração
lectínica (frutalina) apresentou um rendimento maior que a obtida por
Moreira et al. (2008). Essa fração foi dialisada, concentrada e analisada
por eletroforese. Como resultado, a eletroforese mostrou a eficiência do
processo de purificação da frutalina utilizando a coluna de D-gal, pois o
gel mostra as duas bandas com massas moleculares aparentes de 12 e 15,5 kDa
(Fig 1B), características da frutalina (MOREIRA et al., 1998). A fração
purificada também apresentou uma forte capacidade de aglutinar sangue de
coelho.
As análises de CD mostraram que a frutalina apresenta um padrão
conformacional característico de enovelamento proteico (Campana et
al.,2002), com predominância de folhas beta, cujo espectro é caracterizado
por uma banda negativa com o mínimo em 208 nm, uma banda positiva em 208 nm
e a transição do negativo para o positivo ocorrendo em 209 nm. Todas as
matrizes agarose-frutalina testadas foram capazes isolar IgA1 (fig. 2). No
entanto, ficou claro que o tempo de imobilização da frutalina na matriz
influenciou proporcionalmente na sua capacidade de ligação da IgA1, pois a
matriz submetida a imobilização lectínica por 12 h apresentou um melhor
desempenho cromatográfico do que o da matriz comercial imobilizada com a
jacalina (Fig 2A), outra lectina que também interage com IgA1 (Roque-
Barreira e Campos-Neto, 1985).
A eletroforese da IgA1 retida na matriz agarose-frutalina (imobilizada 12 h)
revelou que essa fração isolada apresenta o mesmo padrão relatado por
Almogren et al. (2007), ou seja, três bandas de 83, 65 e 25 KDa,
equivalentes ao componente secretor, cadeias pesada e leve da
imunoglobulina.
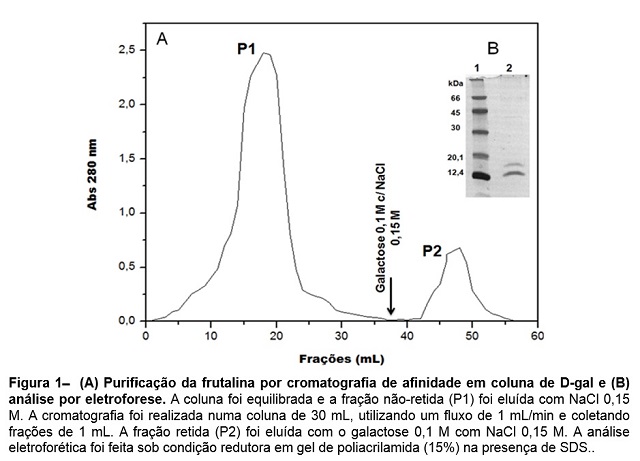
Figura 1– (A) Purificação da frutalina por cromatografia de afinidade em coluna de D-gal e (B) análise por eletroforese.
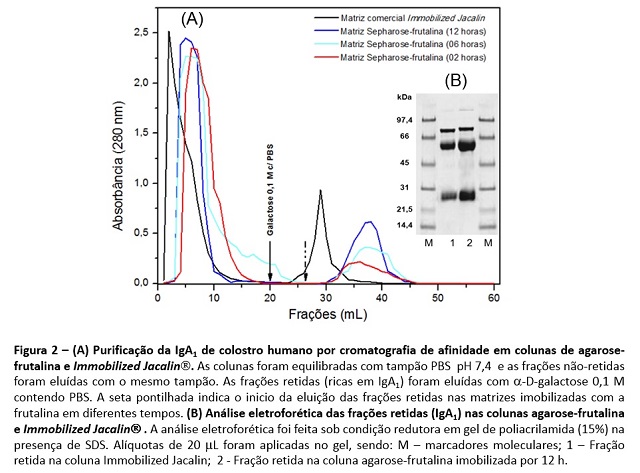
Figura 2 – Purificação da IgA1 de colostro humano por cromatografia de afinidade em colunas de agarose-frutalina e Immobilized Jacalin.
Conclusões
Podemos concluir que todas matrizes agarose-frutalina se mostraram eficientes no processo de purificação de IgA1 do colostro humano. No entanto, apenas a matriz imobilizada 12 h com a frutalina demonstrou desempenho cromatográfico similar ao da coluna comercial Immobilized Jacalin. Concluímos também que o tempo de imobilização da frutalina na agarose influencia proporcionalmente na sua capacidade de retenção do ligante e que essa nova matriz pode ser usado com uma alternativa eficiente e econômica às matrizes comerciais destinadas a purificação de imunoglobulinas A.
Agradecimentos
Aos órgãos de fomento CNPq, CAPES e FUNCAP.
Referências
ALMOGREN, A.; SENIOR, B.W; KERR, M. K. A comparison of the binding of secretory component to immunoglobulin A (IgA) in human colostral S-IgA1 and S-IgA2 Immunology, v.120, n.2, 273–280, 2007.
BRANDO-LIMA, A. C.; SALDANHA-GAMA, R. F.; PEREIRA, C. R.; VILLELA, C. G.; SAMPAIO, A. L. F.; MONTEIRO-MOREIRA, A.C.O.; HENRIQUES, M. G., BARJA-FIDALGO, C. Involvement of phosphatidylinositol-3 kinase–Akt and nuclear factor kappa-B pathways in the effect of frutalin on human lymphocyte. Intern. Immunopharmacology, no. 6, 465-472, 2006.
CAMPANA P.T., MORAES, D.I., MONTEIRO-MOREIRA, A.C., BELTRAMINI, L.M. Unfolding and refolding studies of frutalin, a tetrameric D-galactose binding lectin. Eur J Biochem., v.269, no. 3, 753-758, 2012
FERREIRA, M.V.P. Frutalina, lectina alfa-D-galactose ligante de Artocarpus incisa L. um estudo com câncer de mama. Doutorado. Departamento de Bioquímica e Biologia Molecular. Universidade Federal do Ceará. 145p. Fortaleza, Ceará. 2001.
KUMAR, K. K; CHANDRA, K. L. P.; SUMANTHI, J.; REDDY, G. S.; SHEKAR, P.C.; REDDY, B. Biological role of lectins: A review. Journal of Orofacial Sciences, no. 1, 20-25, 2012.
MARCH, S. C; PARIKH, I.; CUATRECASAS, P. A simplified method for cyanogens bromide activation of agarose for affinity chromatography. Analytical Biochemistry, no. 60, 149-152, 1974.
MOREIRA, R.A.; CASTELO BRANCO, C.C.; MONTEIRO, A.C.O.; TAVARES, R.O.; BELTRAMINI, L. M. Isolation and partial characterization of a lectin from Artocarpus incisa L. seeds. Phytochemistry, no. 47, 1188-1198, 1998.
NEPOMUCENO, D. R. Clonagem e expressão de uma lectina de Artocarpus incisa L. (frutalina) em Escherichia coli. Dissertação. Departamento de Bioquímica e Biologia Molecular. Universidade Federal do Ceará. 81p. Fortaleza, Ceará. 2008.
OLIVEIRA, C; TEIXEIRA, J. A.; SCHMITT, F.; DOMINGUES, L. A comparative study of recombinant and native frutalin binding to human prostate tissues. BMC Biotechnol.no. 9, 78, 2009.
ROQUE-BARREIRA, M. C.; CAMPOS-NETO, A. Jacalin: an IgA-binding lectin. J Immunol., v.134, no.3, 1740-3, 1985.
SATISH, P.R.; SUROLIA, A. Exploiting lectin affinity chromatography in clinical diagnosis. Journal of Biochemical and Biophysical Methods, v.49, 625-640, 2001.


















