ISBN 978-85-85905-15-6
Área
Bioquímica e Biotecnologia
Autores
Pereira, L.F. (UNESP) ; Bevilaqua, D. (UNESP)
Resumo
O presente trabalho avaliou o uso da bactéria oxidante de ferro e enxofre At. ferrooxidans a fim de obter uma máxima redução no teor de enxofre no carvão. Foi realizado ensaio de biolixiviação em frasco agitado durante 30 dias e os seguintes parâmetros foram monitorados na fase líquida: pH, Eh e Fe2+. No controle abiótico o Eh atingiu um valor de 418 mV (Ag/AgClsat) enquanto o ensaio com a bactéria alcançou valor acima de 582 mV (Ag/AgClsat). O ensaio demonstrou que a pirita associada ao carvão é facilmente solubilizada utilizando essa bactéria como catalisadora da reação. A quantificação do total de sulfeto oxidado a sulfato ainda será analisado por normas ASTM.
Palavras chaves
carvão; At. ferrooxidans; Biolixiviação
Introdução
O carvão é a fonte de energia não renovável mais importante do mundo. Ele é constituido por carbono, oxigênio, nitrogênio, enxofre e traços de outros elementos. Um dos problemas no uso do carvão se deve a presença de enxofre nas formas: pirita, orgânico, sulfato e uma pequena quantidade na forma elementar (ACHARYA et al.,2004; SINGH et al.,2013). Entre os compostos que contém enxofre, a pirita corresponde entre 50% a 80% do valor total do elemento (CARDONA and MARQUEZ,2009; CAICEDO and MARQUEZ,2010). Durante o processo de combustão é lançado na atmosfera gases como CO2, NOx e SOx que geram efeitos danosos ao meio ambiente. Os métodos físicos e químicos para a dessulfurização do carvão são muito dispendiosos e envolvem o uso de condições extremas de temperatura e pressão. Como alternativa a esses processos, tem sido desenvolvida uma técnica de remoção biológica mais eficaz para tal fim (PRAYUENYONG,2002; CARA et al.,2003). Alguns microrganismos são capazes de metabolizar o enxofre presente no carvão e utilizar a energia liberada para seu crescimento. Os microrganismos mesófilos, termófilos moderados e extremamente termófilos exibem a capacidade de aumentar a oxidação da pirita e sua conversão para compostos solúveis (PANDEY et al.,2005). Entre eles, o At. ferrooxidans é a bactéria mais utilizada para remoção da pirita no carvão (ALLER et al.,2001; KIM et al.,2013). A energia para manutenção e crescimento dessa bactéria provêm da oxidação de compostos de ferro e enxofre, sob condições ácidas (QUATRINI et al.,2005). Assim, o presente trabalho propõe o uso desta bactéria oxidante de ferro e enxofre a fim de obter uma redução no teor de enxofre piritico do carvão.
Material e métodos
O carvão utilizado no ensaio foi fornecido pel Carbonífera do Cambuí localizado no estado do Paraná e apresentava 10,96% de cinzas, 3,30% de enxofre, 55,25% de carbono fixo e 34,59% de matéria volátil. No ensaio de biolixiviação foi analisada a eficiência de remoção do enxofre utilizando a bactéria acidofílica At. ferrooxidans - LR com adição de fonte energética suplementar (30 mMol L-1 Fe2+). O ensaio de remoção biológica de enxofre dessa amostra de carvão foi realizado em frascos agitados utilizando erlenmeyer de 500 mL com volume final de 300 mL de meio T&K (TUOVINEN and KELLY, 1972), 2,5% (m/V) de carvão moido e peneirado (115 mesh), 5% (v/v) de inóculo da bactéria At. ferrooxidans - LR fresca a 150 rpm e 30°C. Para este ensaio foi preparado frascos sacrifício de 5, 10, 20 e 30 dias nos quais foi feita uma separação da fase líquida e sólida por centrifugação. Na fase sólida foi realizada analises por DRX, FTIR e SEM/EDX a fim de estudar as transformações mineralógicas ocorridas durante o processo e avaliar a evolução da redução do teor de enxofre presente na forma orgânica e inorgânica, além de observar a precipitação de novas fases cristalinas. A fase liquida foi utilizada para determinar o pH, o potencial de óxido redução (Eh) e as concentrações de Fe2+ e ferro total. Durante a biolixiviação o pH foi ajustado com H2SO4 1 mol L-1 esterilizado para pH 1,8. Perdas de água por evaporação foram compensadas antes de cada amostragem pela adição de água destilada igualmente estéril. Todos os ensaios foram realizados em duplicata.
Resultado e discussão
No ensaio contendo o microrganismo, até o 5° dia o pH sofreu um aumento em
seus valores necessitando de correções ácidas para pH abaixo de 2. Após o 5°
dia ocorreu uma queda nos valores de pH não ultrapassando 1,61. A correção
ácida foi realizada para evitar a precipitação de ferro na forma de
jarosita, o que pode interferir na solubilização da pirita. Nas amostras de
carvão, a oxidação bacteriana de íons ferrosos consome ácido aumentando o pH
enquanto as reações bacterianas de oxidação do sulfeto são produtoras de
ácido diminuindo o pH. O frasco abiótico não obteve uma variação
significativa do pH pois, na ausência de microrganismos, não ocorrem as
reações biológicas de produção de ácido. O ensaio com o At.
ferrooxidans apresentou um comportamento crescente no valor do Eh
iniciando-se em 410 mV e se estabilizando em torno de 582 mV a partir do 20°
dia de ensaio. Esta elevação dos valores de Eh é característico da atividade
bacteriana, uma vez que a atividade dos organismos oxidantes de ferro elevam
a razão Fe3+/Fe2+. Para o controle abiótico dessa
condição o Eh não ultrapassou o valor de 418 mV. Outro parâmetro estudado
foi a concentração dos íons Fe2+ nas soluções lixiviantes. Foram
detectadas concentrações menores que 1,02 mMOl L-1 de Fe2+
nos frascos inoculados enquanto seu controle abiótico apresentou
valores acima de 27 mMol L-1. Esse comportamento no meio biótico
indica que as bactérias estão ativas, uma vez que a fonte de energia
(Fe2+) está sendo consumida continuamente. Os dados apresentados
até o momento estão condizentes com os relatados na literatura para esse
tipo de microorganismo em amostras de carvão (ACHARYA et al.,2004).
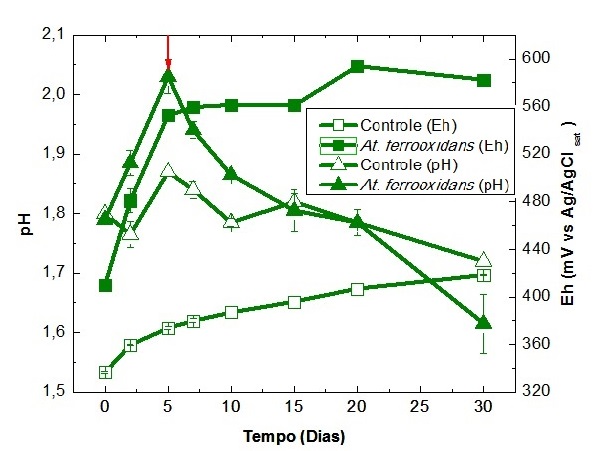
Variação do pH e do Eh no ensaio de biolixiviação para At. ferrooxidans – LR e seu respectivo controle abiótico.
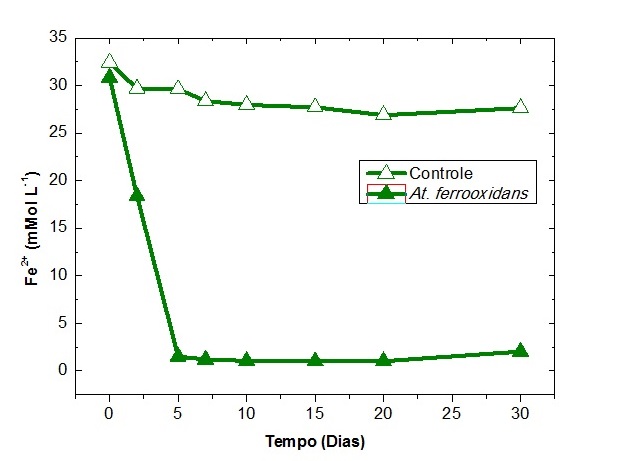
Variação nas concentrações dos íons Fe2+ nos ensaios de biolixiviação para a linhagem da At. ferrooxidans – LR.
Conclusões
De acordo com os resultados apresentados pode-se observar que durante o ensaio houve uma característica atividade bacteriana na amostra de carvão. O At. ferrooxidans é capaz de aumentar a razão Fe3+/Fe2+ elevando os valores de Eh e utilizando o Fe2+ como fonte energética. A presença de ferro na forma de pirita (FeS2) nesta amostra de carvão possibilita sua solubilização removendo o enxofre da matriz sólida deste mineral. Ainda serão realizadas análises para determinar a concentração de ferro total e a quantificação do teor de enxofre total e de suas formas serão avaliadas por normas ASTM.
Agradecimentos
CAPES/Cnpq
Referências
ACHARYA, C.; SUKLA, L.; MISRA, V. Review biodepyritisation of coal. Journal of Chemical Technology and Biotechnology, v. 79, n. 1, p. 1-12, JAN 2004 2004. ISSN 0268-2575.
ALLER, N. et al. Biodesulphurisation of coal by microorganisms isolated from the coal itself. Fuel Processing Technology, v. 69, n. 1, p. 45-57, JAN 2001 2001. ISSN 0378-3820.
CAICEDO, G.; MARQUEZ, M. Selection procedures of consortia bacterial with A. ferrooxidans like bacteria and A. thiooxidans like bacteria in coal biodesulfurization process. Revista Facultad De Ingenieria-Universidad De Antioquia, n. 52, p. 88-94, MAR 2010 2010. ISSN 0120-6230.
CARA, J. et al. The biodesulphurization of a semianthracite coal in a packed-bed system. Fuel, v. 82, n. 15-17, p. 2065-2068, OCT-DEC 2003 2003. ISSN 0016-2361.
CARDONA, I. C.; MARQUEZ, M. A. Biodesulfurization of two Colombian coals with native microorganisms. Fuel Processing Technology, v. 90, n. 9, p. 1099-1106, Sep 2009. ISSN 0378-3820. Available at: <<Go to ISI>://WOS:000270076500007 >.
KIM, D. et al. Microbial desulfurization of three different coals from Indonesia, China and Korea in varying growth medium. Korean Journal of Chemical Engineering, v. 30, n. 3, p. 680-687, MAR 2013 2013. ISSN 0256-1115.
PANDEY, R. et al. Microbial desulphurization of coal containing pyritic sulphur in a continuously operated bench scale coal slurry reactor. Fuel, v. 84, n. 1, p. 81-87, JAN 2005 2005. ISSN 0016-2361.
PRAYUENYONG, P. Coal biodesulfurization processes. Songklanakarin J Sci Technol, v. 24, p. 493-507, 2002.
QUATRINI, R.; JEDLICKI, E.; HOLMES, D. Genomic insights into the iron uptake mechanisms of the biomining microorganism Acidithiobacillus ferrooxidans. Journal of Industrial Microbiology & Biotechnology, v. 32, n. 11-12, p. 606-614, DEC 2005 2005. ISSN 1367-5435.
SINGH, P. et al. Control of different pyrite forms on desulfurization of coal with bacteria. Fuel, v. 106, p. 876-879, APR 2013 2013. ISSN 0016-2361.
TUOVINEN, O.; KELLY, D. BIOLOGY OF THIOBACILLUS-FERROOXIDANS IN RELATION TO MICROBIOLOGICAL LEACHING OF SULFIDE ORES. Zeitschrift Fur Allgemeine Mikrobiologie, v. 12, n. 4, p. 311-&, 1972 1972. ISSN 0044-2208.


















