ISBN 978-85-85905-15-6
Área
Bioquímica e Biotecnologia
Autores
Mikaelly de Oliveira Moreira, L. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Nelson de Paiva Melo, E. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Kethlen Gonçalves Bombonatto, A. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Karlla Moreira de Oliveira, A. (UNIVERSIDADE ESTADUAL DE GOIAS) ; Salomão Caramori, S. (UNIVERSIDADE ESTADUAL DE GOIAS)
Resumo
O monitoramento da atividade enzimática do solo constitui indicadores sensíveis para detectar alterações ambientais decorrentes do uso agrícola. A enzima fenoloxidase desempenha funções chaves no ecossistema, como a degradação da lignina, humificação, mineralização do carbono e degradação de poluentes orgânicos. Essa enzima reduz a toxidade das moléculas fenólicas e de íons metálicos, e ajudam na defesa antimicrobiana no solo. O objetivo desse estudo foi compreender a influência da atividade enzimática de oxidorredutases presentes em solos de acordo com o tipo de manejo usado para plantio de cana-de-açúcar: convencional e cultura orgânica, usando solo nativo de Cerrado como controle. A atividade da enzima fenoloxidase foi maior em solos com o cultivo de cana-de-açucar.
Palavras chaves
Fertilidade; Adubação; oxidorredução
Introdução
Os cenários previstos para a agricultura brasileira considerando o aumento das emissões de CO2 para a atmosfera tornaram-se um tema de preocupação para o agronegócio, uma vez que as mudanças climáticas consequentes do acúmulo de gases de efeito estufa comprometem as áreas de plantio de espécies aproveitadas para o consumo humano (ASSAD et al., 2004; PELLEGRINO, et al., 2007). Por outro lado, a oportunidade de produção de biocombustíveis que forneçam menor impacto para a atmosfera impulsionou o aumento do plantio de cana-de-açúcar no Brasil e a produção de etanol (LEITE; LEAL, 2007, GOUVÊA et al., 2009). O cultivo da cana-de-açúcar no Brasil apresentou um crescimento de 3,6% (318,7 mil hectares) em relação à safra passada (CONAB, 2014). Ocupando uma posição de destaque na economia nacional devido a sua múltipla utilização, a cana-de-açúcar constitui-se como matéria prima básica para importantes produtos da indústria sucroalcooleira no Brasil. Os produtos da cana geram cerca de 39,46 milhões de toneladas de açúcar e 28,37 bilhões de litros de etanol (GAUDER et al., 2011, CONAB, 2014). A diversidade microbiana, a mineralização do nitrogênio, a biomassa microbiana e as taxas de atividade enzimática podem ser considerados indicadores da qualidade do solo (PUGLISI et al.,2006). A atividade enzimática possui alto potencial para a avaliação da qualidade do solo, por apresentar grande sensibilidade, permitindo avaliações logo após a ocorrência de perturbações, monitorando o seu estado sob diferentes condições (GIL-SOTRES et al., 2005). A avaliação da atividade das enzimas extracelulares muda rapidamente se as condições do solo se alteram e é, portanto, recomendada como o indicador da decomposição microbiana.
Material e métodos
Com cultivo da cana-de-açúcar foram coletadas amostras de solo na usina Anicuns S/A - Álcool e Derivados, localizada na Rodovia Anicuns Americano do Brasil, Km 06 – Zona Rural - Anicuns/GO. Sistema de cultivo orgânico e convencional com adubação de torta de filtro e adubação química (Talhão 75), sistema de cultivo orgânico irrigado com vinhaça e com adubação de torta de filtro (Talhão 13), sistema de cultivo convencional com adubação química (Talhão 80). Foi coletado solo de Cerrado nativo na Trilha Interpretativa de Educação Ambiental “Trilha do Tatu”, na Unidade Universitária de Ciências Exatas e Tecnológicas (UnUCET) da Universidade Estadual de Goiás (UEG), em Anápolis- GO. As amostras foram armazenadas em recipientes de plásticos, mantidas em uma caixa térmica com gelo até o laboratório de Biotecnologia da Universidade Estadual de Goiás (UnUCET), posteriormente cada amostra foi peneirada com o auxilio de uma tamise com malha 2mm e foram mantidas na geladeira. Para a determinação do teor de umidade, foi colocado 0,5 gramas de cada amostra de solo na estufa durante 24 h a 105 °C. Nos ensaios enzimáticos, foram testadas as atividades de fenoloxidase total no solo. Para a determinação da atividade de fenoloxidase foi adicionado 0,05 g de massa seca de solo, 1 mL de L-3,4-dihidroxifenilalanina (L-DOPA) (0,0197g ) em 10 mL tampão acetato de sódio 0,1 mol L-1pH 5,0. A mistura foi incubada por 60 min, a temperatura ambiente, e o aparecimento de produto foi monitorado a 460 nm (SINSABAUGH et al., 1999). Foram feitos tubos controle adicionando-se 0,05 g de massa seca de solo e 1,0 mL de tampão acetato de sódio 0,1 mol L-1 pH 5,0, sem a presença dos substratos. A atividade enzimática para a fenoloxidase foi calculada pela diferença entre a leitura da absorbância do ensaio e do controle, sendo assim expressa em μmol de 3-dihidroindol-5,6-quinona-2-carboxilato de metila (DIQC)/h/g de solo (massa seca) e foi calculada com base num coeficiente de extinção micromolar, de 1,29 μ/mol, determinado experimentalmente (SINSABAUGH et al., 1999).
Resultado e discussão
Os maiores valores da atividade enzimática fenoloxidase foram encontrados no
Talhão 80, durante o período de seca, que possui adubação química e
promovendo um aumento no teor de nitrogênio no solo (Figura 1) Fog (1998)
observou que a adição de nitrogênio aumenta a atividade de Fenoloxidase.
Esta constatação também é suportada por Sinsabaugh (2010).
Pode-se observar que houve maior atividade enzimática nos períodos de seca
(Figura 1). Boerner; Brinkman (2003) observaram os efeitos de altas
temperaturas em solos e concluíram que a atividade da fenoloxidase aumentou
até 80%. Fenner et al. (2005), também observaram o aumento da atividade da
fenoloxidase em períodos de seca.
Os maiores valores de atividade da enzima Fenoloxidase foram encontrados em
solos de Cerrado “ss”, seguido por solos de Mata Mesófila e pasto que
apresentaram valores semelhantes no período de seca (Figura 2). Durante o
período de seca a vegetação rasteira predominante no Cerrado “ss” expõe mais
o solo para a perda de água em relação ao que ocorre com a Mata Mesófila,
que possui cobertura vegetal mais densa. Isto pode ter sido uma resposta ao
estresse provocado pelo período de seca em solos de Cerrado “ss”.
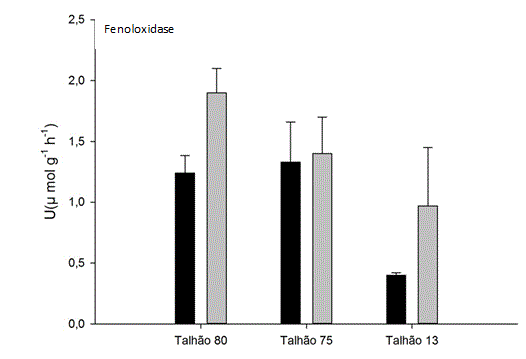
Atividade da enzima Fenoloxidase em diferentes classes de uso do solo de cana-de-açúcar na região de Anicuns-Go. A barra com coloração mais escura representa estações de chuva e barra mais clara representa a estações de seca.
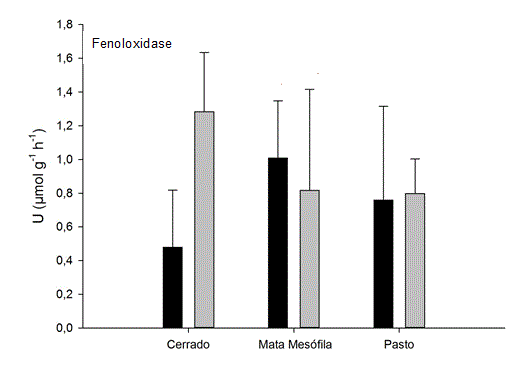
Atividade da enzima Fenoloxidase em diferentes classes de uso do solo do Solo do Cerrado Nativo. A barra com coloração mais escura representa estações de chuva e barra mais clara representa a estações de seca.
Conclusões
Os resultados deste estudo demonstraram que a enzima fenoloxidase, é um indicador sensível ao tipo de manejo do solo e contribuem para avaliar a fertilidade do solo. A atividade enzimática fenoloxidase está associada ao estresse do solo causado pela adubação química e condições de seca, sendo indicadora do grau de toxidade desse ambiente.
Agradecimentos
Universidade Estadual de Goiás.
Referências
ASSAD, E.D.; PINTO, H.S.; ZULLO JR, J.; ÁVILA, A.M.H. Impacto das mudanças climáticas no zoneamento agroclimático do café no Brasil. Pesquisa Agropecuária Brasileira, v.39, n.11, p.1057-1064, 2004.
BOERNER, R.E.J.; BRINKMAN, J.A. Fire frequency and soil enzyme activity in southern Ohio oak-hickory forests. Applied Soil Ecology, v. 23, p.137e146, 2003.
Companhia Nacional de Abastecimento (CONAB). Acompanhamento da safra brasileira cana-de-açúcar. v. 1 – Safra 2014/15, n.1 - Primeiro Levantamento, p. 1-20, 2014. Disponível em: http://www.conab.gov.br/OlalaCMS/uploads/arquivos/14_04_15_15_44_37_boletim_cana_portugues_-_1o_lev_-_14.pdf.
FENNER, N.; FREEMAN, C.; REYNOLDS, B. Hydrological effects on the diversity of phenolic degrading bacteria in a peatland: implications for carbon cycling. Soil Biology & Biochemistry, v. 37, p.1277-1287, 2005.
GAUDER, M.; GRAEFF-HÖNNINGER, S.; CLAUPEIN, M. The impact of a growing bioethanol industry on food production in Brazil. Applied Energy, v. 88, p. 672-679, 2011
GIL-SOTRES, F.; CEPEDA-TRASAR, C.; LEIRÓS, M.C. E.; SEOANE, S. Different approaches to evaluating soil quality using biochemical properties. Soil Biolology &. Biochemistry. v. 37, p. 877-887, 2005.
GOUVÊA, J.R.F.; SENTELHAS, P.C.; GAZZOLA, S.T.; SANTOS, M.C. Climate changes and technological advances: impacts on sugarcane productivity in tropical southern Brazil. Scientia Agricola, v.66, p.593-605, 2009..
LEBRUN, J.D.; TRINSOUTROT-GATTIN, I.; VINCESLAS-AKPA, M.; BAILLEUL, C.; BRAULT, A.; MOUGIN, C.; LAVAL, K. Assessing impacts of copper on soil enzyme activities in regard to their natural spatiotemporal variation under long-term different land uses. Soil Biololy & Biochemistry, v.49, p.150–15, 2012.
LEITE, R. C. C.; LEAL, M. R. L. V. O biocombustível no Brasil. Novos Estudos, v. 78,p. 15-21, 2007
PELLEGRINO, G.Q.; ASSAD, E.D.; MARIN, F.R. Mudanças Climáticas Globais e a Agricultura no Brasil. Revista Multiciência, seção Mudanças Climáticas, nº 8, p. 139-162, 2007.
PUGLISI, E.; DEL RE, A.A.M.; RAO, M.A.; GIANFREDA, L. Development and validation of numerical indexes integrating enzyme activities of soils. Soil Biology & Biochemistry. v.38, p.1673–1681, 2006.
SAPARRAT, N, C. N.; GUILLÉN, F.; ARAMBARRI, A, M.; MARTINEZ, A, T.; MARTINEZ, M, J. Induction, isolation and characterization of two white rot basidiomycete laccases of rigid Coriolopsis. Applied and Environmental Microbiology, v.68, p 1534-1540, 2002.
SINSABAUGH, R. L. Phenol oxidase, peroxidase and organic matter dynamics of soil. Soil Biology & Biochemistry, v. 42, n. 3, 2010
.
YUAN, L.; BAO, D.; JIN, Y.; YANG, Y.; HUANG, J.; Influence of fertilizers on nitrogen mineralization and utilization in the rhizosphere of wheat. Plant and Soil. v.343, p.187–193, 2011.


















