ISBN 978-85-85905-15-6
Área
Bioquímica e Biotecnologia
Autores
Moreira Lima, L. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; de Sousa Oliveira, M. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Augusta Marinho Malaquias, N. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Cristina Garcia Martin Didonet, C. (UNIVERSIDADE ESTADUAL DE GOIÁS) ; Lázaro Faleiro Naves, P. (UNIVERSIDADE ESTADUAL DE GOIÁS)
Resumo
Este estudo determinou a biomassa total em biofilmes formados em microplacas de poliestireno, produzido por cinco bactérias da família Rizobiaceae em três diferentes meios de cultura (YM, RDM e caldo batata). A quantificação foi realizada pela coloração do biofilme com cristal violeta e leitura da densidade óptica a 492 nm. Todas as cepas apresentaram produção de biofilme, sendo observada a influência da composição dos meios de cultura na formação do mesmo. O caldo batata apresentou melhores resultados para as estirpes CFN42, BR522, BR10055 e BR322. A cepa BR520 apresentou comportamento semelhante nos três meios estudados. Conclui-se que a biomassa total presente no biofilme é dependente do tipo de micro-organismo e do meio de cultura empregado.
Palavras chaves
Rizóbios; Biomassa Total; Cristal Violeta
Introdução
Rizóbios são bactérias do solo capazes de induzir a nodulação em raízes de leguminosas, resultando na auto suficiência de nitrogênio para a planta hospedeira. A utilização da fixação biológica de nitrogênio em plantas leguminosas tem se intensificado por favorecer a produtividade nas culturas, além de diminuir o aporte de fertilizantes nitrogenados, que aumentam os custos de produção e contribuem para poluição ambiental. (RINAUDI et al 2010). Biofilme pode ser definido como populações microbianas envolvidas em uma matriz polimérica extracelular, aderidas a uma interface, resultando em uma estrutura porosa complexa. No biofilme as bactérias formam micro colônias rodeadas de grandes quantidades de exopolissacarídeos, apresentando canais para abastecimento de água, influxo de nutrientes e o efluxo de produtos de metabolismo (FLACH, 2006). A sua formação pode ser influenciada por vários fatores como disponibilidade de nutrientes, temperatura, osmolaridade, pH e concentração de oxigênio (O’TOOLE et al, 2000). A metodologia de coloração com cristal violeta foi descrita pela primeira vez em 1985, e vem sendo modificada para aumentar a precisão e permitir a quantificação da biomassa em todo o biofilme. O Cristal violeta é um corante básico que se liga a moléculas carregadas negativamente e a polissacarídeos na matriz extracelular. (PEETERS et al, 2008). Associadas a essas informações este trabalho visa quantificar a biomassa total produzida por cinco bactérias da família Rizobiaceae em três diferentes meios de cultura, visando avaliar a influencia das condições de cultivo na formação de biofilme.
Material e métodos
Para a realização deste estudo foram utilizadas cinco estirpes obtidas junto a Embrapa Arroz e Feijão de Santo Antônio de Goiás. BR322 (Rhizobium tropici), BR520 (Rhizobium tropici), BR10055 (Rhizobium galegae), CFN42 (Rhizobium etli) e BR522 (Mesorhizobium mediterraneum). Para a avaliação da formação de biofilme foram utilizados três meios de cultura: YM (HUNGRIA, ARAUJO, 1994), RDM (CASTELLANE, 2007) e Batata (DOBEREINER, ANDRADE, BALDANI, 1999). Após o crescimento e confirmação da pureza, colônias típicas foram dissolvidas em solução fisiológica estéril (SFE) e os inóculos ajustados para 1,5x105 ufc.mL-1 nos meios testados. As placas foram incubadas por 24 horas a 30 °C. Após o período de incubação o meio crescido foi removido e cada poço foi lavado uma vez com 200 μL de SFE. Para o ensaio de biomassa total, as placas foram tratadas segundo a metodologia descrita por Naves e colaboradores (2008). A cada poço da placa foram adicionados 100 μL de solução do corante Cristal Violeta 0,1%. O corante foi deixado em contato com o biofilme por 15 minutos, em seguida removido e cada poço lavado com 200 μL de água destilada por quatro vezes. As placas foram deixadas à temperatura ambiente por 15 minutos para a completa evaporação dos resíduos de água. Posteriormente 100 μL de álcool etílico absoluto foram adicionados em cada poço para a solubilização do corante aderido a matriz. A quantificação da biomassa total foi realizada através da leitura da densidade óptica a 492 nm, onde resultados maiores de absorbância, indicam maior produção de biomassa no biofilme. Os resultados foram agrupados em médias e desvio padrão a partir de experimentos realizados em triplicatas independentes.
Resultado e discussão
Todas as cepas apresentaram produção de biofilme. Com o auxílio visual do
gráfico postado na Figura 1, nota-se a influência da composição dos meios de
cultura na formação do biofilme e consequentemente na biomassa total. Foi
observado que o caldo Batata, considerado o mais rico dos meios, se mostrou
mais propicio para o desenvolvimento do biofilme para quatro das cepas
analisadas (CFN42, BR522, BR10055 e BR322). Comparando os meios YM e meio
RDM observa se que o primeiro foi mais efetivo para as cepas CFN42, BR322 e
BR10055. A cepa BR520 apresentou valores semelhantes para na formação de
biofilme nos três meios estudados. Os resultados de produção de biomassa
estão listados na Tabela 1.
Foi constatado que os meios de cultura YM e caldo Batata são os que
apresentaram maior capacidade de formação de biofilme, indicando que meios
complexos suprem melhor a demanda de nutrientes pelas bactérias. A partir da
análise dos resultados obtidos pode se observar que a disponibilidade de
nutrientes é determinante para uma maior formação de biofilme e presença de
células vivas no mesmo.
Estudos mostram que a formação de biofilme é induzida em condições limitadas
de nutrientes. Sendo assim, a disponibilidade de nutrientes desempenha um
papel importante na transição a partir de um modo de vida planctônico para
um modo séssil (RINAUDI et al, 2010). Contudo isso não é observado para
bactérias da família Rizobiaceae. A superfície da raiz é um ambiente
relativamente rico em nutrientes, e que mesmo assim permite a formação de
biofilmes de rizóbio. Uma possibilidade é que um via de regulação ainda
desconhecida promova a formação de biofilme e anulando o efeito inibitório
do aporte de nutrientes a partir da raiz (RINAUDI et al, 2010).
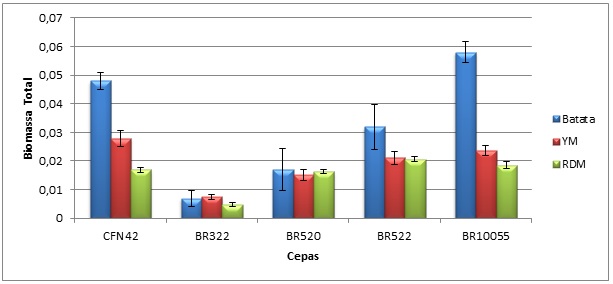
Disposição gráfica dos resultados obtidos no trabalho para Biomassa Total produzida pelas cepas em estudo nos diferentes meios de cultura.
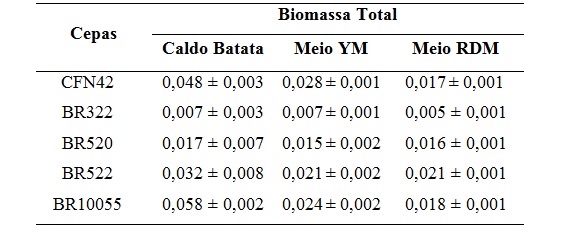
Valores de biomassa total obtidos para as cepas em estudo nos três diferentes meios de cultura.
Conclusões
Todas as cepas apresentaram formação de biofilme nos meios analisados. A estirpe BR10055 foi a maior produtora, enquanto a estirpe BR322 foi a de menor produção de biomassa total no biofilme aderido. Constatou-se a influência da composição dos meios de cultura na formação de biofilme, onde meios complexos promovem uma maior formação de biomassa em biofilme em bactérias da família Rhizobiaceae. A biomassa total associada ao biofilme é dependente do tipo de micro-organismo e do tipo de meio de cultura utilizado.
Agradecimentos
Bolsas de iniciação científica PIBITI/CNPq e PBIT/UEG. Ao CNPq/MCT INCT em Fixação Biológica de Nitrogênio, ao Programa de Bolsa de Incentivo ao Pesquisador (PROBIP)
Referências
CASTELLANE, T. C. L. [b]Análise de Polissacarídeos Essenciais para a Nodulação do Feijoeiro por Rhizobium tropici Cultivados em Diferentes Fontes de Carbono.[/b] Jaboticabal: Unesp, 2007. Dissertação de Mestrado, Faculdade de Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, 2007.
DOBEREINER, J.; ANDRADE, V. O.; BALDANI, V. L. D. [i]Protocolos para Preparo de Meios de Cultura da Embrapa Agrobiologia[/i]. Rio de Janeiro, 1999. Disponível em: <http://ainfo.cnptia.embrapa.br/digital/bitstream/CNPAB-2010/27335/1/doc110.pdf> Acesso em: 13 jun. 2014.
FLACH, J. [b]Formação de Biofilmes em Diferentes Materiais Utilizados na Indústria de Processos de Leite[/b]. Porto Alegre, 115 f, 2006. Dissertação (Mestrado em Microbiologia Agrícola e do Ambiente) Universidade Federal do Rio Grande do Sul, 2006.
HUNGRIA, M., ARAUJO, R. S. [b]Manual de Métodos Empregados em Estudos De Microbiologia Agrícola[/b]. Empresa Brasileira de Pesquisa Agropecuária. 1. ed. Brasília: Centro Nacional de Pesquisa de Arroz e Feijão, Centro Nacional de Pesquisa de Soja. 1994. 542 p.
NAVES, P.; PRADO, G.; HUELVES, L.; GRACIA, M.; RUIZ, V.; BLANCO, J.; DHABI, G.; BLANCO, M.; PONTE, M. C.; SORIANO, F. Correlation Between Virulence Factors and in vitro Biofilm Formation by Escherichia coli Strains. [b]Microbial Pathogenesis[/b], v. 45, 86-91, 2008.
O’TOOLE, G.; KAPLAN, H. B.; KOLTER, R. Biofilm formation as microbial development. [b]Annual Review of Microbiology[/b], v. 54 49-79, 2000.
PEETERS, E., HANS, J. N. COENYE, T. Comparison of multiple methods for quantification of microbial biofilms grown in microtiter plates. [b]J. of Microbiological Methods[/b], v 72, 157 – 165, 2008.
RINAUDI, L. V.; SORROCHE, F.; ZORREGUIETA, A.; GIORDANO, W. Analysis of ThemucR Gene Regulating Biosynthesis of Exopolysaccharides: Implications for Bio-lmformation in Sinorhizobium meliloti Rm1021. [b]FEMS Microbiology Letters[/b], v. 302, 15-21, 2010.


















