ISBN 978-85-85905-15-6
Área
Materiais
Autores
Canedo Silva, B.G. (UNIVERSIDADE FEDERAL DE GOIÁS - UFG) ; Sartoratto, P.P.C. (UNIVERSIDADE FEDERAL DE GOIÁS - UFG) ; Lacava, Z.G.M. (UNIVERSIDADE DE BRASÍLIA - UNB) ; Fonseca, M.J.P. (UNIVERSIDADE DE BRASÍLIA - UNB)
Resumo
Nanopartículas funcionalizadas com moléculas catiônicas e recobertas com dextrana, além de serem capazes de estabelecer interação eletrostática com diversas biomoléculas que contém grupos aniônicos, também são capazes de proteger a informação genética do DNA e RNA em aplicações biológicas. Neste trabalho, um fluido magnético constituído de nanopartículas de maghemita funcionalizadas com L- Lisina foi preparado e utilizado para carreamento de moléculas de DNA, sendo posteriormente recoberto com dextrana. A associação de DNA e dextrana à superfície foi verificada pelo aumento do raio hidrodinâmico das partículas dispersas. As análises de FTIR evidenciaram a associação de dextrana mesmo após a lavagem do sólido maghemita/dextrana.
Palavras chaves
nanopartículas; DNA; dextrana
Introdução
A funcionalização de nanopartículas com moléculas catiônicas contendo grupos amina protonáveis tem sido amplamente utilizada em diversas aplicações biológicas, inclusive na terapia gênica, devido à capacidade dessas moléculas de interagir eletrostaticamente com diversas biomoléculas que possuem grupos funcionais aniônicos, como DNA, RNA, proteínas, etc (RAMOS et al., 2014). Entre essas moléculas catiônicas, podemos citar polímeros como polietilenoinima – PEI (ZHOU et al., 2009), poli(L-lisina) (BABIC et al., 2008), espermina (COHEN et al., 2011), aminoácidos como a lisina e histidina (DURMUS et al., 2009) e aminopropiltrietoxisilano – APTS (KNEUER et al., 2000). Devido às moléculas de DNA e RNA serem degradadas pelas nucleases presentes no soro humano e animal, é necessário que essas nanoestruturas sejam recobertas com substâncias capazes de proteger a informação genética do ácido nucleico em aplicações in vivo (CUI et al., 2012). Uma das alternativas é utilizar a dextrana, um polissacarídeo biocompatível capaz de associar-se à superfície das nanopartículas de maghemita/DNA por interação de van der Waals e ligações de hidrogênio (HONG et al., 2008). Neste trabalho, foi preparado um fluido magnético biocompatível constituído de nanopartículas de maghemita funcionalizadas com L-Lisina e dextrana para carreamento de DNA e este foi caracterizado quanto a composição, cristalinidade, morfologia e estabilidade coloidal.
Material e métodos
Um fluido magnético constituído de nanopartículas de maghemita funcionalizada com L-Lisina (NPLis) foi obtido através da coprecipitação dos íons ferro (II) e (III) na presença do monocloridrato de L-Lisina, segundo a proporção molar 1:2:2 Fe2+ : Fe3+ : L-Lisina (DURMUS et al., 2009). As nanopartículas sintetizadas foram dispersas em água destilada e centrifugadas para separação de qualquer fração sólida presente na suspensão. O fluido NPLis foi caracterizado por difração de raios X (DRX), microscopia eletrônica de transmissão (MET), termogravimetria (TG), espectrofotometria UV-Vis, espalhamento dinâmico de luz (DLS) e espalhamento eletroforético de luz (ELS). Duas amostras contendo 1 mL de fluido NPLis e 5 μL de solução de DNA do fungo Humicola grísea (171 ng/μL) foram preparadas e agitadas por meia hora (amostras NPDNA). A cada amostra, foi adicionada a dextrana (peso molecular médio 10.000 kDa) segundo a proporção maghemita/dextrana (m/m) de 0,43 e 1,44 [9], gerando os fluidos NPDNAdex01 e NPDNAdex02, respectivamente. Os fluidos NPDNAdex01 e NPDNAdex02 foram analisados por DLS para a determinação do raio hidrodinâmico. Tais amostras foram divididas em duas frações, sendo que uma fração de cada (NPDNAdex01a e NPDNAdex02a) foi seca em estufa a 40º C por 24 horas para caracterização por FTIR. As outras duas frações foram submetidas a separação por gradiente de campo magnético, visando à separação do sólido. Após a separação, os sólidos foram lavados com água deionizada e secos de forma semelhante à já descrita, dando origem às amostras NPDNAdex01b e NPDNAdex02b, que foram também caracterizadas por FTIR.
Resultado e discussão
O sólido NPLis apresentou padrão de difração característico da maghemita e
parâmetro de rede de 0,835 nm (DRX). As análises de MET evidenciaram
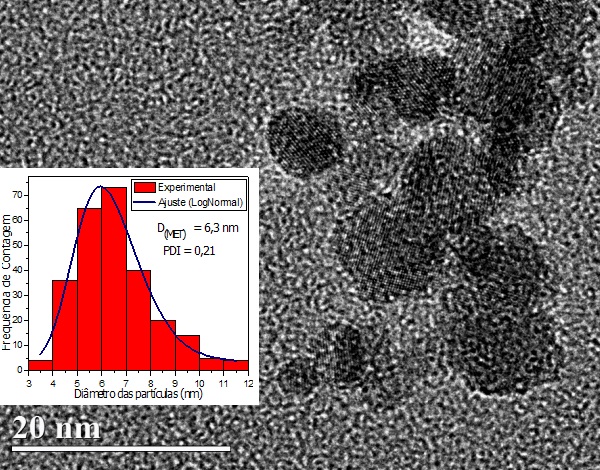
nanopartículas esféricas, diâmetro médio de 6,3 nm e índice de polidispersão de
0,21 (Fig. 1). O coeficiente de recobrimento do sólido NPLis foi determinado
pela TG em 1,2 moléculas de aminoácido por nm2, raio hidrodinâmico
(DLS) em 88 nm e teor de ferro (UV-Vis) em 0,78 g/L. As nanopartículas
apresentaram potencial zeta de + 16 mV em pH fisiológico, evidenciando a
protonação dos grupos amina da L-Lisina na superfície das nanopartículas,
favorecendo a estabilidade coloidal do fluido e possibilitando a
interação eletrostática com os grupos fosfato do DNA.
A amostra NPDNA apresentou bandas referentes à maghemita/L-Lisina, como a banda
de estiramento Fe-O em 590 cm-1, estiramento O-H em 3400
cm-1; estiramento -CH2 em 2974 e 2933 cm-1, estiramento do
carboxilato em 1400 cm-1, além das bandas referente ao DNA, em 1049
cm-1 característica do estiramento C-O da ligação ribose-fosfato
(ARAKAWA et al., 2001) e a banda em 2850 cm-1 referente ao
estiramento C-H dos fragmentos de DNA.
A associação de DNA e dextrana à superfície das nanopartículas foi evidenciada
pelo aumento do raio hidrodinâmico das amostras NPDNAdex01 e NPDNAdex02 para 105
e 107 nm, respectivamente.
As quatro amostras NPDNAdex (Fig. 2) apresentaram, além das bandas
características da amostra NPDNA, bandas relacionadas à dextrana, em 1460 e
1340 cm-1 relativas à deformação C-H-OH e bandas em 1152 e 1014
cm-1 referentes ao estiramento C-O do anel α-glicosídeo (BAUTISTA et
al,2011), evidenciando que mesmo as amostras lavadas continham dextrana
associada.
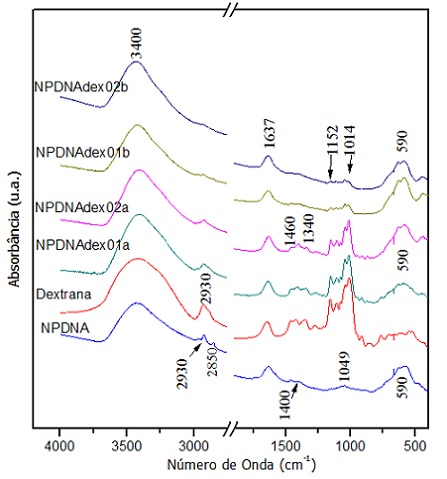
Espectros de infravermelho da dextrana e das amostras NPDNA e NPDNAdex (lavadas e não-lavadas).
Conclusões
O fluido magnético NPLis apresentou potencial zeta positivo em pH fisiológico, favorecendo a estabilidade coloidal do fluido e possibilitando a interação eletrostática com as moléculas de DNA. O aumento do raio hidrodinâmico após a adição de DNA e dextrana no fluido sugerem a associação destes à superfície das nanopartículas. A análise de FTIR evidenciou que, mesmo após a lavagem dos sólidos, a dextrana se mantem associada à superfície das nanopartículas, embora em menor quantidade.
Agradecimentos
CAPES, UFG, CNANO – UnB, INCT Nano.
Referências
ARAKAWA, H.; NEAULT, J. F.; TAJMIR-RIAHI, H. A. Silver(I) Complexes with DNA and RNA Studied by Fourier Transform Infrared Spectroscopy and Capillary Electrophoresis. Biophysical Journal, v. 81, n. 3, p. 1580–1587, 2001.
BABIC, M.; HORÁK, D.; TRCHOVÁ, M.; JENDELOVÁ, P.; GLOGAROVÁ, K.; LESNÝ, P.; HERYNEK, V.; HÁJEK, M.; SYKOVÁ, E. Poly(L-lysine)-modified iron oxide nanoparticles for stem cell labeling. Bioconjugate Chemistry, v. 19, n. 3, p. 740-750, 2008.
BAUTISTA, C. M.; MIGUEL, B. O.; MORALES. P. M. Surface characterization of dextran-coated iron oxide nanoparticles prepared by laser pyrolysis and coprecipitation. Journal of Magnetism and Magnetic Materials, v. 293, p. 20-27, 2005.
COHEN, J. L.; SCHUBERT, S.; WICH, P. R.; CUI, L. COHEN, J. A.; MYNAR, J. L.; FRÉCHET, J. M. J. Acid-Degradable Cationic Dextran Particles for the Delivery of siRNA Therapeutics. Bioconjugate Chemistry, v. 22, n.6, p. 1056–1065, 2011.
CUI, L.; COHEN, J. L.; CHU, C. K.; WICH, P. R.; KIERSTEAD, P. H.; FRÉCHET, J. M. Conjugation chemistry through acetals toward a dextran-based delivery system for controlled release of siRNA. Journal of the American Chemical Society, v. 134, n. 38, p. 15840–15848, 2012.
DURMUS, Z.; KAVAS, H.; TOPRAK, M. S.; BAYKAL, A.; ALTINÇEKIÇ, T. G.; ASLAN, A.; BOZKURT, A.; COȘGUN, S. L-lysine coated iron oxide nanoparticles: synthesis, sctructural and conductivity characterization. Journal of Alloys and Compounds, v. 484, n. 1, p. 371-376, 2009.
HONG, Y. R.; FENG, B.; CHEN, L. L.; LIU, H. G.; LI, Z. H.; ZHENG, Y.; WEI, G. D. Synthesis, characterization and MRI application of dextran-coated Fe3O4 magnetic nanoparticles. Biochemical Engineering Journal, v. 42, p. 290-300, 2008.
KNEUER, C.; SAMETI, M.; HALTNER, E. G.; SCHIESTEL, T.; SCHIRRA, H.; SCHMIDT, H.; LEHR, C. M. Silica nanoparticles modified with aminosilanes as carriers for plasmid DNA. International Journal of Pharmaceutics, v. 196, n. 2, p. 257-261, 2000.


















