ISBN 978-85-85905-15-6
Área
Materiais
Autores
Rabbers, A.S. (UFG) ; Vulcani, V.A.S. (UFG) ; Martins, V.C.A. (USP) ; Plepis, A.M.G. (USP) ; Rabelo, R.E. (UFG) ; Santos, G.P. (UFG) ; Oliveira, L.P. (UFG) ; Mascarenhas, L.J.S. (UFG) ; Assis, B.M. (UFG) ; Dutra, H.T. (UFG)
Resumo
Colágeno, gelatina e óleo de pequi, foram utilizados para desenvolvimento de biomembrana. A caracterização térmica do biomaterial foi por calorimetria diferencial de varredura (DSC) e termogravimetria (TG). As curvas de DSC apresentaram valores de temperatura de desnaturação de 53,2°C para membrana controle e 53,0°C para a membrana experimental, valores próximos ao referencial de desnaturação do colágeno. As curvas de TG mostraram alteração na massa em três fases, condizendo à perda de água, degradação das cadeias poliméricas e carbonização do material. A espectroscopia no infravermelho mostrou bandas características de cada material, indicando que não ocorreu interação entre o óleo e as proteínas. Verificou-se que o óleo de pequi não interfere no arranjo estrutural do colágeno.
Palavras chaves
Caryocar brasiliense Camb; polímeros; termogravimetria
Introdução
O termo biomaterial pode ser utilizado para toda substância de origem natural ou sintética, destinada à aplicação na interface com sistemas biológicos para tratar, aumentar ou substituir qualquer tecido, órgão ou função orgânica (WILLIANS, 1987). O colágeno possui características distintas como biomaterial, sendo a mais importante o modo de interação com os tecidos do organismo. Isso está associado, principalmente, à baixa resposta imunológica, baixa toxicidade e a habilidade de promover o crescimento celular. O seu uso vem aumentando consideravelmente como suporte biodegradável de crescimento celular na área da engenharia de tecidos, principalmente na forma de compósitos. O pequi (Caryocar brasiliense Camb.), fruto comum do cerrado brasileiro, tem sido associado à diversas propriedades medicinais, das quais a cicatrização de feridas tem despertado grande interesse pelos pesquisadores (BATISTA et al., 2010). No planejamento e desenvolvimento de biomateriais é necessário que sejam realizadas caracterizações físicas, químicas e biológicas para prever comportamentos na interface. Especificamente para polímeros naturais, como o colágeno, é interessante avaliar seu comportamento térmico, afim de compreender os mecanismos envolvidos nas alterações de massa, transições de fase, dentre outros aspectos, no intuito de demonstrar condições ideais de obtenção, esterilização e aplicações nos tecidos. Além disso, a espectroscopia de absorção no infravermelho permite analisar o efeito da interação da radiação eletromagnética com o material, obtendo informações sobre a estrutura e comportamento microscópico da matéria. Desta, o presente estudo teve como objetivo caracterizar o compósito a base de colágeno, gelatina e óleo de pequi quanto à suas características termogravimétricas e espectroscópicas.
Material e métodos
Para obtenção do colágeno, tendões bovinos foram lavados com solução salina 0,9% (NaCl) e água destilada, fragmentados e colocados em solução alcalina, que contém sais (sulfatos e cloretos) e hidróxidos de metais alcalinos e alcalinos terrosos, por 96 horas a aproximadamente 25oC (LACERDA et al., 1998). Após este período, os fragmentos foram colocados em outra solução contendo sulfatos e cloretos dos íons sódio, potássio e cálcio, durante 6 horas. O excesso de sais foi removido por lavagens em solução de ácido bórico (3%) e água deionizada, seguida por solução de EDTA 0,3% e água deionizada. O colágeno foi extraído com solução de ácido acético (pH 3,5). A concentração foi determinada por liofilização, obtendo-se um valor de 1,11%. A solução de gelatina 1% foi preparada utilizando gelatina SIGMA®, tipo A solubilizada em ácido acético (pH 3,5) sob agitação por 30 min a 60°C. As membranas foram preparadas a partir da mistura colágeno/gelatina na proporção 1:1 com a adição lenta de 0,5 mL de uma solução X para cada 10 g da mistura sob agitação vigorosa, durante 30 min. A solução X foi preparada de duas formas: (X1) - 1,5 mL de solução de ácido acético pH 3,5 + 1,5 mL de acetona, para obtenção da membrana controle (MCG); e (X2) - 1,5 mL de óleo de pequi + 1,5 mL de acetona, para obtenção da membrana com óleo de pequi (MCGOP). Após deareção das emulsões, casting em molde de teflon®, as membranas foram neutralizadas em vapor de amônio e deixadas sob fluxo de ar por 10 dias, para posterior análise. As curvas de calorimetria diferencial de varredura (DSC) foram obtidas em um equipamento TA Instruments, modelo DSC 2010. A razão de aquecimento foi de 10oC min-1, na faixa de aquecimento de 25 a 120oC, em atmosfera de nitrogênio. Foram utilizadas massas de aproximadamente 20 mg, em suportes herméticos de alumínio. As curvas termogravimétricas (TG) foram obtidas utilizando amostras de aproximadamente 10 mg, em atmosfera de ar sintético com variação de temperatura de 25 a 800oC e razão de aquecimento de 10oC min-1 em um equipamento TGA Q50 (TA Instruments). Para espectroscopia de absorção no infravermelho (FT-IR), o óleo foi gotejado em pastilha de silício e as amostras de MCG e MCGOP foram analisadas na forma de filmes após diluição das emulsões em solução de ácido acético pH 3,5, na proporção de 1:2. A análise foi feita em um intervalo entre 400 a 4000 cm–1, com 32 scans e resolução de 4 cm-1 utilizando-se um espectrofotômetro de FT-IR Shimadzu IR Affinity – 1.
Resultado e discussão
As curvas DSC (Fig. 1A) permitiram a determinação da temperatura de
desnaturação (Td) do colágeno presente nos filmes. Os valores de Td foram de
53,2 e 53,0°C para MCG e MCGOP, respectivamente, ou seja, valores próximos
ao referencial de desnaturação do colágeno (E’GUES et al., 2008). Dessa
forma, é verdadeiro afirmar que a presença do óleo de pequi não modifica a
estrutura de tripla hélice do colágeno.
As curvas TG (Fig. 1B) apresentam perda de massa ocorrendo em três etapas: o
primeiro refere-se à água presente (25-200ºC), o segundo, à degradação
térmica das cadeias poliméricas (200-500ºC) e o terceiro, (500-700ºC), a
carbonização do material degradado. A maior diferença que pode ser observada
está em relação ao conteúdo de água presente nas membranas. A membrana MCGOP
tem um conteúdo de 3,7% de água presente, enquanto a membranas MCG tem 15%.
O espectro no infravermelho (Fig. 2) do óleo de pequi mostra bandas na
região de aproximadamente 3020 a 2780 cm–1, referentes à ligação C-H de
alcanos. A banda em 1743 cm–1, referente ao estiramento do grupo carbonila
(C=O), característico dos ésteres. As vibrações da ligação C–O em 1238, 1163
e 1116 cm-1 são diagnósticos para a ligação éster no triacilglicerol. As
bandas em 1464 e 721 cm-1 são referentes à deformação angular da ligação C-H
simétrica e assimétrica, respectivamente.
No espectro da mistura colágeno/gelatina (MC) observa-se uma banda larga
próxima a 3325 cm-1 devido ao estiramento O-H. Em 1659 cm-1, a banda típica
de amida I, devido ao estiramento da carbonila; em 1556 cm-1, relacionada à
amida II, devido as vibrações no plano da ligação N-H e ao estiramento C-N;
em 1454 cm-1, correspondente a estereoquímica dos anéis pirrolidínicos; em
1242 cm-1, corresponde as vibrações no plano da amida III, devido ao
estiramento C-N e a deformação N-H; em 738 e 611 cm-1 são referentes a
deformação angular da ligação N-H.
Para a membrana MCGOP o espectro no infravermelho mostra as bandas
características de cada material, sem deslocamentos, indicando que não
ocorreu interação entre o óleo e as proteínas.
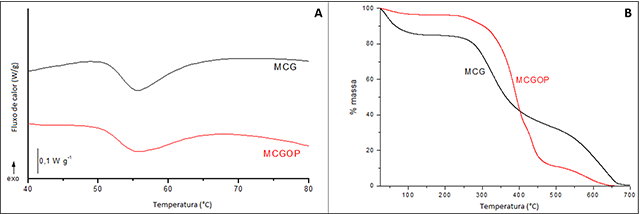
A)Curva DSC para as membranas testadas; B)Curvas termogravimétricas para as membranas testadas.
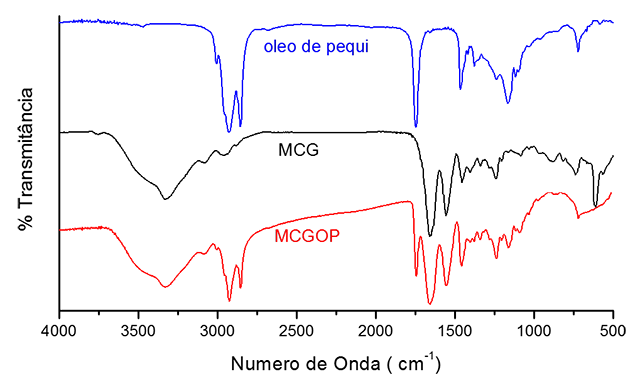
Espectro na região do infravermelho para óleo de pequi, colágeno/gelatina e colágeno, gelatina e óleo de pequi.
Conclusões
Por meio dos testes realizados nesse trabalho foi possível verificar que o óleo de pequi não interfere no arranjo estrutural do colágeno, sendo mantida a tripla hélice. Este resultado é importante, visto que a estrutura helicoidal do colágeno é responsável em grande parte por suas propriedades mecânicas e biológicas.
Agradecimentos
Laboratório de Bioquímica e Biomateriais – Instituto de Química de São Carlos; Centro Nacional de Desenvolvimento Científico e Tecnológico; Fundação de Amparo à Pesqu
Referências
BATISTA, J.S.; SILVA, A.E.; RODRIGUES, C.M.F.; COSTA, K.M.F.M.; OLIVEIRA, A.F.; PAIVA, E.S.; NUNES, F.V.A.; OLINDA, R.G. Avaliação da atividade cicatrizante do óleo de pequi (Caryocar coriaceum Wittm) em feridas cutâneas produzidas experimentalmente em ratos. Arq Inst Biol, v.77, n.3, 441-447, 2010.
E’GUES, M.A.M.; PAULA, M.; GOISSIS, G. Compósito de colágeno com silicato e hidroxiapatita como material para endodontia: preparação e caracterização. Ver Odonto Ciênc., v.23, n.2, p.134-140, 2008.
LACERDA, C.; PLEPIS, A. M. G.; GOISSIS, G. Hidrólise seletiva de carboxiamidas de resíduos de Asparagina e Glutamina em colágeno: preparação e caracterização de matrizes aniônicas para uso como biomateriais. Química Nova, v. 21, p. 267-271, 1998.
WILLIAMS, D.F. Definitions in Biomaterials. Proceedings... Consensus Conference of the European Society for Biomaterials, Chester, England, March 3-5, 1986.


















