ISBN 978-85-85905-15-6
Área
Físico-Química
Autores
de Brito, H.G. (LQTC/UFPA) ; Oliveira, L.F.S. (LQTC/UFPA) ; Pinheiro, A.C.B. (FACULDADE DE MEDICINA-UFPA) ; Costa, O.N. (LQTC/UFPA) ; Santos, M.A.B. (LQTC/UFPA) ; Figueiredo, A.F. (INSTITUTO FEDERAL DE CIENCIA E TECNOLOGIA DO PARÁ) ; Ciriaco Pinheiro, J. (LABORATÓRIO DE QUÍMICA TEÓRICA E COMPUTACIONAL)
Resumo
Opiódes Analgésicos foram estudados usando mapa de potencial eletrostático molecular (molecular electrostatic potetial, MEP) e docking molecular. Inicialmente, métodos quimiométricos (principal component analysis, PCA e HCA, hierarchinal cluster analysis) foram usados para selecionar a aproximação teórica (HF/6-31**) mais adequada ao desenvolvimento dos estudos moleculares. Em uma segunda etapa, cálculos para o MEP e para o complexo opióide-alvo biológico foram desenvolvidos e as características estruturais, eletrônicas e de interação ligante-receptor opióide, necessárias para existência da atividade analgésica, foram investigadas. As evidências obtidas na analise dos resultados podem ser usadas no planejamento e síntese de novas moléculas com atividade biológica analgésica.
Palavras chaves
Opióides; MEP; Docking molecular
Introdução
Os opióides são de fundamental importância no tratamento da dor. De acordo com a literatura (GUSTSTEIN & AKIL, 1998), esses fármacos exercem seus efeitos terapêuticos simulando a ação dos peptídeos opióides endógenos nos receptores opióides. As ações nos neurônios locais e circuitos intrínsecos envolvidos na modulação da dor causam analgesia, dentre outros efeitos terapêuticos e efeitos colaterais indesejáveis. A liberdade conformacional limitada da morfina (ALLEN, 2002) tem possibilitado o estudo da sua interação com os receptores opióides como proveitosa referência no entendimento da estrutura de narcóticos analgésicos ou agonistas. Neste trabalho, apresentamos uma investigação das características estruturais e eletrônicas necessárias para que um opióide se comporte como analgésico. No estudo, o ponto de partida foi o estabelecimento do método e função de onda adequada, para a realização dos cálculos, através de PCA e HCA. Mapas de MEP (POLITZER et al., 1985) foram construídos para mitraginina e corinanteidalina e comparadas, suas estruturas moleculares e densidades eletrônicas, com aquelas obtidas para morfina (RAFFA et al., 2013), na busca da compreensão da relação estrutura - atividade desses compostos. Também foram desenvolvidos cálculos para o complexo molecular formado pelo opióide e o receptor opióide µ (mu opioid recptor, MOR), buscando compreender o modo de interação ligante-receptor e o seu reflexo na atividade biológica.
Material e métodos
Os cálculos moleculares foram feitos em um processador AMD PHENOM 955 usando o pacote Gaussian 98. O programa Pirouett foi usado na etapa quimiométrica. Na obtenção do MEP e no estudo da interação ligante-recptor foram usados os programas Molekel e Autodock 4.2, respectivamente. A molécula de mitraginina (CARVALHO, 2009) foi otimizada com diferentes métodos e conjuntos de bases da química quântica, em seguida foi construída uma matriz de dados de dimensão 66 X 21 (66 linhas correspondentes aos parâmetros geométricos; e 21 colunas construídas com os métodos (20 teóricos e 1 experimental). Essa matriz foi analisada usando PCA e HCA e selecionada a aproximação HF/6-31G** que foi usada nos cálculos. A utilização de PCA e HCA possibilitou a seleção dessa aproximação em um espaço tridimensional. Todas as estruturas foram otimizadas e as propriedades foram calculadas na conformação mais estável de cada molécula. Os Mapas de MEP foram obtidos da densidade eletrônica e visualizados usando o programa Molekel. As interações ligante-receptor, energia de interação e distancias interatômicas, foram obtidas com o algoritmo Lamarckiano, considerando para cada interação o cálculo de 100 conformações e aquela correspondente a energia de interação mais baixa foi escolhida para nossa análise. Uma vez que a analgesia dos opióides é mediada por uma interação complexa entre os receptores µ (um), δ (delta) e κ (kappa), de acordo com a literatura, em relação à ação supra-espinhal, os receptores µ parecem ter a influência mais importante, enquanto os receptores δ e κ estão envolvidos com a ação espinhal (GOZZANI, 1994). Por essa razão, os estudos da interação ligante-receptor foram desenvolvidos considerando o receptor µ. A proteína MOR foi obtida no Banco de dados de Proteínas (PDB), código 4DKL (MANGLIK et al., 2012).
Resultado e discussão
a) Análise Quimiométrica
A Figura 1 mostra o (a) gráfico dos scores obtido pelo PCA (PC1-PC2) e (b) o dendrograma obtido pelo HCA para os métodos teóricos e dados experimentais da mitraginina (CARVALHO, 2009). Na Figura 1a a aplicação da PCA separou os métodos em duas classes: métodos semi-empíricos; e outros métodos (teóricos e experimental). De acordo com essa figura, o método HF/6-31G** encontra-se mais próximo do experimental. Na Figura 1b os métodos estão formandos vários agrupamentos e HF/6-31G** situa-se mais próximo do experimental, ou seja, o resultado do HCA confirma a PCA. Desse modo, o método mais adequado para desenvolver o estudo é HF/6-31G**.
b) Estrutura molecular, densidade eletrônica e docking molecular da morfina, mitraginina e corinanteidalina
Na Figura 2 são mostradas as estruturas moleculares em 2D, os mapas de MEP e os docking moleculares para morfina [(a), (b) e (c)], mitraginina [(d), (e) e (f)] e corinanteidalina [(g), (h) e (i)], respectivamente.
Análise da estrutura molecular 2D da morfina
A análise da estrutura química 2D da morfina (Figura 2a) evidencia três grupos funcionais (o átomo N terciário no sitio aniônico, o resíduo benzênico na região hidrofóbica e a hidroxila fenólica no sitio fenólico) que, de acordo com a literatura, são tradicionalmente considerados importantes na ligação dos opióides ao receptor e, portanto, na atividade analgésica dessas moléculas (DHAWAN et al, 1996; GOZZANI, 1994).
Análise do MEP da morfina
Na Figura 2b é mostrado o mapa de MEP para morfina. A analise do mapa de MEP mostra uma região negativa (cores vermelho, laranja, amarelo e verde), cujos valores situam-se entre -79,7 e -4,27 kcal/mol. A região com maior concentração de densidade eletrônica na molécula contém o N terciário do sitio aniônico, o resíduo benzênico da região hidrofóbica e o hidróxido fenólico do sitio fenólico, a mema pode sofrer o ataque eletrofílico por um alvo biológico. Também nessa figura, pode-se notar a presença de uma região de MEP positivo (cor verde) com valores no intervalo 1,12 a 28,1 kca/mol, suscetível a ataque nucleofilico por outra molécula.
Análise do docking molecular da morfina
Na Figura 2c, a analise do docking molecular para morfina revela que a geometria do complexo formado (ligante-MOR) ocorre preferencialmente disposta no sitio aniônico dos ligantes, assumindo a orientação próxima do aminoácido, mais especificamente na posição que propicia melhor acoplamento ao sitio aniônico (átomo N terciário) do ligante com o aminoácido asparagina (asparagin, ASP) 147 do MOR. Isto pode ser evidenciado através da interação experimental ligante-receptor reportada na literatura (MANGLIK et al., 2012). Os resultados obtidos mostram que a distância entre o átomo de N terciário (sitio aniônico) da morfina e ASP 147 de MOR corresponde a 2,69Å, portanto, muito próximo do dado experimental (2,62 Å). Também o resultado obtido para a energia de ligação morfina-MOR corresponde a -7,39 kcal/mol.
Análise da estrutura molecular 2D da mitraginina
A Figura 2d mostra a estrutura 2D da mitraginina. Uma comparação entre as moleculas de mitraginina e de morfina sugere algumas similaridades nas estruturas químicas desses opióides. Assim como na morfina, a mitraginina apresenta os três grupos funcionais (o átomo N terciário no sitio aniônico, o resíduo benzênico na região hidrofóbica e a hidroxila fenólica no sitio fenólico) importantes para a ligação com o MOR e para atividade analgésica dessa substância.
Análise do MEP da mitraginina
Na Figura 2e é mostrado o mapa de MEP para mitraginina. Nessa figura pode se notar uma região de MEP negativo, similar a morfina, (cores vermelho, laranja, amarelo e verde), caracterizada por valores situados entre -62,1 e -1,44 kcal/mol. Nessa região da molécula concentra-se maior densidade eletrônica, que pode sofrer ataque eletrofílico do receptor opióide. Também na referida região verifica-se a presença do sitio aniônico contendo o átomo N terciário, a região hidrofóbica contendo o resíduo benzênico e o sitio fenólico contendo o hidróxido fenólico. Também o MEP da mitraginina apresenta uma região de valores negativos (cor verde), situados entre 3,22 e 31,2 kcal/mol, que pode sofre ataques nucleofilicos por outra molécula.
Análise do docking molecular da mitraginina
Na Figura 2f é mostrado o docking molecular da mitraginina, a interação dessa molécula com o receptor é similar à interação morfina-MOR. Também pode ser verificado que a orientação na formação do complexo molecular ocorre preferencialmente disposta na posição que propicia acoplamento do sitio aniônico (átomo N terciário) do ligante com o aminoácido ASP 147 do MOR. Os resultados obtidos mostram que a distância entre o átomo N terciário (sitio aniônico) da mitraginina a ASP 147 de MOR corresponde 2,98Å, próximo a valore obtido para morfina (2,69 Å), evidenciando um acoplamento satisfatório das duas estruturas e o resultado obtido para a energia de ligação mitraginina-MOR é -6,04 kcal/mol.
Análise da estrutura molecular 2D da corinanteidalina
A Figura 2g mostra a estrutura 2D da corinanteidalina. Nessa figura, verifica-se a presença de apenas dois (o N terciário do sítio aniônico e o resíduo benzênico na região hidrofóbica) dos três grupos funcionais importantes para a atividade analgésica. Nessa molécula não ocorre a presença da hidroxila fenólica e do sítio fenólico. Portanto, diferentemente da morfina e da mitraginina, a corinanteidalina não apresenta atividade analgésica.
Análise do MEP da corinanteidalina
Na Figura 2h é mostrado mapa de MEP para corinanteidalina. Nessa figura, nota-se uma região de MEP negativo (cores vermelho, laranja, amarelo e verde), caracterizada por valores situados entre -58,3 e -3,59 kcal/mol, e correspondente ao sítio aniônica e ao resíduo benzênico. Nesta região da molécula concentra-se maior densidade eletrônica, que pode sofrer ataque eletrofílico do receptor opióide.
Análise do docking molecular da corinanteidalina
Na Figura 2i é mostrado o docking molecular da corinanteidalina, a interação da molécula com o MOR difere da interação da morfina e da mitraginina com esse receptor em decorrência da orientação não favorável na formação do complexo (corinanteidalina-MOR), o que não proporciona um bom acoplamento do sitio aniônico (átomo de N terciário) do ligante com o aminoácido da proteína. Os resultados obtidos mostram que a distância entre o átomo N terciário no sitio aniônico à ASP 147 do MOR corresponde a 4,89Å. A energia de ligação corinanteidalina-MOR é -5,75 kcal/mol. Diferentemente do acoplamento da morfina e mitraginina com MOR, a interação ligante-receptor não favorece a manifestação de atividade analgésica.
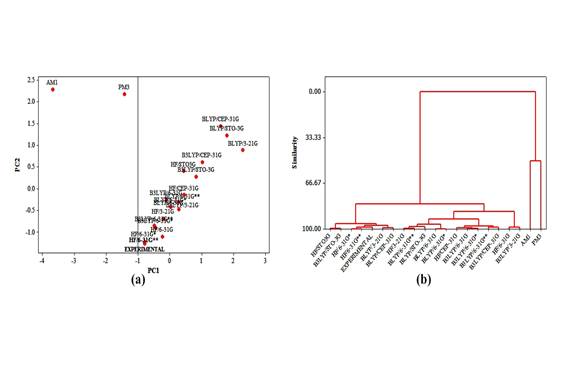
(a) Gráfico dos scores obtido da PCA (PC1-PC2) e (b) dendrograma obtido da HCA para os métodos teóricos e dados experimentais da mitraginina.
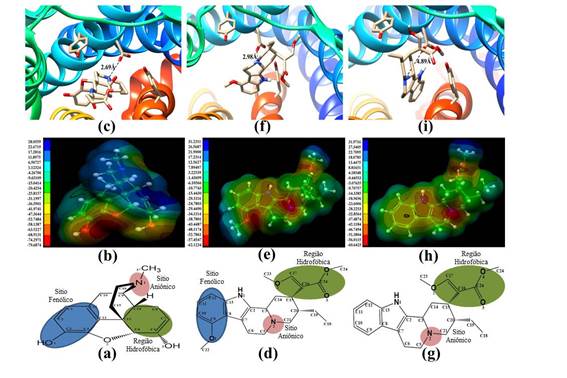
(a), (d), (g) estrutura 2D; (b), (e), (h) mapa de MEP e ( c), (f), (i) docking molecular da morfina, mitraginina e corinanteidalina, respectivamente.
Conclusões
Os cálculos envolvendo química quântica foram desenvolvidos na aproximação HF/6-31G** selecionada com a ajuda de PCA e HCA. As estruturas 2D para morfina e mitraginina apresentam grupos funcionais (átomo N terciário no sitio aniônico, o resíduo benzênico na região hidrofóbica, e a hidroxila fenólica no sitio fenólico) tradicionalmente importantes para a ligação com o MOR e, portanto, para a atividade analgésica desses compostos. A estrutura 2D para corinanteidalina por apresentar apenas dois desses grupos (o átomo de nitrogênio terciário no sitio aniônico, o resíduo benzênico na região hidrofóbica ), quando interage com receptor MOR comporta-se biologicamente inativa. Os mapas de MEP da morfina e mitraginina evidenciaram um comportamento da densidade eletrônica similar nas regiões do sitio aniônico, região hidrofóbica e sitio fenólico, enquanto a densidade eletrônica observada no mapa de MEP para corinanteidalina concentra-se apenas na região hidrofóbica e no sitio aniônico. A análise dos docking molecular para morfina e mitraginina mostrou similaridade e as distancias de interação entre N terciário do opióide e o MOR foram, respectivamente, 2,69 Å para morfina e 2,98 Å para mitraginina. Por sua vez, as energias de interação dois opióides-MOR foram -7,39 e -6,04 kcal/mol, respectivamente. Para a molécula de corinanteidalina, a distância e energia de interação com o MOR são, respectivamente, 4,89 Å e -5,75 kcal/mol. As evidencias apresentadas e discutidas neste trabalho poderão suportar o desenvolvimento e síntese de novas moléculas opióides com atividade biológica analgésica.
Agradecimentos
Ao CNPQ pelo suporte financeiro, ao LQTC-UFPA e ao Swiss Center for Scientific Computing pelo uso do programa Molekel.
Referências
ALLEN, F. H. Acta Cryst B58, 2002, 380-388.
CARVALHO, P.; FURR III E. B.; MCCURDY C. B. Acta Cryst E65, 2009, 1441-1442.
DHAWAN, B. N.; CESSELIN, F.; RAGHUBIR, R.; REISINE, T.; BRADLEY, P. B.; GOZZANI, J. L. Opióides e Antagonista. Rev Bras Anestesiol 44,1994, 65-73.
GUTSTEIN H. B. e AKIL H. Analgésicos opióides. In: As Bases Farmacológicas da Terapêutica, REISINE,T; PASTERNAK, G (eds.), cap. 23, McGraw-Hill, Rio de Janeiro, 1998.
MANGLIK, A.; KRUSE, A. C.; KOBILKA, T. S.; THIAN, F. S.; MATHIESEN, J. M.;
POLITZER, P.; LAURENCE, P. R.; JAYASURIYA, K. Environ Healt Perspect 61, 1985, 191-202.
PORTOGHESE, P. S.; HAMON, M. Pharmacol Rev 48, 1996 567−592.
RAFFA, R. B. et al. J Med Chem 56, 2013, 4840-4848.
SUNAHARA, R. K.; PARDO, L.; WEIS, W. I. ; GRANIER, S. Nature 485, 2012, 321-326.


















