ISBN 978-85-85905-15-6
Área
Físico-Química
Autores
Lobato, J.R.B.L. (LQTC-UFPA) ; Aquino, E.L.C. (LQTC-UFPA) ; Oliveira, L.F.S. (LQTC-UFPA) ; Figueiredo, A.F. (LQTC-UFPA) ; Pinheiro, J.C. (LQTC-UFPA) ; de Brito, H.G. (LQTC-UFPA)
Resumo
Neste trabalho uma série de 22 compostos derivados de chalcona, foram modelados e a otimização das geometrias foi realizada com o método B3LYP\6- 31G*. Os métodos quimiométricos PCA e HCA serviram para selecionar os descritores Refratividade Molar (RM), (HOMO energy) e o ângulo de ligação (C3C4C9 AL) que melhor descrevem a relação estrutura molecular e atividade biológica dos compostos estudados. Os mapas de MEP auxiliaram na identificação de características estruturais e eletrônicas necessárias para existência da atividade biológicas dos derivados e foram construídos para os compostos 13 e 20 do classe das chalconas e seus análogos. Os estudos com PCA, HCA e mapas de MEP podem ser usados no planejamento e síntese de novos derivados com atividade leishmanicida.
Palavras chaves
Leishmania; Atividade leishmanicida; Mapas de MEP
Introdução
As doenças infecciosas no mundo são classificadas de acordo com o agente etiológico em protozoários, vírus, fungos e bactérias. Esta classificação está baseada nas características biológicas do agente. A transmissão e a manutenção de uma doença na população humana são resultantes do processo interativo do agente com o meio ambiente e o hospedeiro humano (NEVES, 2005). Química Medicinal procura estudar as razões moleculares de ação de fármacos e a relação entre sua estrutura química e atividade farmacológica, incluindo o desenho estrutural de novas substâncias que, quando apresentam propriedades farmacoterapeuticas úteis, podem tornar-se um novo fármaco (BARREIRO et al.,2001). Esta ciência caracteriza-se pela inter e multidisciplinaridade, uma vez que vários fatores estão envolvidos na utilização terapêutica de uma molécula, como estudos de química computacional, química sintética, físico-química orgânica, biofísica, bioquímica, biologia molecular, fisiologia, patologia, clínica médica, entre outros (AMARAL; MONTANARI, 2002). Leishmaniose A leishmaniose é uma doença negligenciada e representa um conjunto de enfermidades diferentes entre si, que podem comprometer pele, mucosas e vísceras, dependendo da espécie do parasito. São infecções crônicas, não contagiosas, causadas por diversas espécies de protozoários do gênero Leishmania, (Fundação Nacional de Saude, 2000). A transmissão do parasito ocorre pela picada das fêmeas hematófagos infectadas dos insetos da família Psychodidae, subfamília Phlebotminae e dos gêneros Phlebotomuse Lutzomyia (VENDRAMETTO et al., 2010). A partir do conhecimento do ciclo de vida dos parasitos, diferentes estratégias de ataque às doenças têm sido propostas, visando à interrupção da transmissão. Entre elas destacam-se os Programas de Erradicação, propostos pela Organização Mundial de Saúde – OMS, (WHO, 2010). A forma mais eficiente de combate a leishmaniose ainda é a eliminação do vetor. As terapias amplamente utilizadas foram introduzidas há mais de 50 anos, apresentam alta toxicidade e efeitos colaterais indesejados somados ao modo de administração parenteral e o tempo prolongado de tratamento, tipicamente de várias semanas (HERWALDT, 1999; CROFT et al., 2006). Os antimoniais pentavalentes são os fármacos de primeira escolha usados no tratamento de todas as formas de leishmanioses. Os dois antimoniais pentavalentes mais usados são: antimoniato de metilglucamina (Glucantime®) e Gluconato de antimônio (V) de sódio (Pentostan®) (PATEL, SHAH, 2008). Além dos antimoniais, outras drogas têm sido empregadas no tratamento das diversas formas da leishmaniose, entre as quais se destacam a anfotericina B, pentamidina e miltefosine (RATH et al., 2003). Nas últimas décadas, pode-se perceber um grande interesse na investigação de substâncias ativas de origem natural que possam chegar à fase de ensaios clínicos (SCHENKEL, et al., 2001), as quais, na maioria das vezes, são alvos de estudos contínuos para melhorar suas características farmacodinâmicas e farmacocinéticas. Diversos produtos naturais têm sido empregados como matéria-prima e como protótipos para a síntese de diferentes substâncias bioativas, principalmente por serem fontes renováveis. Os primeiros estudos da atividade leishmanicida de chalconas aparecem com o isolamento da licochalcona A. Em ensaios com macrófagos humanos parasitados, apresentou um grande efeito inibitório no crescimento das formas amastigotas e promastigota das espécies Leishmania major e Leishmania donavani, em concentrações não tóxicas para as células. Apesar de progressos importantes e dos conhecimentos fundamentais sobre o parasita Leishmania, a atual terapia para leishmaniose ainda é insatisfatória, devido a fatores, como: limitada eficácia, efeitos adversos indesejáveis, longo prazo e alto custo do tratamento. Na busca de novos compostos com potencial leishmanicida, objetivou-se, com este estudo, gerar informações estruturais e eletrônicas responsáveis pela atividade biológica das chalconas e que possam ser uteis no desenvolvimento de novos protótipos a fármacos, os quais deverão apresentar um melhor perfil de atividade leishmanicida em menor tempo de tratamento e menos efeitos adversos em relação às terapias existentes.
Material e métodos
Os compostos utilizados foram retirados da literatura (LIU et al., 2003) e foram testados biologicamente contra Leishmania donavani. Para o nosso estudo consideramos a seguinte hipótese: Compostos mais ativos (+) apresentam ED50 ≤ 7 e compostos menos ativos (-) aqueles com ED50 > 7. A estrutura básica dos derivados estudados corresponde a 4’- hidroxichalcona, Figura 1a. Inicialmente a mesma foi construída e pré- otimizada com programa HyperChem, seguida de uma busca conformacional com o programa Gaussian 98 (B3LYP\6-31G*). A conformação mais estável da molécula foi usada na construção dos demais derivados que foram também otimizados. Com as estruturas moleculares dos compostos foram calculadas propriedades (descritores) usados na construção de dados de dimensão 22 linhas e 871 colunas (22x871,) que foi em seguida decomposta em uma matriz de scores e uma matriz de loadings (PCA). A matriz de dados foi também analisada usando HCA. Os mapas de MEP foram computados da densidade eletrônica e visualizados com o programa Molekel (MURRAY; POLITZER, 2009).
Resultado e discussão
Quimiometria
A Figura 1 mostra o gráfico dos scores (a), o gráfico dos loadings (b) e o
dendrograma obtido com a HCA dos 22 compostos estudados. De acordo com a
Figura 1a, a aplicação da PCA separou os derivados em PC1 em duas classes:
compostos mais ativos (+AT): 7, 12, 13, 14, 15, 16, 17, 18, 19, 20 e 21; e
compostos menos ativos (-AT): 1, 2, 3, 4, 5, 6, 8, 9, 10, 11 e 22. O modelo
PCA foi construído com três componentes principais: PC1 = 61,76; PC2 =
32,17; e PC3 = 6,06%, mantendo 99,9 % da informação original, e os
descritores responsáveis pela separação são: RM, HOMO energy; AL. A analise
da Figura 1b mostra que o descritor AL é responsável pelo deslocamento dos
compostos mais ativos para o lado esquerdo do gráfico, enquanto que os
descritores HOMO energy e AL deslocam os compostos menos ativos para o lado
direito do gráfico de loadings.
Para o planejamento de novos compostos podemos usar a seguinte equação:
PC1 = 0,68RM + 0,54 HOMO energy – 0,47 AL
(1)
Compostos mais ativos serão planejados com a inclusão de substituintes que
forneçam menores valores de RM combinados com baixos valores de HOMO energy
e maiores valores de AL.
Na Figura 1c a HCA confirma a PCA. De acordo com a Figura 1c as duas classes
principais: mais ativos (+AT); e menos ativos (–AT), são compostos por três
agrupamentos: A, B e C, sendo que os mais ativos encontram-se agrupados no
cluster C.
Estrutura molecular 2D e Mapas de MEP
Na Figura 2 são mostradas a estrutura molecular 2D e o mapa de MEP para 4’-
Hidroxichalcona. A estrutura molecular 2D do composto 13 (Figura 2a), de
acordo com a literatura, deve sofrer substituições no anel A e/ou B desse
composto. Os compostos mais ativos apresentam, de modo geral, a presença do
grupamento hidroxila no anel B, na posição orto (5) e/ou meta (6) e/ou para
(7), enquanto que os compostos menos ativos apresentam o anel aromático B
triplamente, di ou mono substituído por grupos metoxilas, desse modo, para
se obter, em geral, compostos ativos deve-se fazer substituições de acordo
as observações anteriormente mencionadas.
A Figura 2b mostra o mapa de MEP para o composto 13. Nessa figura, verifica-
se uma região de MEP negativo (cores vermelho e amarelo), cujo valor mínimo,
Vr = - 0,165 u.a., indicando um sitio passível de ataque eletrofílico de um
alvo biológico. Isto se deve a presença de pares de elétrons isolados dos
átomos de oxigênio da carbonila e da hidroxila do anel B. Também verifica-se
uma região de MEP positivo (cores verde e azul), de potencial máximo Vr =
0,338 u.a., indicando um sítio com possibilidade de ataque nucleofílico por
um receptor biológico.
A Figura 2c apresenta a estrutura química 2D do composto 20. Neste composto,
observamos que o anel B sofreu modificação da hidroxila, da posição 7 para
posição 5, enquanto que o anel A, modificou-se pela adição do anel
piridinil, em substituição ao anel benzênico. Desse modo compostos ativos
também podem ser obtidos através de modificações da posição da hidroxila do
anel B e da inclusão de substituintes no anel A.
Na Figura 2d é mostrado o MEP para o composto 20. Dessa figura nota-se um
MEP negativo (cores vermelho e amarelo), com concentração da densidade
eletrônica no oxigênio da hidroxila da posição 5 do anel B, na carbonila e
no nitrogênio do anel A (piridinil) em decorrência da existência de pares de
elétrons isolados nestes átomos. Neste caso, o potencial mínimo,
Vrmin = - 0,166 u.a.. Essa região pode sofrer um ataque eletrofílico por um
receptor biológico.
O estudo dos mapas de MEP para os compostos 13 e 20 evidenciou que os
processos biológicos envolvendo os dois compostos poderão ocorrer por ataque
eletrofílico ou nucleofílico. O estudo quimiométrico desenvolvido revelou a
importância do descritor HOMO energy na relação estrutura atividade das 22
chalconas estudadas. Isto evidencia a importância desse orbital de fronteira
nos processos biológicos envolvendo as chalconas e seus análogos e um
receptor biológico (desconhecido). Portanto o processo de interação ligante
receptor necessariamente deverá ocorrer através da reação de transferência
de elétrons das chalconas e seus análogos para o alvo biológico
(desconhcido)
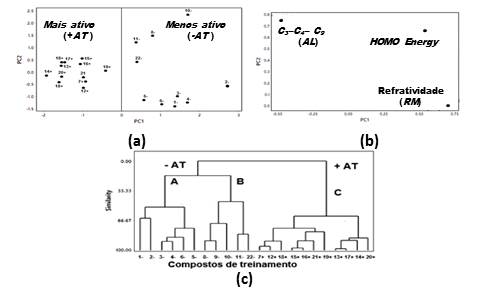
(a) gráfico dos scores, PC1×PC2, (b) gráfico dos loadings, (c) dendograma obtido por HCA para os compostos estudados.
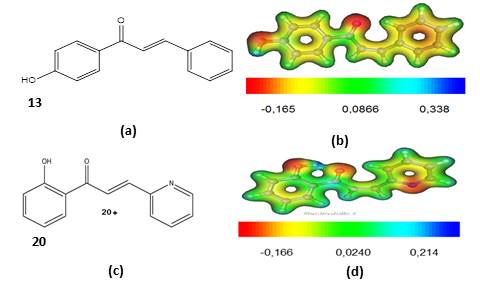
Estrutura 2D [(a), (c)] e Mapa de MEP [(b), (d)] dos compostos 13 e 20, respectivamente.
Conclusões
A analise de componentes (PCA) e a Analise de Agrupamento (HCA) serviram para selecionar os descritores Refratividade Molar (RM), Energia do Orbital mais alto ocupado (HOMO energy) e o ângulo de ligação (C3C4C9 AL) que melhor descrevem a relação estrutura molecular e atividade biológica dos compostos estudados. Neste trabalho uma série de 22 compostos derivados de chalcona, foram modelados e a otimização das geometrias foi realizada com o método B3LYP\6- 31G*. A aplicação da análise estatística multivariada (PCA e HCA, possibilitou a seleção dos descritores Refratividade, HOMO energy (εHOMO) e o ângulo de ligação (AL) C(3)-C(4)-C(9), como os mais importantes na classificação dos compostos em mais ativos (+AT 7, 12-21) e menos ativos (-AT 1-6, 8-11 e 22). A seleção feita em PC1, com 3 PCs, PC1 = 61,76%, PC2 = 32,17% e PC3 = 6,06 % manteve 99,9 % da informação original. O ângulo AL (C3C4C9) deslocou os compostos (+AT) para o lado esquerdo do gráfico dos scores e HOMO energy e RM deslocaram os compostos (–AT) para o lado direito do gráfico. Os mapas de potencial eletrostático molecular (MEP) dos compostos 13 e 20, relatados no trabalho mostram que há uma similaridade na superfície próxima a região da carbonila caracterizando uma região de potencial eletrostático (MEP) negativo, sugerindo ser um sítio reativo com possibilidades de interações eletrofílicos com receptores biológicos. Para o planejamento de novos compostos podemos usar a seguinte equação: PC1 = 0,68RM + 0,54 HOMO energy – 0,47 AL (1) Compostos mais ativos serão planejados com a inclusão de substituintes que forneçam menores valores de RM combinados com baixos valores de HOMO energy e maiores valores de AL. Os estudos envolvendo quimiometria e MEP poderão ser usados como auxiliares no planejamento e síntese de novos derivados de chalconas com atividade leishmanicida.
Agradecimentos
A Universidade Federal do Pará (UFPa); Aos membros do Laboratório de Química Computacional (LQTC)
Referências
AMARAL, A. T. do; MONTANARI, C. A. Química Medicinal: 25 anos de planejamento racional de fármacos. Química Nova, v. 25, n. 1, p. 39-44, 2002.
BARREIRO, E. J. Desenho de Fármacos a partir de Produtos Naturais. In: YUNES, R. A.; CALIXTO, J. B. (ed.). Plantas Medicinais: sob a ótica da Química MedicinalModerna. Chapecó: Argos, 2001. Cap. 7, p. 238-260.
CROFT, S. L.; SUNDAR, S.; FAIRLAMB, A. H. Drug Resistance in Leishmaniasis.Clin. Microbiol. Rev, v. 19, p. 111-126, 2006.
Fundação Nacional de Saúde. Manual de Controle da Leishmaniose Tegumentar Americana. Ministério da Saúde; 2000 p. 7-37,
HERWALDT, B. L. Leishmaniasis. The lancet, v. 354, p. 1191-1199, 1999.
Liu, M. et al.,. Structure–Activity Relationships of Antileishmanial and Antimalarial Chalcones. Bioorganic & Medicinal Chemistry 11 (2003) 2729–2738.
MURRAY, J. A. S.; POLITZER, P. Molecular surfaces, van der Waals radii and electrostatic potentials in relation to noncovalent interactions. Croatica Chemica Acta. v. 82, p. 267-275. 2009.
NEVES, D. P.; ET AL. Parasitologia Humana. 11. São Paulo: Editora Atheneu, 2005.
PATEL, J. A.; SHAH, K. G. Leishmaniasis: a review. Pharmacologyonline, v. 2, n. 1, 2008.
RATH, S. et al.,. Antimoniais empregados no tratamento daleishmaniose: estado da arte. Química Nova, v. 26, 2003 .
SCHENKEL, E. P.; GOSMANN, G.; PETROVICK, P. R. Produtos de origem vegetal e o desenvolvimento de medicamentos. In: Simões, C. M. O.; Schenkel, E. P.; Gosmann, G.; Mello, J. C. P.; Mentz, L. A.;. Petrovick, P.R. (org.) Farmacognosia: da planta ao medicamento. 3.ed. Porto Alegre/Florianópolis: Editora da Universidade UFRGS / Editora da UFSC, Capítulo 15, p. 301-332, 2001.
VENDRAMETTO, M. C. et al. Evoluation of antileishimanial activity of eupomatenoid-5, a compound isolated from leaves of Piper regnelli var. pallescens.Parasitol. IInter, v. 59, p. 154-158, 2010. .
WHO, WORLD HEALTH ORGANIZATION. Parasitological Confirmation of Malaria Diagnosis: WHO Technical Consultation, Geneva, 6-8 October 2009, 2010.


















