ISBN 978-85-85905-15-6
Área
Físico-Química
Autores
Magri, V.R. (UNESP/IBILCE) ; Fertonani, F.L. (UNESP/IBILCE) ; Pastre, I.A. (UNESP/IBILCE)
Resumo
No presente trabalho modificou-se a estrutura da argila bentonita sódica (Na-B) obtendo-se materiais híbridos TiO2-Bentonita (Ti-B) e Al2O3/Fe2O3- Bentonita (Al/Fe-B). Caracterizou-se e aplicou-se os materiais em ensaios de cinética de adsorção, frente ao herbicida paraquate em meio aquoso. Observou-se que a capacidade de troca de cátions (CTC) das argilas, que diminui em função do método de modificação, foi dependente do tamanho médio de partícula do material. Verificou-se que a CTC foi a característica que mais influenciou na capacidade adsortiva dos materiais. Ambas, CTC e capacidade adsortiva, seguiram a ordem: Na-B > Ti-B > Al/Fe-B. As argilas apresentaram cinética de adsorção rápida com o equilíbrio se estabelecendo em 30 minutos para Na-B e Ti-B e em 45 minutos para a argila Al/Fe-B.
Palavras chaves
Paraquate; Bentonita; Adsorção
Introdução
O paraquate (Dicloreto de 1,1-dimetil-4,4-bipiridinio) é um herbicida de ação foliar, persistente na natureza, extremamente tóxico, e que está entre os agrotóxicos mais utilizados no mundo (HAN et al., 2010; MARTINS, 2013). Os tratamentos convencionais de água e efluentes não são eficientes na remoção de substâncias persistentes e o herbicida torna-se passível de atingir a população pela contaminação da água de abastecimento (DE LEÓN et al., 2008; DHAOUADI; ADHOUM, 2010) pois frequentemente é encontrado em ambientes aquáticos (FERNÁNDEZ; IBÁÑEZ; PICÓ, 1998; AMONDHAM et al., 2006; BRITTO et al., 2012). Tratamentos terciários, como adsorção em fase líquida e fotocatálise heterogênea, mostram-se como métodos alternativos aos tratamentos convencionais de efluentes líquidos (WONG et al., 2004; WANG; HUNG; SHAMMAS, 2006). Um dos desafios nesta área está no desenvolvimento de matrizes sólidas viáveis e eficientes para serem utilizadas nesses processos (ESPLUGAS et al., 2002; WANG et al., 2013). Materiais como a argila bentonita, recebem atenção por serem abundantes e de baixo custo. Ademais, propriedades físico-químicas como expansibilidade em água, área de superfície especifica elevada, capacidade adsortiva e de troca de cátions, fazem da argila um excelente adsorvente e possibilitam a modificação estrutural do material. De acordo com o método de modificação obtêm-se materiais funcionalizados com propriedades fotocatalíticas (MURRAY, 2007; GALEANO; GIL; VICENTE, 2010; YANG et al., 2013). Neste contexto, o trabalho objetivou a síntese de materiais híbridos TiO2-Bentonita e Al2O3/Fe2O3- Bentonita, a partir da argila bentonita sódica, para serem utilizados na remoção do paraquate de sistemas aquosos. Como etapa inicial da investigação realizou-se ensaios de cinética de adsorção.
Material e métodos
Os materiais foram preparados como descrito a seguir: A) Na-B: a argila bentonita (Sigma-Aldrich) foi tratada com NaCl em meio aquoso, fracionada por centrifugação, a fração mais leve foi dialisada, seca em estufa a 80°C e calcinada em mufla a 450°C por 2 horas; B) Ti-B: preparou-se um gel de TiO2 como descrito por Cervantes, Zaia e Santana (2009), com modificações. Sob agitação magnética, o gel foi adicionado a uma suspensão aquosa 2% m/v de bentonita sódica não calcinada (TiO2/Argila = 1:20). O material foi liofilizado e calcinado nas mesmas condições que a Na-B; C) Al/Fe-B: preparou-se uma solução de polihidroxicátions mistos de Al3+ e Fe3+, com porcentagem de [Fe3+]/[Al3++Fe3+] = 3%, como descrito por Galeano, Gil e Vicente (2010), com modificações. A solução foi adicionada a uma suspensão aquosa 2% m/v de bentonita sódica não calcinada (20,0 meq g-1). O material foi lavado, liofilizado e calcinado nas mesmas condições que a Na-B. Dentre outras técnicas, as argilas foram caracterizadas por difratometria de raios- X, determinação da área de superfície por BET, determinação da CTC por Kjeldhal e determinação do tamanho médio de partícula por espalhamento de luz. Os ensaios de cinética de adsorção foram realizados em triplicata a 25±1 °C. Amostras, com concentração 0,1 g L-1 de argila e 14,97 mg L-1 de paraquate, foram mantidas sob agitação magnética, retiradas em função do tempo (t: 2,5 a 120 minutos) e centrifugadas. Analisou-se os sobrenadantes em espectrofotômetro UV-Vis, calculou-se a quantidade de herbicida adsorvido nos tempos t (Qt: mg g-1) e, aos resultados experimentais, aplicou-se as equações de cinética de pseudo-primeira ordem e pseudo-segunda ordem. Calculou-se também a porcentagem adsorvida no equilíbrio (%Ads) (HO; MCKAY, 1998, 1999; SARI et al., 2007).
Resultado e discussão
Os resultados de caracterização dos materiais (Tabela 1) mostraram que os
métodos de modificação não alteraram significativamente o espaçamento
interlamelar (d001) das argilas e embora a modificação com TiO2 não tenha
alterado significativamente a área de superfície específica (SBET) da
argila, a modificação com polihidroxications de Al/Fe diminuiu
consideravelmente essa propriedade. Além disso, as modificações aumentaram o
tamanho médio de partícula e diminuiram a CTC do material e nota-se que
essas grandezas são inversamente proporcionais. Por meio das curvas de
cinética de adsorção do paraquate (Figura 1a) foi possível inferir que a
cinética do processo é rápida, com o equilíbrio se estabelecendo em 30
minutos para Na–B e Ti–B, e em 45 minutos para Al/Fe–B. Ao aplicar as
equações de cinética aos resultados experimentais, somente a de pseudo-
segunda ordem [t/Qt = 1/k2.(Qeq)2 + 1/Qeq.t], atingiu valores de correlação
aceitáveis (R2 > 0,90; curvas na Figura 1b). Essa equação fornece parâmetros
cinéticos (Tabela 1) como a constante de velocidade de pseudo-segunda ordem
(k2: g mg-1 min-1) e a quantidade de herbicida adsorvido no equilíbrio (Qeq:
mg g-1). A correlação com essa equação sugere que a Qeq é proporcional aos
sítios ativos do material e que a adsorção envolve interações coulombianas
entre o dicátion paraquate e os grupos da argila carregados negativamente
(Si–O- e Al–O-) (HO; MCKAY, 1998, 1999; SARI et al., 2007). Mediante análise
comparativa dos resultados, observa-se que a k2 aumentou para a argila Ti-B
e diminuiu para a argila Al/Fe-B em relação à Na-B, que os valores de Qeq
são consistentes com os obtidos experimentalmente e que a capacidade
adsortiva da argila frente ao paraquate foi dependente de sua CTC, onde
ambas seguiram a ordem Na-B > Ti-B > Al/Fe-B.
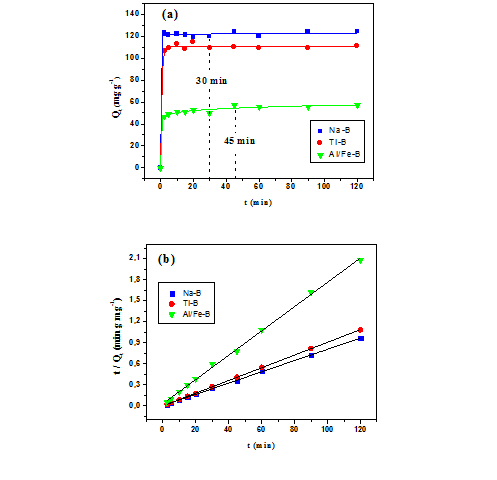
Curvas de: (a) cinética de adsorção e (b) cinética de pseudo-segunda ordem para a adsorção do herbicida paraquate nas argilas estudadas; T = 25±1 °C.
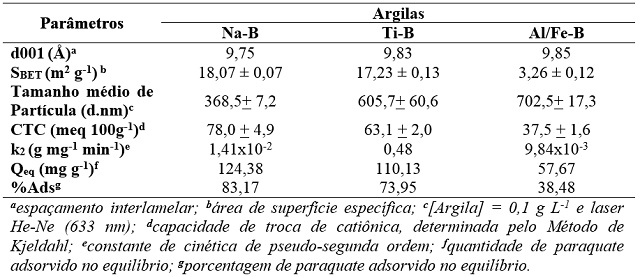
Parâmetros obtidos por meio da caracterização estrutural das argilas e por meio dos estudos de cinética de adsorção do herbicida paraquate.
Conclusões
Os métodos de modificação alteraram significativamente apenas o tamanho médio de partícula e a CTC da argila bentonita. Além disso, essas propriedades mostraram-se inversamente proporcionais. A cinética de adsorção foi rápida em todos os materiais e a quantidade de paraquate adsorvido foi dependente da CTC do material. Contudo, a modificação com TiO2 aumentou a constante de cinética de pseudo-segunda ordem, referente a adsorção do paraquate pela argila Ti-B.
Agradecimentos
Agradecemos ao IBILCE/Unesp, ao Prof. Dr. José Geraldo Nery e à Profa. Dra. Marcia Perez dos Santos Cabrera, da mesma instituição, por disponibilizar seus equipamento
Referências
AMONDHAM, W.; PARKPIAN, P.; POLPRASERT, C.; DELAUNE, R. D.; JUGSUJINDA, A. Paraquat adsorption, degradation, and remobilization in tropical soils of Thailand. Journal of environmental science and health. Part. B, Pesticides, food contaminants, and agricultural wastes, v. 41, n. 5, p. 485–507, 2006.
BRITTO, F. B.; VASCO, A. N.; PEREIRA, A. P. S.; MÉLLO JÚNIOR, A. V.; NOGUEIRA, L. C. Herbicidas no alto Rio Poxim, Sergipe e os riscos de contaminação dos recursos hídricos. Revista Ciência Agronômica, v. 43, n. 2, p. 390–398, 2012.
CERVANTES, T. N. M.; ZAIA, D. A. M.; SANTANA, H. de. Estudo da fotocatálise heterogênea sobre Ti/TiO2 na descoloração de corantes sintéticos. Química Nova, v. 32, n. 9, p. 2423–2428, 2009.
DE LEÓN, M. a.; CASTIGLIONI, J.; BUSSI, J.; SERGIO, M. Catalytic activity of an iron-pillared montmorillonitic clay mineral in heterogeneous photo-Fenton process. Catalysis Today, v. 133-135, p. 600–605, abr. 2008.
DHAOUADI, A.; ADHOUM, N. Heterogeneous catalytic wet peroxide oxidation of paraquat in the presence of modified activated carbon. Applied Catalysis B: Environmental, v. 97, n. 1-2, p. 227–235, 9 jun. 2010.
ESPLUGAS, S.; GIMÉNEZ, J.; CONTRERAS, S.; PASCUAL, E.; RODRÍGUEZ, M. Comparison of different advanced oxidation processes for phenol degradation. Water Research, v. 36, n. 4, p. 1034–1042, 2002.
FERNÁNDEZ, M.; IBÁÑEZ, M.; PICÓ, Y.; MAÑES, J. Spatial and Temporal Trends of Paraquat, Diquat, and Difenzoquat Contamination in Water from Marsh Areas of the Valencian Community (Spain). Archives of Environmental Contamination and Toxicology, v. 35, n. 3, p. 377–384, 1998.
GALEANO, L. A.; GIL, A.; VICENTE, M. A. Effect of the atomic active metal ratio in Al/Fe-, Al/Cu- and Al/(Fe–Cu)-intercalating solutions on the physicochemical properties and catalytic activity of pillared clays in the CWPO of methyl orange. Applied Catalysis B: Environmental, v. 100, n. 1-2, p. 271–281, 2010.
HAN, Y-S.; LEE, S-Y.; YANG, J-H.; SOO HWANG, H.; PARK, I. Paraquat release control using intercalated montmorillonite compounds. Journal of Physics and Chemistry of Solids, v. 71, n. 4, p. 460–463, 2010.
HO, Y. .; MCKAY, G. Pseudo-second order model for sorption processes. Process Biochemistry, v. 34, n. 5, p. 451–465, 1999.
HO, Y.; MCKAY, G. Sorption of dye from aqueous solution by peat. Chemical Engineering Journal, v. 70, n. 2, p. 115–124, 1998.
MARTINS, T. Herbicida Paraquat: conceitos, modo de ação e doenças relacionadas. Semina: Ciências Biológicas e da Saúde, v. 34, n. 2, p. 175–186, 2013.
MURRAY, H. H. Applied clay mineralogy occurrences, processing and application of kaolins, bentonites, palygorskite- sepiolite, and common clays. First ed. Amsterdam: Elsevier B.V., 2007.
SARI, A.; TUZEN, M.; CITAK, D.; SOYLAK, M. Equilibrium, kinetic and thermodynamic studies of adsorption of Pb(II) from aqueous solution onto Turkish kaolinite clay. Journal of hazardous materials, v. 149, n. 2, p. 283–91, 2007.
WANG, X.; WU, Z.; WANG, Y.; WANG, W.; WANG, X.; BU, Y.; ZHAO, J. Adsorption-photodegradation of humic acid in water by using ZnO coupled TiO2/bamboo charcoal under visible light irradiation. Journal of hazardous materials, v. 262C, p. 16–24, 2013.
WANG, LAWRENCE K.; HUNG, YOUNG-TSE; SHAMMAS, N. K. (ed.). Advanced physicochemical treatment processes. Totowa, New Jersey: Humana Press Inc., 2007. 697 p.
WONG, Y. C.; SZETO, Y. S.; CHEUNG, W. H.; MCKAY, G. Adsorption of acid dyes on chitosan-equilibrium isotherm analyses. Process Biochemistry, v. 39, n. 6, p. 695–704, 2004.
YANG, S.; LIANG, G.; GU, A.; MAO, H. Synthesis of TiO2 pillared montmorillonite with ordered interlayer mesoporous structure and high photocatalytic activity by an intra-gallery templating method. Materials Research Bulletin, v. 48, n. 10, p. 3948–3954, 2013.


















