ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Gomes, R.A.B. (UNIVERSIDADE FEDERAL DE ALFENAS) ; Magalhães, C.S. (UNIVERSIDADE FEDERAL DE ALFENAS) ; Luccas, P.O. (UNIVERSIDADE FEDERAL DE ALFENAS) ; de Figueiredo, E.C. (UNIVERSIDADE FEDERAL DE ALFENAS)
Resumo
Neste trabalho, propomos o estudo da influência do pH na exclusão de proteínas dos nanotubos de carbono de acesso restrito (em inglês, RACNT), obtidos através da modificação química de nanotubos de carbono (CNT) com o emprego de agente oxidante ácido. Os CNTs oxidados foram revestidos com uma camada de albumina de soro bovino (BSA), resultando em RACNT-BSA. Determinou-se o ponto isoelétrico (pI) do RACNT-BSA e estudou-se a sua interação com a BSA na concentração de 3 μg/mL, em tampão fosfato com pH de 2,2 a 7,0. Com isso, houve uma maior compreensão dos mecanismos de interação entre eles, sendo principalmente regidos por fenômenos eletrostáticos.
Palavras chaves
pH; proteína; nanotubos de carbono
Introdução
A descoberta dos nanotubos de carbono (em inglês, CNTs), impulsionou o desenvolvimento de diversos nanomateriais de carbono favorecendo a aceleração da nanotecnologia (IIJIMA, 1991). As propriedades únicas dos CNTs, tais como elevada resistência mecânica, alta condutividade elétrica e térmica e elevada área superficial, possibilitaram que esses materiais possuíssem um elevado potencial em diversas aplicações, principalmente na área biomédica (TERRONES, 2003). As funcionalizações ou modificações químicas da superfície dos nanomateriais de carbonos são de extrema importância, pois produzem melhoria das suas características. Assim, permitindo maior controle de sua pureza, facilitando a obtenção de materiais adequados à produção de dispositivos de elevada sensibilidade e seletividade, podendo, portanto, interagir com sistemas biológicos, destacando-se na biocompatibilidade com biomoléculas (proteínas) e redução da citotoxidade desses materiais (VIJAYARAJ et al., 2010). As características mais relevantes dos CNTs para aplicações biomédicas são a solubilidade e biocompatibilidade, que podem ser intensificadas por vários métodos de purificação através de tratamento com ácidos, expondo determinados grupos químicos nas superfícies dos nanotubos como, álcoois, lactonas, ácidos carboxílicos, carbonilas, entre outros (PORTER et al., 2009). Neste trabalho, os CNTs oxidados foram revestidos com uma camada de albumina de soro bovino (BSA), resultando em RACNT revestidos com BSA. Foi investigada a influência do pH na interação dos RACNT-BSA com macromoléculas (soluções proteicas de BSA), proporcionando uma maior compreensão do mecanismo de interação entre estes com moléculas biológicas.
Material e métodos
REAGENTES E SOLUÇÕES- Utilizou-se CNTs de paredes múltiplas, com pureza de 95% em massa. HNO3 65% (v/v), H3PO4 e Na2HPO4 anidro P.A foram utilizados para o preparo do tampão, BSA cristalina, glutaraldeído e NaBH4, foram usados para a funcionalização e revestimento dos CNTs. HCl, NaOH, Na2CO3 e biftalato de potássio, no preparo e padronização das soluções empregadas na titulação potenciométrica (todos da Sigma-Aldrich®). METODOLOGIA- Para a funcionalização (JIA et al., 1999), transferiu-se 500 mg de CNT puro para um balão de fundo redondo preenchido com 30 mL de HNO3, sob agitação magnética à 120 ºC por 90 min em refluxo. Eles foram filtrados e lavados com água destilada até pH neutro, secados a 120°C por 12 h e recobertos com BSA, segundo (BARBOSA et al., 2015). Percolou-se, 20 mL de solução de BSA 1% (m/v) em tampão fosfato 50 mmol.L-1 (pH = 5,7) e 5 mL de uma solução aquosa de glutaraldeído 1% (v/v) em um cartucho de SPE contendo 200 mg do CNT. Após 5 h, adicionou-se 10 mL de uma solução aquosa de boro hidreto de sódio de 1% (m/v). Finalmente o RACNT-BSA foi lavado em água. Os pontos isoelétricos (pI) foram determinados por titulação potenciométrica, adicionando (~15 mg) das amostras em 20,0 mL de água deionizada. As soluções de HCl e NaOH (0,01 mol.L-1) foram previamente padronizadas. Os valores de pH foram medidos, utilizando o pHmetro, a cada volume adicionado de titulante. Para avaliar a influência do pH, soluções de BSA (~3 µg/mL) foram preparadas em tampão fosfato (50 mM) no intervalo de pH 2,2 a 7,0. Percolou-se (n = 4) estas soluções em cartuchos de SPE com 150 mg de RACNT-BSA. As concentrações de BSA, antes e depois de cada percolação, foram determinadas empregando-se o método de Bradford (MARION, 1976), utilizando-se um espectrofotômetro UV-Vis (595 nm).
Resultado e discussão
De acordo com resultados obtidos, o pH influenciou significativamente nas
interações
entre a BSA solubilizada nos tampões e o RACNT-BSA (figura 1). Nos
intervalos de
valores de pH entre 2,2 e 3,0 e entre 5,6 e 7,0, obtiveram-se altas
porcentagens de
recuperação da BSA (acima de 85%). Assim, sugere-se que, para estes
intervalos de
pH, houve repulsão eletrostática entre a superfície dos RACNT-BSA e as
moléculas de
BSA em solução. Este fato pode ser explicado devido as cargas de ambos serem
iguais.
Entretanto, para o intervalo de valores de pH entre 3,5 e 5,2, observou-se
uma
mudança no comportamento, com uma maior interação entre as proteínas e os
RACNT-BSA,
ou seja, uma recuperação de proteínas dos percolados de 20 a 45%. Este
intervalo de
valores de pH compreende o valor de pI da BSA (4,8 a 5,2), descrito na
literatura
(PETERS JR, 1995). Dessa forma, ao aproximar-se do valor próximo ao pI da
BSA,
ocorreria um aumento da atração eletrostática entre a superfície dos RACNT-
BSA e a
BSA em solução. Os pI´s do RACNT-BSA (4,90) e da BSA pura (5,05), foram
determinados
(figura 2a). Assim, pôde-se propor os seguintes mecanismos: Na região A, há
um
excesso de íons hidroxilas (OH-) em solução e a superfície do CNT está
carregada
positivamente, pois há diferença de dipolo ocorrendo atração eletrostática.
Na
região B, há um equilíbrio entre as cargas em solução, porém na superfície
do
material há excesso de carga negativa. Em C, destaca-se a região tampão,
demonstrando o equilíbrio entre as cargas. Em D, todos os íons OH- na
superfície do
material e solução foram neutralizados com íons H+, assim o pI da amostra e
da
solução são iguais, determinando o pI do RACNT-BSA. Finalizando, em E há
repulsão
eletrostática entre cargas positivas da superfície do RACNT-BSA e da
solução.
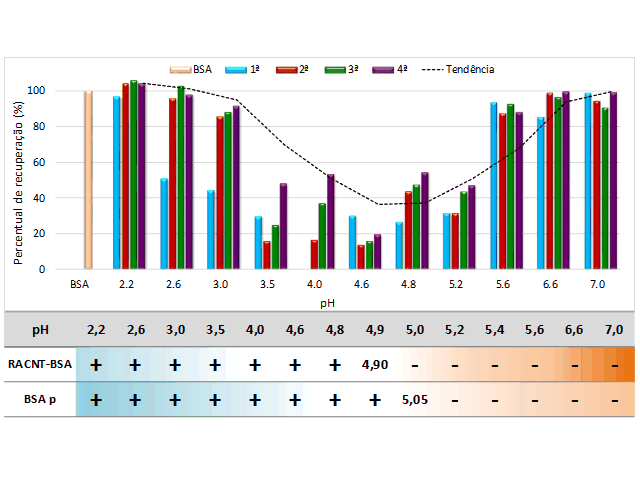
Figura 1. Gráfico representativo do efeito do pH na exclusão de BSA dos RACNT-BSA. A linha pontilhada representa a tendência de recuperação.
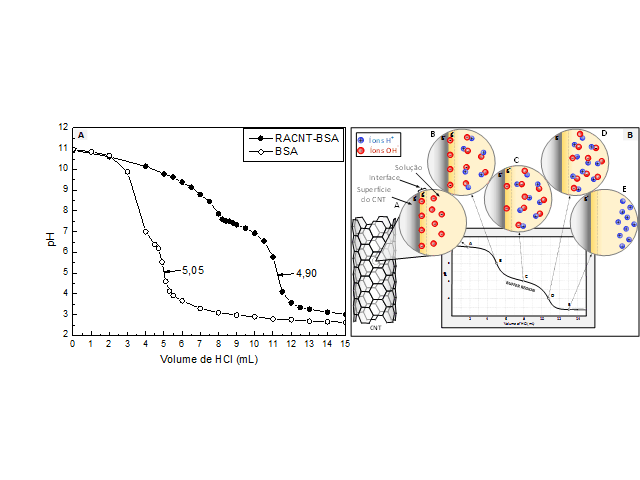
Figura 2. (a) Curvas potenciométricas ácido-base das amostras tituladas com HCl 0,01 mol.L-1, (b) Representação do mecanismo da titulação.
Conclusões
Os resultados obtidos a partir do presente trabalho nos permitem propor um mecanismo de interação eletrostática para o funcionamento dos RACNT-BSA, sendo este mecanismo dependente do pH da solução e das proteínas a serem percoladas. Existe um intervalo bem definido em que as proteínas da solução são atraídas aos nanotubos (pH entre 3,5 e 5,2), o qual compreende os valores de pI de ambos. Já nos outros intervalos de pH estudados (de 2 a 3,5 e de 5,6 a 7) há repulsão eletrostática. Portanto, há uma forte influência do pH na exclusão ou adsorção de proteínas nos RACNT-BSA.
Agradecimentos
CNPq, FAPEMIG e PPGQ/UNIFAL-MG
Referências
BARBOSA, A. F.; BARBOSA, V. M.; BETTINI, J.; LUCCAS, P. O. AND FIGUEIREDO, E. C. Restricted access carbon nanotubes for direct extraction of cadmium from human serum samples followed by atomic absorption spectrometry analysis. Talanta. v.131, p.213-220, 2015.
IIJIMA, S. Helical microtubules of graphitic carbon. nature. v.354, p.56-58, 1991.
JIA, Z.; WANG, Z.; LIANG, J.; WEI, B. AND WU, D. Production of short multi-walled carbon nanotubes. Carbon. v.37, p.903-906, 1999.
PETERS JR, T. All about albumin: biochemistry, genetics, and medical applications, Academic press.(1995)
PORTER, A. E.; GASS, M.; BENDALL, J. S.; MULLER, K.; GOODE, A.; SKEPPER, J. N..;WELLAND, M. Uptake of noncytotoxic acid-treated single-walled carbon nanotubes into the cytoplasm of human macrophage cells. Acs Nano. v.3, p.1485-1492, 2009.
TERRONES, M. Science and technology of the twenty-first century: synthesis, properties, and applications of carbon nanotubes. Annual review of materials research. v.33, p.419-501, 2003.
VIJAYARAJ, M.; GADIOU, R.; ANSELME, K.; GHIMBEU, C.; VIX‐GUTERL, C.; ORIKASA, H..;ITTISANRONNACHAI, S. The influence of surface chemistry and pore size on the adsorption of proteins on nanostructured carbon materials. Advanced Functional Materials. v.20, p.2489-2499, 2010.


















