ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Lages, E.B. (UEG) ; Chellini, P.R. (UFJF)
Resumo
As formulações farmacêuticas contendo combinações de descongestionantes, anti-histamínicos e analgésicos são normalmente utilizadas no tratamento da gripe e resfriado. Inúmeros métodos têm sido descritos para determinação quantitativa desses fármacos, sendo a cromatografia a líquido de alta eficiência (CLAE) a principal técnica de escolha. Um método analítico por CLAE-UV para determinação simultânea de cafeína (CAF), ácido acetilsalicílico (AAS) e cloridrato de fenilefrina (FEN) em comprimidos foi desenvolvido e validado. O método mostrou-se seletivo, linear, preciso, exato e robusto e pode ser aplicado no controle de qualidade de produtos farmacêuticos.
Palavras chaves
cafeína; ácido acetilsalicílico; cloridrato de fenilefrina
Introdução
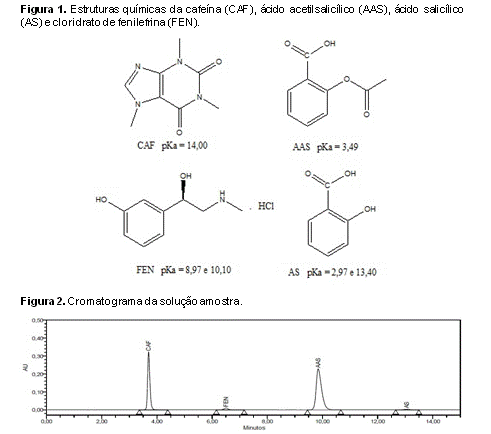
O AAS pertence à classe dos anti-inflamatórios não esteroidais e possui propriedades anti-inflamatórias, analgésicas, antipiréticas e antiplaquetárias. O ácido salicílico (AS) é o produto de hidrólise do AAS e, normalmente, está presente em pequenas quantidades nas formulações contendo AAS (MARRA et al., 2014). A CAF é um alcaloide largamente encontrado em produtos naturais e também utilizado em formulações farmacêuticas, alimentos e bebidas. A CAF possui inúmeros efeitos fisiológicos, tais como a estimulação do sistema nervoso central, a secreção de ácido gástrico e a diurese (REDASANI et al., 2013). Embora não tenha nenhuma atividade analgésica, a CAF é usada em formulações analgésicas devido às suas propriedades adjuvantes, aumentando em cerca de 40% o efeito analgésico do componente principal (MARRA et al., 2014). O FEN é um agente simpatomimético utilizado, principalmente, como midriático, cardiotônico e descongestionante nasal (DEWANI et al., 2015). Essas substâncias são frequentemente associadas em formulações farmacêuticas para combate a gripe e ao resfriado, porém com um grande desequilíbrio entre as dosagens de cada componente ativo. Além disso, esses compostos possuem polaridades diferentes e consequentemente um perfil cromatográfico distinto, o que representa um desafio analítico. A Figura 1 apresenta as estruturas químicas da CAF, AAS, AS e FEN. Pela revisão da literatura, nenhum método por CLAE aplicado a medicamentos contendo a combinação desses fármacos foi encontrado. Assim, este trabalho teve como propósito desenvolver e validar um método analítico por CLAE-UV para determinação simultânea de CAF, AAS e FEN em uma formulação farmacêutica.
Material e métodos
As análises foram executadas em um sistema cromatográfico Waters modelo Alliance, equipado com bomba quaternária, injetor automático e detector de arranjo de fotodiodos. O software Empower 3 foi utilizado para aquisição e análise dos dados. A separação cromatográfica foi realizada em uma coluna analítica Hypersil ODS (250 x 4,6 mm d.i; 5 µm; Thermo) mantida a 25 ºC. Empregou-se eluição isocrática com uma fase móvel constituída por metanol, acetonitrila e tampão contendo ácido cloroacético 10 mM e octanossulfonato de sódio 1 mM na proporção 10:10:80 v/v/v. O pH da fase móvel foi mantido em 2,5, não sendo necessário ajuste. O fluxo foi de 1,8 mL/min e o volume de injeção de 20 µL. Detecção no UV foi realizada em 280 nm para todos os analitos. Foram preparadas soluções padrão estoque de CAF, AAS e FEN isoladamente, as quais foram diluídas e combinadas a fim de se obter 60 µg/mL de CAF, 800 µg/mL de AAS e 20 µg/mL de FEN. As amostras foram preparadas na mesma concentração dos padrões a partir do pool de 20 comprimidos pulverizados. Empregou-se como diluente água pH 2,8 ajustado com ácido acético glacial, exceto para o padrão de AAS que foi previamente solubilizado em 10 mL de metanol. O método foi validado de acordo com as diretrizes da Conferência Internacional de Harmonização e a legislação brasileira vigente Resolução RE Nº 899/2003, sendo avaliados os parâmetros de adequabilidade, seletividade, intervalo, linearidade, precisão, exatidão e robustez.
Resultado e discussão
Os resultados de adequabilidade do sistema para a solução padrão contendo
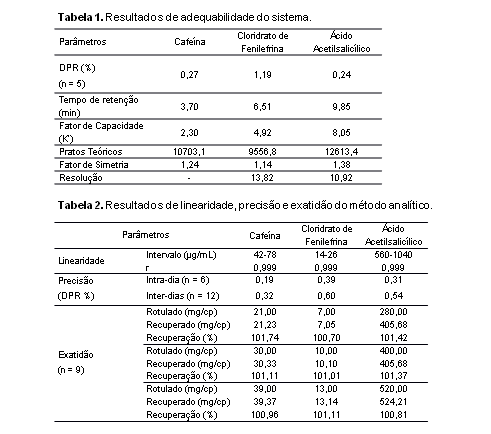
CAF, AAS e FEN estão descritos na Tabela 1. A Figura 2 mostra o cromatograma
obtido para a amostra. O método mostrou seletividade adequada, uma vez que
os espectros dos picos obtidos com a solução amostra foram sobrepostos aos
espectros obtidos com os padrões de referência. Não foram observados
interferentes nos tempos de retenção da CAF, AAS e FEN quando o placebo e as
soluções diluentes foram analisados. A linearidade foi determinada através
das injeções em triplicata de soluções padrões em sete níveis de
concentração. Encontrou-se uma correlação linear entre a área do pico e as
concentrações de cada analito no intervalo estudado. O coeficiente de
correlação (r) obtido foi maior que 0,99 para todos os compostos, o que
atesta a linearidade do método. A precisão foi avaliada pela proximidade dos
resultados de seis preparações da amostra realizadas por analistas
diferentes e em dias diferentes. Os valores de desvio padrão relativo (DPR)
foram consideravelmente inferiores a 5,0%, assegurando a precisão do método.
A exatidão foi verificada pela técnica de adição de padrão, avaliando-se o
grau de recuperação de cada analito em três níveis de concentração: baixa,
média e alta. Todos os analitos apresentaram recuperação próxima de 100,0%,
indicando a exatidão da metodologia. Os resultados da linearidade, precisão
e exatidão são apresentados na Tabela 2. A robustez foi avaliada através da
adequabilidade do sistema e dos teores de amostras submetidas a condições
alteradas propositalmente no método analítico. O método mostrou-se robusto a
todas as alterações propostas: temperatura da coluna; fluxo, pH e proporção
da fase móvel; lote da coluna cromatográfica e marca da membrana filtrante.
Conclusões
O método desenvolvido demonstrou-se seletivo, linear, preciso, exato e robusto. Os três fármacos, além do AS proveniente da degradação do AAS, foram separados com um tempo de corrida adequado de 15 minutos. Embora o AS tenha sido separado, sua quantificação é realizada por outro método, juntamente com outras impurezas. O método mostrou ser simples e confiável, e pode ser empregado nas análises de controle de qualidade de formulações farmacêuticas contendo CAF, AAS e FEN.
Agradecimentos
Referências
DEWANI, A. P.; DABHADE, S. M.; BAKAL, R. L., GADEWAR, C. K.; CHANDEWAR, A. V.; PATRA, S. Development and validation of a novel RP-HPLC method for simultaneous determination of paracetamol, phenylephrine hydrochloride, caffeine, cetirizine and nimesulide in tablet formulation. Arabian Journal of Chemistry. v. 8, n. 4, p. 591-598, 2015. MARRA, M. C.; CUNHA, R. R.; VIDAL, D. T. R.; MUNOZ, R. A. A.; LAGO, C. L.; RICHTER, E. M. Ultra-fast determination of caffeine, dipyrone, and acetylsalicylic acid by capillary electrophoresis with capacitively coupled contactless conductivity detection and identification of degradation products. Journal of Chromatography A. v. 1327, p. 149-154, 2014. REDASANI, V. K.; GORLE, A. P.; BADHAN, R. A.; JAIN, P. S.; SURANA, S. J. Simultaneous determination of chlorpheniramine maleate, phenylephrine hydrochloride, paracetamol and caffeine in pharmaceutical preparation by RP-HPLC. Chemical Industry & Chemical Engineering Quarterly. v. 19, n. 1, p. 57-65, 2013.


















