ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Carneiro Teles, V. (UNIVERSIDADE FEDERAL DO TOCANTINS) ; Passamani Oliveira, A.F. (UNIVERSIDADE DE BRASÍLIA) ; Carneiro Teles, E. (UNIVERSIDADE FEDERAL DO TOCANTINS) ; Pinheiro Soares, I. (EMBRAPA AGROENERGIA) ; Bombarda Campanha, R. (EMBRAPA AGROENERGIA) ; dos Santos Alves Figueiredo Brasil, B. (EMBRAPA AGROENERGIA)
Resumo
O presente estudo foi realizado a fim de caracterizar a biomassa de uma nova espécie de microalga do gênero Micractinium. As microalgas foram cultivadas em meio à base de vinhaça em duas formulações distintas: vinhaça 50% (V50%) e vinhaça clarificada 100% (VC100%) e foi feito cultivo controle com meio BBM. Verificaram-se os seguintes dados de composição química para as amostras LBA-32(V50%) e para LBA-32(VC100%) (Cinzas % - 6,01±0,15; 5.83±0,36; Proteína Bruta % - 39,50±0,47; 39,62±0,09 e Carotenoides totais (µg/g) em base seca - 192,08±0,00; 26,33±0,00) respectivamente. De acordo com os valores obtidos, pode-se ressaltar essa estirpe como uma boa fonte de proteínas e quanto à fração de carotenoides, propõe-se a otimização do processo de produção, caso essa fração seja de interesse.
Palavras chaves
Microalgas; Vinhaça; Coprodutos
Introdução
Nos últimos anos, as questões ambientais atreladas a fatores econômicos têm sido alvo de debates de interesse mundial, ocasionado a busca por novas matrizes de bioprodutos. E nesse cenário, a exploração de biomassa originária de microalgas tem se apresentado como uma alternativa renovável para o suprimento da demanda de compostos químicos de interesse para a indústria de bens de consumo, produtoras dos gêneros alimentícios, farmacológicos, bioquímicos e insumos agrícolas. As algas verdes (Chlorophyta) são microalgas eucariontes encontradas em quase todos os ambientes (RIVIERS, 2010). Em comparação com outras culturas oleaginosas, as microalgas têm uma série de características atraentes que propiciam o seu desenvolvimento, incluindo a alta produtividade por hectare, ciclo de crescimento curto, utilização de terras não cultiváveis e uma ampla variedade de fontes de água (doce, salobra e de águas residuais) (WU et al., 2012). Esses micro-organismos possuem uma notável variabilidade metabólica quanto à fonte de energia e carbono. Podem ser classificados em quatro grupos de acordo com a obtenção de energia e carbono: fotoautotrófico, heterotrófico, mixotrófico e fotoheterotrófico (YANG, 2000); (CHOJNACKA e MARQUEZ-ROCHA, 2004); (SCOPARO, 2010). O cultivo em meio mixotrófico tem sido demonstrado como uma opção versátil, pois utiliza como fonte de energia a luz e compostos orgânicos e como fonte de carbono componentes inorgânicos e orgânicos. Portanto, podem ser utilizados como fonte de nutrientes para o cultivo efluentes agroindustriais, como por exemplo, a vinhaça, proveniente da indústria sucroalcooleira. Tal uso reduz os custos do processo e também contribui para a redução da carga orgânica presente no corpo d’ água, por isso apresenta-se como uma possibilidade economicamente sustentável para a geração em larga escala de químicos de microalgas. A composição química da biomassa de microalgas baseia-se majoritariamente nas frações de pigmentos, carboidratos, proteínas e lipídeos, esse conteúdo sofre alterações de acordo com o gênero, espécie ou estirpe (ANDRADE et al., p.268, 2014). Os carotenoides constituem um grupo de pigmentos naturais que apresentam alto valor agregado. São atualmente utilizados como aditivos alimentares, corantes naturais e também como antioxidantes. A conscientização da enorme aplicabilidade desses compostos provenientes de microalgas tem aumentado (RIBEIRO, et al., 2011). A fração proteica de microalgas pode ser ressaltada como promissora, pois apresenta alta qualidade nutritiva e pode ser comparada com a de outras proteínas alimentares, devido à seu excelente perfil e a boa proporção de aminoácidos (BECKER, 2007). Faz-se necessário estudos para determinação dos teores dos principais compostos presentes em biomassa algal para dessa forma verificar a viabilidade de aplicação biotecnológica e potencial de produção de compostos químicos utilizando como meio de cultivo efluentes provenientes das agroindústrias. O objetivo desse trabalho foi caracterizar a biomassa de microalga cultivada em meio à base de vinhaça em duas formulações distintas.
Material e métodos
Cultivo algal Uma cepa de microalga, LBA32, foi cultivada em fotobiorreator tipo placas planas, com sistema de agitação air lift. A microalga é pertencente ao gênero Micractinium e faz parte da coleção de micro-organismos fotossintetizantes da Embrapa Agroenergia. Utilizou-se como meio de cultura, vinhaça proveniente da usina Jales Machado S. A. (Goianésia-GO). Foram utilizadas duas formulações distintas como meio de cultivo, vinhaça clarificada 100% e vinhaça 50%. No procedimento de clarificação da vinhaça foram utilizados 3 g de cal hidratada/L de vinhaça, essa solução foi mantida em repouso por 40 minutos. Após este período, o material foi centrifugado a 800 g e o pellet descartado. O pH foi ajustado para 8 e o material obtido foi autoclavado por 15 minutos a 1 atm. A concentração utilizada foi de 100% no meio de cultivo. Para o segundo processo, a vinhaça foi centrifugada a 800 g e o pellet descartado. O pH do resíduo foi ajustado para 8 e o material foi autoclavado por 15 minutos a 1 atm. O meio foi então diluído no momento da efetuação da inoculação para 50% em água destilada. Foi realizado cultivo controle com meio Bold’s Basal Medium (NICHOLS,1976). Todos os cultivos foram realizados com aeração (60 L/h) com CO2 a 5% nos fotobiorreatores. As microalgas foram inoculadas em vinhaça e após 72 h de cultivo foram colhidas por centrifugação, lavadas com água destilada e congeladas a -20 °C. Logo após, realizou-se a liofilização da biomassa. Análises Químicas Os procedimentos de caracterização química foram realizados no Laboratório de Química de Biomassa e Biocombustível da unidade da Embrapa Agroenergia em Brasília-DF. Foram executadas as análises dos teores de cinzas, proteínas e carotenoides totais, em triplicata, com a biomassa algal previamente liofilizada e triturada em moinho analítico de bancada. Na análise do teor de cinzas foi usado por volta de 100 mg de amostra e empregou-se metodologia analítica proposta por (WYCHEN & LAURENS, 2013), a incineração foi feita em forno tipo Mufla. Para a determinação de proteína bruta (método Kjeldahl) foi usado como referência o protocolo (AOAC, 1990) e utilizou-se como fator de conversão de nitrogênio N=4,78 proposto para microalgas (LOURENÇO et. al., 2004). O procedimento foi realizado no digestor e destilador de nitrogênio automático. Para tanto, foi pesado em balança analítica cerca de 100 mg de amostra. Para a análise de carotenoides totais empregou-se metodologia proposta por (PORRA et al., 1989) adaptada por (HUANG & CHEUNG, 2011) baseada em espectrofotometria. Foi feita a pesagem de aproximadamente 500 mg de amostra. A partir dos extratos obtidos foram realizadas leituras nos comprimentos de onda de 440,5, 646,6 e 663,6 nm em espectrofotômetro UV/VIS. Análise Estatística Os resultados das análises químicas foram avaliados através do software Assistat Versão 7.7 onde foi feita análise de variância e teste de t Student com intervalo de confiança de 95%.
Resultado e discussão
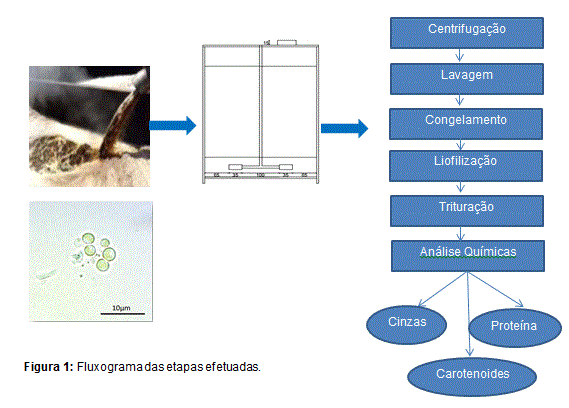
Na figura 1, podem ser visualizadas as etapas executadas.
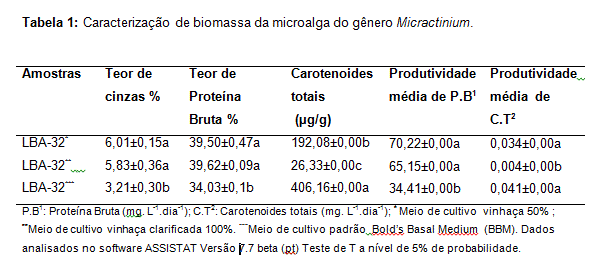
Os resultados comparativos dos teores e condições de cultivo são mostrados
na Tabela 1.
Foi verificado que a cepa LBA-32 com duas formulações de vinhaça para o meio
de cultivo, vinhaça 50% e clarificada 100%, apresentaram respectivamente as
seguintes médias de teores de cinzas: 6,01±0,15; 5,83±0,36 (Tabela 1). Esses
dados de teores de cinzas são semelhantes ao encontrados por (PHUKAN et al.,
2011), que ao trabalhar com culturas similares verificou uma porcentagem de
cinzas de 5,83%.
Para proteína bruta foram observadas as seguintes percentagens médias, para
a amostra com tratamentos do meio de cultura vinhaça 50% centrifugada e
vinhaça 100% clarificada: 39,50±0,47; 39,62±0,09, respectivamente. Singh e
Gu (2010), ao analisar o conteúdo de proteínas de cianobácterias da espécie
Porphyridium cruentum verificaram que estava na faixa de 28 - 45%. Sabe-se
que ampla faixa de variação dentro de uma mesma espécie pode ocorrer devido
a vários fatores dentre eles as condições de cultivo e colheita.
Na análise de carotenoides totais foram observadas as seguintes médias para
o tratamento com vinhaça 50% centrifugada e vinhaça 100% clarificada,
expressas em microgramas por grama (µg/g): 192,08±0,00; 26,33±0,00 de modo
respectivo. Segundo Ahmed, et al. (2014), em estudo com microalga da espécie
Dunaniella tertiolecta foi encontrada uma concentração de 207 µg/g de
luteína, considerada como um dos principais carotenoides presentes em algas.
Quanto a produtividade média de proteína bruta, pode-se ressaltar que a cepa
inoculada em meio vinhaça 50%, apresentou maior ganho se comparada com as
demais formulações de meio de cultura (70,22 mg. L-1.dia-1). Deve-se
salientar que não ocorreram diferenças significativas nas produtividades
diárias de proteínas na cultura exposta a vinhaça durante o crescimento, no
entanto pode-se perceber que o mesmo comportamento não se aplica para o meio
padrão Bold’s Basal Medium (BBM).
Para a fração de carotenoides totais, foi verificado que o maior percentual
foi na microalga cultivada em meio controle (BBM) (406,16 µg/g), Em relação
a produtividade média de carotenoides totais foi verificada que em meio
padrão BBM, houve um rendimento diário superior (0,041 mg. L-1.dia-1). Dessa
forma, pode-se afirmar que houve discrepâncias entre os rendimentos diários
de carotenoides totais no meio padrão se relacionarmos com as outras duas
fórmulas do meio de crescimento em que foi usada a vinhaça.
Conclusões
A pesquisa possibilitou a caraterização da biomassa de microalga do gênero Micractinium cultivadas em vinhaça com dois tratamentos, 50 % centrifugada e 100% clarificada usando fotobiorreatores de placas planas. Os resultados obtidos das análises dos teores de cinzas e proteínas não apresentaram diferenças significativas nas duas formulações de meio de cultivo que utilizaram vinhaça. Entretanto no cultivo controle (BBM), foram observadas diferenças significativas em ambas às análises. Para o conteúdo de carotenoides totais, de acordo o análise estatística empregada, foram notadas diferenças significativas em todos os tratamentos do meio realizados com vinhaça e também com o meio padrão BBM. Pode-se ressaltar que a estirpe usada no estudo apresentou um relevante teor de proteína bruta, podendo ser empregada, por exemplo, na indústria farmacêutica, de suplementos alimentícios, fertilizantes e de ração para animais. De acordo com os dados da análise de carotenoides totais, supõe-se que o baixas concentrações encontradas são devido o curto período de cultivo (3 dias) e à não exposição à condições de estresse, fatores esses que influenciam na produção desses compostos pela microalgas.
Agradecimentos
Pelos recursos financeiros através do projeto da Embrapa (ALGAVIN - SEG: 02.12.11.001.00.00) e a usina Jales Machado S. A. por ceder a vinhaça.
Referências
AHMED, F.; FANNING, K.; NETZEL, M.; Warwick TURNER, W.; Yan LI , Y.; SCHENK, P. M. Profiling of carotenoids and antioxidant capacity of microalgae from subtropical coastal and brackish waters. Food Chemistry, nº 165 300–306, 2014.
ANDRADE, D. S.; FILHO, A. C.; GUEDES, C. L. B.; LIMA, F. A. F. de.; MACHINESKI, G. S.; MATOS, M. A.; SILVA, H. R. Principais produtos da biomassa algal e suas aplicações biotecnológicas. In: ANDRADE, D. S.; A. C. (Ed.). Microalgas de águas continentais – Potencialidades e desafios do cultivo. v. 1. Londrina: IAPAR, 2014.
AOAC – Association of Official Analytical Chemistis. Official methods of analysis. 11 TH ed. Washington D. C.; AOAC., 1990. 1051p.
BECKER, E. W. Micro-algae as a source of protein. Biotechnol Adv., v. 25, 207–210, 2007.
CHOJNACKA , K.; MARQUEZ-ROCHA, F. J. Kinetic and stoichiometric relationships of the energy and carbon metabolism in the culture of microalgae. Biotecnology, v.3, n. 1, p.21-34, 2004.
HUANG,J. J; CHEUNG, P. C. Enhancement of Polyunsaturated Fatty Acids and Total Carotenoid Production in Microalgae by Ultraviolet Band A (UVA, 365 nm)Radiation. J. Agric. Food Chem. nº 59, 4629–4636, 2011.
LOURENÇO S. O.; BARBARINO, E.; LAVÍN, P. L.; LANFER MARQUEZ, U. M.; AIDAR, E. Distribution of intracellular nitrogen in marine microalgae: Calculation of new nitrogen-toprotein conversion factors. Eur J Phycol., v. 39, p.17–32, 2004.
NICHOLS, H. W. Growth media-freshwater. In: STEIN, J. R. (Ed.). Handbook of phycological methods. Cambridge: Cambridge University Press, 1973. p. 7–24.
PHUKAN, M. M.; CHUTIA, R. S.; KONWAR, B. K.; KATAKI, R. Microalgae Chlorella as a potential bio-energy feedstock. Appl Energy, v. 88, p.3307-3312, 2011.
PORRA, R., THOMPSON, W., KRIEDEMANN, P., Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents: verification of the concentration of chlorophyll standards by atomic absorption spectroscopy. Biochim. Biophys.Acta nº 975, 384–394, 1989.
RIBEIRO, B.D.; BARRETO, D.W. and COELHO, M.A.Z. (2011). Technological aspects of β-carotene production. Food and Bioprocess Technology, vol. 4, n. 5, p. 693-701.
RIVIERS, B. D. Natureza e posição das algas na árvore filogenética do mundo vivo. IN:FRANCESCHINI, I. M. (Ed.). Algas: uma abordagem filogenética , taxonômica e ecológica. Porto Alegre: Artmed, 2010. p. 19-57.
SCOPARO, C. H. G. Remoção de CO2 em fotobiorreatores utilizando efluentes petroquímicos. 137 p. 2010. Dissertação (Mestrado em Engenharia Química) – Faculdade de Engenharia Química - Universidade Estadual de Campinas, Campinas, 2010.
SINGH, J.; GU, S. Commercialization potential of microalgae for biofuels production. Renewable and Sustainable Energy Reviews. v. 14, n. 9, p. 2596–2610, 2010.
WU, Y.-H., YU, Y., LI, X., HU, H.-Y., SU, Z.-F., Biomass production of a Scenedesmus sp. under phosphorous-starvation cultivation condition. Bioresour.Technol. nº 112, 193–198, 2012.
WYCHEN, S. V.; LAURENS, L. M. L. Determination of Total Solids and Ash in Algal Biomass. Technical Report NREL/TP-5100-60956, 2013. Disponível em: < http://www.nrel.gov/docs/fy14osti/60956.pdf>. Acesso em: 04 de junho 2015.
YANG, C.; HUA, Q.; SHIMIZU, K. Energetics and carbon metabolism during growth of microalgae cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions. Biochemical Engineering Journal, Amsterdam, v. 6, n. 2, p. 87-102, 2000.


















