ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Pereira, J. (UNIVERSIDADE ESTADUAL DO MARANHÃO) ; Andrade, R. (UNIVERSIDADE ESTADUAL DO MARANHÃO) ; Nascimento, L. (UNIVERSIDADE ESTADUAL DO MARANHÃO) ; Sena, A. (UNIVERSIDADE ESTADUAL DO MARANHÃO) ; Feitosa, A. (UNIVERSIDADE ESTADUAL DO MARANHÃO) ; Guedes, Q. (UNIVERSIDADE ESTADUAL DO MARANHÃO)
Resumo
Este trabalho descreve a preparação de um eletrodo de pasta de carbono (EPC) baseado na caracterização e otimização dos parâmetros analíticos na determinação de hidroquinona (HDQ), as medidas eletroquímica foram obtidas através da técnica de voltametria cíclica (VC). Experimentos como estudo da composição da pasta de carbono, repetibilidade, reprodutibilidade do eletrodo e o estudo do pH, foram realizados para determinar as melhores condições de analise. Os melhores resultados se mostraram em uma concentração de 5x10-4 mol L-1 de HDQ em meio tampão fosfato 0,2 mol l-1 pH 7,0 entre os picos catódico (Epc) e anódico (Epa) nos intervalos de -0,2 a 0,6 E/V vs. ECS.
Palavras chaves
EPC; hidroquinona; voltametria cíclica
Introdução
Os sensores são muitos importantes na eletroquímica principalmente por serem conceituados como dispositivos que convertem uma informação química em um sinal analítico. Na construção do EPC, sua principal vantagem em seu uso se deve ao fato da rapidez e simplicidades do processo de preparação, ligado à facilidade da renovação da superfície do eletrodo a cada nova medida. A voltametria cíclica (VC) é uma técnica aonde se obtêm as informações qualitativas de uma espécie química, no qual registra curvas de corrente- potencial, realizadas em uma cela eletroquímica através de dois eletrodos imersos em uma solução. Os eletrodos mais utilizados nesta técnica são eletrodos de trabalho (ET), eletrodo de referência (ER), Ag/AgCl e eletrodo auxiliar (EA). Na VC os parâmetros de mais importância são o potencial de pico catódico (Epc), o potencial de pico anódico (Epa), a corrente de pico catódica (ipc), e a corrente de pico anódica (ipa). A hidroquinona é conhecida como benzeno-1,4-diol, 1,4-dihidroxibenzeno, ou ainda quinol, é um composto orgânico do tipo fenólico e apresenta a fórmula molecular C6H4(OH)2. A fórmula estrutural da hidroquinona possui dois grupos hidroxila ligada a um anel benzênico [2]. Em temperatura ambiente, apresenta-se na forma de um sólido cristalino de cor branca, inodoro, sabor adocicado e solúvel em água, etanol, éter, clorofórmio e glicerina [2]. A hidroquinona (HDQ) é oxidada a quinona (Q) e à redução da quinona reverte à reação levando a formação novamente de hidroquinona, este processo é caracterizado por envolver dois elétrons [3]. O objetivo deste trabalho é desenvolver um método analítico para determinação de hidroquinona em formulações farmacêuticas, com o intuito de estudar os processos de otimização do EPC através da técnica de voltametria cíclica
Material e métodos
Na construção do eletrodo de Pasta de Carbono (EPC), para determinação de hidroquinona (HDQ), foi utilizado um tubo de seringa, fazendo contato elétrico com um tarugo de cobre com uma pequena cavidade na ponta do tubo para a adição da pasta. A pasta de carbono, para o EPC foi homogeneizada em uma pequena quantidade de pó de grafite e óleo mineral, que atua como agente aglutinante, além de uma placa de platina como eletrodo auxiliar, e um eletrodo de referencia de Calomelano saturado (ECS). O eletrodo construído foi avaliado quanto ao seu desempenho eletroquímico em termos de seletividade, sensibilidade, exatidão, precisão (repetitividade, precisão intermediária e reprodutividade). As medidas eletroquímicas foram realizadas utilizando a técnica de voltametria cíclica e com o auxilio de mini-potenciostato/galvanostato, marca PalmSens, com o modelo PS05225. Este foi acoplado a um computador do tipo Notebook e identificado pelo software Pstrace. Antes de cada medida, a solução eletrolítica foi homogeneizada com um agitador magnético por cerca de um minuto e em seguida o eletrodo foi submetido a 20 ciclos de voltametria cíclica para sua limpeza e para a eliminação de possíveis interferências nas curvas corrente-potencial. Para que em seguida pudessem ser realizados os testes com o analito hidroquinona.
Resultado e discussão
Ao avaliar o comportamento do EPC em diferentes medidas de pó de grafite
(100mg ate 600mg), foi escolhido o eletrodo de 500mg de pó de grafite com 3
gotas de óleo mineral, pois apresentou um processo redox com um pico
catódico (Epc) e potencial de pico anódico (Epa) entre os intervalos de -0,2
a 0,6E/V vs. ECS.
O EPC imerso em solução tampão fosfato pH 7,0 dento de uma cela
eletroquímica, foi observando a ausência de um pico entre potencial de -0,2
a 0,6V vs. ECS. Contudo, após a adição de HDQ 5x10-4molL-1 apresentou a
presença de um processo redox com potenciais de picos anódico e catódico
próximos a -0,2 e 0,2V, na figura 2A.
Para verificar a estabilidade do EPC, foi realizando o estudo de
repetibilidade em 10 medidas consecutivas. O desvio padrão relativo obtido
para o EPC foi de 0,42%. Apresentando assim uma boa repetibilidade com um
baixo desvio padrão relativo nas medidas em HDQ, comprovando uma
estabilidade satisfatória do eletrodo. No estudo da reprodutibilidade do
EPC, foram realizadas 10 medidas de corrente, renovando a superfície do
eletrodo a cada medida. O desvio padrão relativo foi de 1,62%. Apresentando
assim uma boa reprodutibilidade com um baixo desvio padrão relativo, além de
uma estabilidade satisfatória do eletrodo mostrou uma boa sensibilidade.
Na Figura 2B, representar os voltamogramas cíclicos da HDQ sobre o EPC
feitos em diferentes pHs. À proporção que o pH do meio diminui o potencial
de pico de oxidação do HDQ aumenta. O efeito do pH sobre os potenciais de
pico é um estudo que indica o números de elétrons envolvidos na reação de
oxidação. Para os estudos subsequentes foi escolhido o pH 7,0 por se tratar
de um pH neutro, uma vez que serão utilizadas neste trabalho amostras de
interesse ambiental e farmacológico.
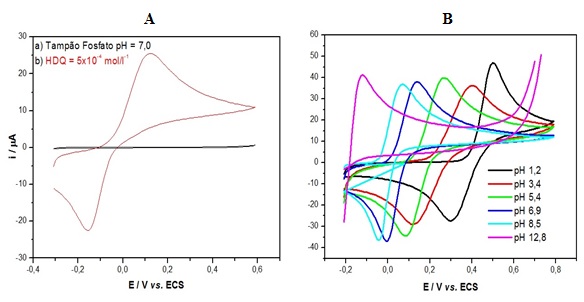
Estudo do comportamento do EPC em solução tampão (A) e Estudo do EPC com diferentes tipos de pH=1,2, pH=3,4, pH=5,4, pH=6,9, pH=8,5, pH=12,5 (B).
Conclusões
Os estudos realizados neste trabalho evidenciaram a viabilidade do emprego do eletrodo de pasta de carbono para determinação voltamétrica da hidroquinona. A utilização destes EPC são promissores, principalmente pela facilidade em modifica-lo sua superfície a cada medida, além de serem de fácil manuseio. O procedimento desenvolvido para determinação de hidroquinona apresentou boa estabilidade, sensibilidade e seletividade. Já que o objetivo para estudos futuros é trabalhar com fármacos com limite detecção em amostra ambiental.
Agradecimentos
Agradeço primeiramente a deus por iluminar através de ideias que venha a minha cabeça o que é certo e errado.Ao meus pais, a instituição ao abrir as portas para me
Referências
REFERÊNCIAS
[1] FRIZON, T. Comportamento Molecular da Hidroquinona em Preparações Farmacêuticas. Goiânia – GO 2010. 36f. Dissertação (mestrado) Profissional em Gestão, Pesquisa e Desenvolvimento em Tecnologia Farmacêutica.
[2] GUEDES, Q. S. Desenvolvimento de eletrodos modificados com poli-1-aminonaftaleno e poli-1,5-diaminonaftaleno e aplicação na determinação de analitos de interesse farmacêutico. Tese de Doutorado - UFSC, São Carlos-SP. 2010.
[3] FRIZON, T. Comportamento molecular da hidroquinona em preparações farmacêuticas. Dissertação de Mestrado- Pontifícia Universidade Católica de Goiás, Goiânia-GO. 2010.
[4] Ueda, J.; Tarvenaro, R.; Marostega, V.; Pavan, W. Impacto ambiental do descarte de farmacos e estudo ca conscientização da população a respeito do problema. Revista Ciências do Ambiente, 5: 1, 2009.
[5] VIEIRA, ANA JÚLIA RÊGO. Aplicação de Processos Oxidativos Avançados em Resíduos contendo hidroquinona. São Carlos, 2006. XXp. Dissertação (mestrado) – Instituto de Química de São Carlos / Universidade de São Paulo.
[6] CRESPILHO, FRANK NELSON; REZENDE, MARIA OLÍMPIA OLIVEIRA. Eletrodos de pasta de carbono modificados com ácidos húmicos: estudo e determinação de metais em meio aquoso. Química Nova, Vol. 27, No. 6, 964-969, 2004.


















