ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Giordani da Costa, S.I. (UTFPR) ; Cechin, J.M. (UTFPR) ; Rodrigues Santana, F. (UTFPR) ; Almeida, N. (UTFPR) ; Rubias, T. (UTFPR) ; Bastian, L.F. (UTFPR) ; Antunes Martin, C. (UTFPR)
Resumo
Este experimento objetivou avaliar o efeito da força iônica e do pH na absorção, no comprimento de onda máximo, do método da orto-fenantrolina para quantificação de ferro por espectrometria UV-VIS, utilizando adição de NaCl em diferentes concentrações para a força iônica e a adição de diferentes soluções, partindo desde um pH ácido até pH básico para avaliação do efeito do pH. Realizou-se uma análise de varredura da absorbância em função dos comprimentos de onda para determinar o comprimento de onda que apresentasse absorbância máxima, a partir deste resultado, foi avaliado se a força iônica e o pH surte algum efeito na absorção da quantificação de ferro. O comprimento de onda máximo obtido foi de 503 nm, para cada força iônica e pH, as absorbâncias registradas foram distintas.
Palavras chaves
orto-fenantrolina; complexação; força iônica
Introdução
O ferro é o metal mais conhecido e utilizado pela humanidade desde os tempos mais longínquos e remotos, sendo também o quarto elemento mais abundante na crosta terrestre, possuindo dois números de oxidação mais comuns, o Fe2+ conhecido antigamente como íon ferroso no estado bivalente e o Fe3+, antes chamado de íon férrico, com estado de oxidação trivalente (SIQUEIRA, 2004). Este elemento está complexado pela água ou por íons hidroxila, na forma de complexos octaédricos FeL6 (desde que não haja outro complexante) dependendo do pH, o qual influencia diretamente o equilíbrio ácido/base dos aquo complexos (FLYNN, 1984). Contido numa solução, o ferro é reduzido a íon ferroso pelo aquecimento com ácido e hidroxilamina e, posteriormente é tratada com fenantrolina a pH entre 3,2 a 3,3. Para cada três moléculas de fenantrolina ocorre a quelação com um íon ferroso resultando em um complexo vermelho – alaranjado (APHA-AWWA, 1998). Estudos sistemáticos têm mostrado que o efeito da adição de eletrólitos sobre os equilíbrios é independente da natureza química do eletrólito, mas que depende de uma propriedade da solução denominada força iônica (SKOOG et al, 2008). A força iônica é uma medida da concentração total de íons em solução. A adição de um sal inerte (Cloreto de Sódio, por exemplo) aumenta a solubilidade de um composto iônico (ATKINS; JONES, 2006; VOGEL, 1992). O método colorimétrico da ortofenantrolina na determinação de ferro pode ser realizado em variadas concentrações, obedecendo assim a Lei de Beer Lambert, onde a intensidade da coloração é diretamente proporcional à concentração do analito (MENDHAM et al, 2002). Deste modo o presente trabalho teve como objetivo avaliar o efeito do pH e da força iônica sobre a quantificação de ferro complexado com orto-fenantrolina.
Material e métodos
Os experimentos foram realizados no laboratório de Análise Instrumental na Universidade Tecnológica Federal do Paraná-Câmpus Toledo. Para quantificação do ferro complexado utilizando o método da 1,10 fenantrolina, preparou-se: 50,00 mL de solução estoque de Fe2+ 0,001 mol.L-1 utilizando cloreto férrico hexahidratado (FeCl3.6H2O) e 80µL de ácido clorídrico concentrado; 10,00 mL de solução de NaOH 4 mol.L-1, 10,00 mL de solução de hidroxilamina 10% (m/m), 25,00 mL de solução de o-fenantrolina 0,3% (m/v) utilizando 2 gotas de ácido clorídrico concentrado e 25,00 mL de acetato de sódio 2 mol.L-1. Os reagentes foram pesados em uma balança analítica (SHIMADZU – AY220). Para encontrar o comprimento de onda máximo do complexo ferroína [Fe(o-phen)3]2+ formado, preparou-se uma solução contendo 400 µL da solução estoque de Fe(III) em um balão de 10,00mL e adicionou-se 100 µL de acetado de sódio e 200 µL de o-fenantrolina, a leitura das absorvâncias foram feitas em um espectrofotômetro (THERMO SCIENTIFIC – GENESIS 10UV) utilizando uma cubeta de vidro com caminho óptico de 1 cm, variando o comprimento de onda de 400 a 560 nm, resultando uma absorbância de 0,463 ± 0,001 para um comprimento de onda máximo de 503 nm. A hidroxilamina reduz o Fe(III) para Fe(II) e este determinado pela adição da ortofenantrolina e a adição de ácidos fortes serem para reprimir a hidrólise do ferro (MATOS, 2012). Para avaliar o comportamento do complexo ferroína em relação a mudança de pH e da força iônica foram preparados 4 balões com a solução do complexo[Fe(o-phen)3]2+ variando o pH e a força iônica do meio. Os resultados foram feitos em triplicatas e estão apresentados na tabela 1 e 2. As leitura do pH foram realizadas em um pHmetro (POLICONTROL – PH250) previamente calibrado.
Resultado e discussão
A tabela 1 apresenta as medidas de absorvância em diferentes valores de pH. A variação de absorvância foi pouco significativa, apresentando maior e menor absorvância em pH ácido, nas faixas de 5,66 ± 0,01 e 0,37 ± 0,01.
Este complexo apresenta uma boa estabilidade na faixa de pH entre 2 e 9. Porém, recomenda-se que o complexo seja formado em meio ácido, evitando assim a precipitação de hidróxido de ferro. O pH da reação é importante uma vez que, em valores de pH muito baixos, a espécie desprotonada da o-fenantrolina pode não estar presente na concentração necessária para a formação quantitativa do complexo com o Fe (II) (COLTRO et al, 2014)
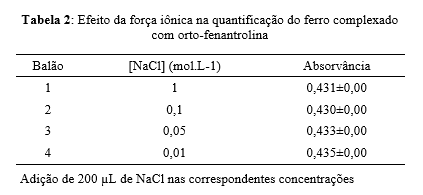
A tabela 2 apresenta os resultados obtidos na avaliação do efeito da força iônica na quantificação do ferro complexado. Os valores de força iônica variaram de 1 a 0,01 mol.L -1. A variação de absorvância foi relativamente pequena sob o efeito da força iônica da solução de equilíbrio. Porém, observou-se que mesmo que pequena o aumento da força iônica fez com que a absorvância diminui com a quantidade de NaCl adicionado.
APHA, AWWA, WEF. Standard Methods for the Examination of Water and Wastewater. 20ch Edition. American Public Health Association, Washington, DC, 1998.

Conclusões
Observou-se que as variações espectrofotométricas, resultantes na utilização do método da orto-fentrolina para quantificação de ferro, são insignificantes quando se altera o potencial hidrogeniônico e/ou a força iônica das amostras.
Agradecimentos
Referências
APHA, AWWA, WEF. Standard Methods for the Examination of Water and Wastewater. 20ch Edition. American Public Health Association, Washington, DC, 1998.
ATKINS, Peter; JONES, Loretta. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 3ₐ ed. – Porto Alegre: Bookman, 2006.
COLTRO, Wendell Karlos Tomazelli, et al. Avaliação de dispositivos de captura de imagens digitais para detecção colorimétrica em microzonas impressas. 2014. Disponível em: < http://quimicanova.sbq.org.br/detalhe_artigo.asp?id=217> Acesso em 07 de junho de 2015.
FLYNN, C. M. Hydrolysis of inorganic iron(III) salts. Chemical Reviews, v. 84, n. 1, p. 31-41, 1984.
HOLLER, F. James; SKOOG, Douglas A.; CROUCH, Stanley R. Princípios de Análise Instrumental. 6ª ed. Porto Alegre: Bookman, 2009
MATOS, Renato Camargo. Metodologia Analítica: Espectrofotometria UV/VIS. Universidade Federal de Juiz de Fora, Juiz de Fora - MG, 2012. Disponível em: <http://www.ufjf.br/nupis/> Acesso em 19. Maio de 2015.
MENDHAM, J., DENNEY, R. C., BARNES, J. D.,THOMAS, M. J. K.; Vogel, Análise Química Quantitativa; 6ª edição. LTC editora. Rio de Janeiro, 2002
SIQUEIRA, L. F. S.; NETO, J. J. G.; ROJAS, M. O. A. Determinação de ferro (I) em água do mar pelo sistema Fe (I)/ KSCN via espectrometria do UV-Vis: uma alternativa prática e de baixo custo. Eclética Quím. Vol. 20, No. 2, 2004.
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos da Química Analítica. 8ª ed. São Paulo: Cengage Leraning, 2008.


















