ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Kling, D.P. (TPQB) ; Medeiros, J.A. (UFRJ) ; Freita, S.P. (TPQB)
Resumo
Neste trabalho foram desenvolvidos 2 processos de digestão de uma microalga e um método para determinação sequencial por HR-CS-FAAS de metais da microalga Monoraphidium SP. Sendo avaliados: Na, K, Mg, Ca, Cu, Fe e Zn. A validação dos métodos foi realizada pelo estabelecimento de curvas de calibração,ensaios de recuperação e comparação dos resultados entre os dois métodos de digestão. Padrões aquosos foram utilizados para a calibração e o coeficiente de correlação encontrado foram maiores que 0,98. A partir das curvas de calibração os limites de detecção foram calculados para cada elemento variando entre 4,4-30 μg.L-1 para os diversos metais. Obtemos taxa de recuperação de 100±4% para a 1ª metodologia e taxas de recuperação para a 2ª metodologia entre 91 e 119%, exceto para Ca
Palavras chaves
absorção atômica; microalga; analise mineral
Introdução
A crescente demanda mundial de combustíveis fóssil incentivou os debates para implementação de políticas ambientais relacionadas às mudanças climáticas, poluição do ar, destruição do ecossistema e desafios a segurança nacional que está relacionado com a produção de petróleo, reforçando a necessidade de desenvolvimento de combustíveis alternativos com menor impacto ambiental tal como o biodiesel e o bioetanol. A matéria-prima para produção de biodiesel é proveniente da agroindústria de óleos de vegetais, fator este que impede um grande aumento na sua oferta, pois ocorre uma competição entre os setores agroindustrial e de energia. Com isso, a produção de biodiesel por esta rota não será capaz de substituir uma fração significativa de combustíveis fósseis. Neste cenário a microalga vem recebendo cada vez mais atenção para produção de biocombustíveis. As estimativas de sua produtividade, em cerca de 10 vezes maior do que o de culturas convencionais, contribui para torná-las a fonte mais promissora para a produção de biomassa. A produção de biodiesel utilizando microalgas depende principalmente da capacidade de produção de lipídeos, o qual é afetado por diversos fatores ambientais como luminosidade, temperatura, salinidade, concentração de CO2 e em especial pelos nutrientes. Os nutrientes utilizados no cultivo das microalgas são os principais fatores que interferem no desenvolvimento do cultivo. Por serem os reguladores dos metabolismos, a ausência ou o excesso de algum nutriente altera de maneira significativa os resultados obtidos. O perfil e a concentração mineral na microalga fresca define o perfil e concentração destes micronutrientes na torta ou no farelo resultante da extração do óleo. A determinação da concentração mineral pode ser usada como uma ferramenta de diagnóstico do processo de cultivo e na identificação da existência de alguma contaminação por metais tóxicos os quais podem interferir no desenvolvimento da microalga. A obtenção desses dados pode, consequentemente, auxiliar na redução de custos de produção tornando a produção de biodiesel mais viável economicamente. Por estes fatores acima citados, o desenvolvimento de novas metodologias de pré tratamento e análise da concentração mineral devem ser avaliadas e implementadas.
Material e métodos
Preparação de soluções Na preparação das soluções feitas partindo do elemento em forma metálica foram feitos em meio de HCl 1 mol/L e os demais em HCl 0,5 mol/L. Padrão feito a partir de suas formas metálicas: Zn, Cu, Fe, Ni. Padrão feito a partir do sal de carbonato anidro: Na, K, Ca. Padrão feito a partir de ampola (MECK): Mg Outras soluções: NH4Cl 1,5 M e HNO3 10%(ultra puro) Condições espectrométricas As determinações foram realizadas em chama de acetileno-ar, utilizando queimador de 50 mm com ângulo de 0º em relação ao feixe de luz. Foram utilizados os comprimentos de onda de maior sensibilidade para Ca, Fe, Zn e Mn, para Na e K utilizou-se os λ 50% de intensidade relativa(Ir) e para Mg o λ de 4,3% de Ir. Com relação a utilização dos pixels do detector, todos os metais foram medidos com 3 pixels com exceção do Mg que utilizou apenas o pixel central. Para cada determinação realizou-se 6 medidas de absorbância com o tempo de integração de 3s e com uma taxa de aspiração da solução de aproximadamente 6 ml/min. Digestão da amostra Metodologia AOAC 90 adaptada 1º- pesa-se 100,0 e 300,0 mg em um Becker; 2º- Adiciona-se 1 ml HNO3 e 0,5 ml HClO4, coloca-se o condensador de refluxo no Becker e deixe em repouso por 4hrs; 3º- Após o repouso, leva-se ao aquecimento de 80ºC, deixando pernoitar nesta temperatura; 4º- Na manhã seguinte, retira-se da chapa de aquecimento. Após esfriar, adiciona-se gota a gota 0,1ml de H2O2, retorna-se com o Becker para a chapa de aquecimento a 100ºC; 5º- Repita o 4º item de tempo em tempo até não ser mais observado o desprendimento do gás NOx e/ou toda solução e a microalga estiverem incolor; 6º-Rinsa-se o condensador de refluxo no Becker; 7º-Na chapa de aquecimento deixa-se a solução evaporar a 120ºC; 8º após a eliminação da solução, eleva-se a temperatura para 200ºC e elimine excesso de ácido; 9º- Transfere-se a solução para um balão volumétrico, adicionando 10% do volume do balão da solução de 10% HNO3up e avolume. Metodologia alternativa 1º- pesa-se entre 100,0 e 300,0mg no tubo; 2º- Adiciona-se 3mL H2O2; 3º- após 3-5 minutos adiciona-se 2 mL HNO3 e em seguida fecha-se o tubo; 4º- leva-se ao aquecimento de 100ºC em banho Maria, deixando reagir por 2-3 horas até mudança de coloração da microalga; 5º- Retira-se do aquecimento e realiza-se a lavagem do tubo antes da etapa 6; 6º- Transfere-se a solução para um balão volumétrico, adicionando 10% do volume do balão da solução de 10% HNO3up e avolume.
Resultado e discussão
Todo o desenvolvimento discutido a seguir foram realizados simultaneamente.
Sendo assim a determinação das concentrações de cada analito não foi
possível até o completo desenvolvimento da metodologia de pré-tratamento e
de análise
Metodologia adaptada
Com o objetivo de verificar a reprodutibilidade desta metodologia, realizou
dois ensaios de digestão independentes, sendo na 1ª sequencia digerida 5
amostras e na 2ª a digestão de 6 amostras. Após a realização do
procedimento, realizou a determinação de Na, K, Ca, Mg, Fe, Zn, Cu e Mn e em
seguida o teste t de student, os resultados encontram-se na Tabela 1 abaixo
Tabela 1 Teste de Reprotutibilidade da metodologia adaptada
Analito Ensaio 11 Ensaio 22 valor p
Na 9,54 9,17 0,09
K 6,94 6,26 0,09
Ca 1,01 1,00 0,08
Mg 28,18 28,92 0,20
Fe 0,195 0,188 0,01
Zn 0,134 0,139 0,07
Cu 0,016 0,016 0,60
Mn 0,028 0,031 0,22
1media do resultado da analise de 5 amostras em ABS/g
2media do resultado da analise de 6 amostras em ABS/g
A verificação da reprodutibilidade da metodologia deu-se pela comparação do
valor-p com o valor de α pré estabelecido (α=0,05). Após a analise do
valor-p obtido para os metais determinados podemos inferir que não existe
diferença significativa entre os dois ensaios, sendo exceção o Fe.
Erros Sistemáticos
Com o objetivo de averiguar a existência de alguma fonte de erro sistemático
que não foi contemplada anteriormente, realizamos o teste de recuperação de
um analito com concentração vestigial, sendo escolhido o Cd devido sua
concentração estar próximo do LOD da técnica (8μg/L) e assim não gerando
interferência significativa nos resultados.
A realização do teste deu-se pela adição de uma solução padrão que resultou
em 1 ppm de concentração final. As análises foram realizadas na linha mais
sensível do cadmio (228nm), com 6 leituras de 3s por amostra. O resultado
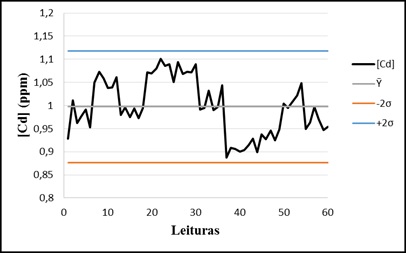
das 60 leituras é representado na figura em anexo.
Como podemos constatar pela figura 1 em anexo, os resultados permaneceram
dentro do limite de 2σ, dado este que indica um baixo nível de erro
aleatório e alta precisão da técnica de abertura e do equipamento. Pela
análise do intervalo de confiança obteve-se um valor de concentração de
1,00 ± 0,04 ppm de cadmio podendo inferir que os resultados representam uma
recuperação de 100% de cadmio, demostrando assim a ausência de erros
sistemáticos na execução da metodologia.
Metodologia alternativa
Após realização das mudanças necessárias para realização da digestão em vaso
fechado, analisou-se os metais Na, K, Mg, Fe e Zn para verificar se abertura
foi capaz de extrair os metais de forma reprodutiva, os resultados são
mostrados abaixo.
Na K Mg Fe Zn
Media 0,071 0,045 4,0 0,194 0,120
Desvio padrão 0,005 0,004 0,6 0,007 0,003
RSD(%) 7,2 8,3 15,7 3,4 2,3
*média de 4 ensaios em ABS/g de amostra
Com a obtenção de um baixo valor de RSD, podemos concluir que a metodologia
é reprodutiva e precisa. Para determinarmos se a extração realizada por esta
metodologia ocorre de forma quantitativa, realizamos a digestão de 12, sendo
separadas em 2 grupos, onde um dos grupos recebeu a adição de 10% do volume
do balão volumétrico de uma solução de 10% HNO3 (Grupo 2) e o outro grupo
não (Grupo 3), estes dois grupos foram comparados com o resultado da analise
de 10 amostras digeridas pela metodologia adaptada (Grupo1).
Analito Grupo 1* Grupo 2* Grupo 3* valor p
Na 4,66 4,90 4,92 0,21
K 4,84a 4,99a,b 4,13a,c 0,01
Mg 4,86a 4,62a 5,45b 0,01
Fe 0,41a 0,40a 0,28b <0,05
Zn 0,12a 0,13a 0,09b 0,003
*média dos resultados das amostras, dados em ABS/g
As médias seguidas de pelo menos uma mesma letra, na linha, não diferem
entre si pelo teste de Tukey, a 5% de probabilidade.
Como o visto na tabela acima, o teste anova identificou diferença
significativa em 4 dos 5 metais analisados, sendo realizado o teste de Tukey
nos resultados desses 4 metais. Os metais analisados por Tukey não
apresentaram diferenças significativas entre os grupos 1 e 2, indicando
assim que a não digestão completa da amostra não apresenta alteração
significativa na determinação dos mesmos. No entanto de 3 dos 4 metais
testados apresentaram diferenças significativas entre os grupos 1 e 3,
indicando que a não adição de HNO3 altera significativamente os resultados
obtidos. De acordo com os resultados obtidos, podemos inferir que as
metodologias adaptada e a alternativa apresentam mesmo nível de exatidão na
obtenção dos resultados.
Teste de Recuperação
GGeralmente são aceitos valores de recuperação para analises de metais na
faixa de ±20%, sendo realizado em triplicata e avaliado a recuperação média
de cada analito individualmente. Neste teste utilizamos as equações abaixo
para o cálculo de recuperação.
TR=100 C_analisada/C_esperada
C_esperada=C_analito+C_adicionada
A solução adicionada não possui magnésio devido a dificuldades técnica da
construção de uma solução multi elementar a qual contemple a concentração
necessária para a construção da curva analítica para metais na mesma faixa
de concentração do magnésio nesta amostra, concentração superior a 1000 ppm.
Analito Rec. Média (%)
Na 112,1
K 104,7
Ca 250,3
Fe 99,6
Zn 119,8
Cu 91,1
A metodologia alternativa apresentou taxas de recuperação satisfatória para
todos os analitos, sendo o Cálcio a exceção, apresentando uma taxa de
recuperação acima dos 200%. Valor este que pode ter sido causado devido a
não digestão completa da microalga e como o cálcio apresenta função
estrutural na microalga, encontrando-se mais fortemente ligado , não sendo
extraído para solução. Devido à taxa de recuperação fora da faixa aceitável,
o cálcio não pode ter sua concentração determinada de forma quantitativa,
sendo assim excluído da metodologia alternativa.
Analise do teor mineral da microalga
Após ter finalizado todo o desenvolvimento das metodologias de pré
tratamento da amostra e da metodologia de análise, preparamos as soluções
padrões que contivessem a concentração da microalga e realizamos a
determinação dos metais utilizando os dois procedimentos de digestão. Os
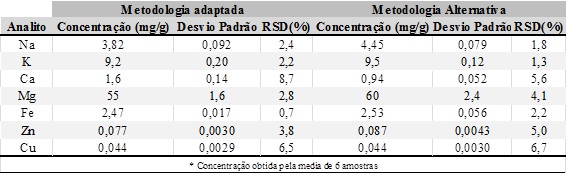
resultados obtidos são mostrados na figura 2 em anexo
Metodologia adaptada Metodologia Alternativa
Analito Concentração (mg/g) Desvio Padrão RSD(%) Concentração (mg/g)
Desvio Padrão RSD(%)
Na 3,82 0,092 2,4 4,45 0,079 1,8
K 9,2 0,20 2,2 9,5 0,12 1,3
Ca 1,6 0,14 8,7
Mg 55 1,6 2,8 60 2,4 4,1
Fe 2,47 0,017 0,7 2,53 0,056 2,2
Zn 0,077 0,0030 3,8 0,087 0,0043 5,0
Cu 0,044 0,0029 6,5 0,044 0,0030 6,7
* Concentração obtida pela media de 6 amostras
Foi possível a determinação da concentração de todos os metais objetivados,
com exceção do manganês devido a concentração ser inferior ao limite de
detecção da curva analítica construída, sendo alcançado um bom nível de
precisão para todos os metais determinados.
Os limites de detecção obtidos para cada elemento foram: 5,5 μg/L para Na,
85 μg/L para K, 3,5 μg/L para Ca, 15 μg/L para Fe, 8 μg/L para Zn, 14 μg/L
para Cu e 30 μg/L para Mn
Teste de recuperação de Cádmio
Resultado da determinação da concentração mineral na microalga Monoraphidium sp utilizando as metodologias desenvolvidas
Conclusões
Os métodos desenvolvidos para determinação dos analitos Na, K, Mg, Ca, Cu, Fe, Zn e Mn em uma amostra de microalga da espécie Monoraphidium sp. utilizando a técnica de HR-CS-FAAS mostrou-se precisa e mais rápida que a metodologia descrita na literatura. Foram determinado a concentração dos analitos propostos, sendo obtido as concentrações: 2,3±0,2 e 3,0±0,2 mg/L para Na; 6,3 ±0,4 e 6,2±0,6 mg/L para K; 2,50±0,08 mg/L para Ca; 59±2 mg/L e 67±5 para Mg; 2,03±0,09 e 2,0±0,1 mg/L para Fe; 0,06±0,001 e 0,8±0,02 mg/L para Zn; Cu 0,047 ± 0,005 e 0,046±0,005mg/L para Cu, para a metodologia adaptada e metodologia alternativa respectivamente. Em ambas metodologias, a concentração de Mn ficou abaixo do limite de detecção e o Ca não pode ser determinado pela metodologia adaptada
Agradecimentos
Os autores agradecem ao CNPq pelo apoio financeiro.
Referências
1. Levine, R. B., Costanza-Robinson, M. S. & Spatafora, G. A. Neochloris oleoabundans grown on anaerobically digested dairy manure for concomitant nutrient removal and biodiesel feedstock production. Biomass and Bioenergy 35, 40–49 (2011).
2. Singh, A., Nigam, P. S. & Murphy, J. D. Renewable fuels from algae: an answer to debatable land based fuels. Bioresour. Technol. 102, 10–6 (2011).
3. Chisti, Y. Biodiesel from microalgae beats bioethanol. Trends Biotechnol. 26, 126–31 (2008).
4. Ebdon, L., Evans, E. H., Fisher, A. & Hill, S. J. An Introduction to Analytical Atomic Spectrometry. (John Wiley & Sons, 1998). doi:10.1006/mchj.1999.1751
5. Welz, B., Becker-Ross, H., Florek, S., Heitmann, U. & Vale, M. G. R. High-resolution continuum-source atomic absorption spectrometry - What can we expect? J. Braz. Chem. Soc. 14, 220–229 (2003).
6. Borges, D. L. G., Curtius, A. J., Welz, B. & Heitmann, U. Fundamentos da espectrometria de absorção atômica de alta resolução com fonte contínua. Rev. Anal. 1, 58–67 (2005).
7. Welz, B., Vale, M. G. R., Castilho, I. N. B. & Dessuy, M. B. Continuum Source Atomic Absorption Spectrometry: Past, Present and Future Aspects – A Critical Review. J. Braz. Chem. Soc. 25, 799–821 (2014).
8. Mohadi, R. Determination of heavy metals in natural waters and sediments by high resolution-continuum source flame and graphite furnace atomic absorption spectrometry. (2012).
9. Welz, B. High-resolution continuum source AAS: the better way to perform atomic absorption spectrometry. Anal. Bioanal. Chem. 381, 69–71 (2005).
10. Orientações sobre Validação de Métodos de ensaios químicos. INMETRO 35 (2003).
11. Freitas, S. M. Modelagem da curva de calibração. (2003).
12. Borges, L., Faria, B. M. D. E., Odebrecht, C. & Abreu, P. C. Potencial de absorção de carbono por espécies de microalgas usadas na aquicultura: primeiros passos para o desenvolvimento de um ‘ mecanismo de desenvolvimento limpo ’. Atlântica, Rio Gd. 29, 35–46 (2007).
13. Brennan, L. & Owende, P. Biofuels from microalgae-A review of technologies for production, processing, and extractions of biofuels and co-products. Renew. Sustain. Energy Rev. 14, 557–577 (2010).
14. Rodrigues, D. B., Menezes, C. R., Mercadante, A. Z., Jacob-Lopes, E. & Zepka, L. Q. Bioactive pigments from microalgae Phormidium autumnale. Food Res. Int. (2015). doi:10.1016/j.foodres.2015.04.027
15. Dragone, G., Fernandes, B. D., Abreu, A. P., Vicente, A. a. & Teixeira, J. a. Nutrient limitation as a strategy for increasing starch accumulation in microalgae. Appl. Energy 88, 3331–3335 (2011).
16. Ho, S.-H., Chen, C.-Y. & Chang, J.-S. Effect of light intensity and nitrogen starvation on CO2 fixation and lipid/carbohydrate production of an indigenous microalga Scenedesmus obliquus CNW-N. Bioresour. Technol. 113, 244–52 (2012).
17. Anjos, M., Fernandes, B. D., Vicente, A. a, Teixeira, J. a & Dragone, G. Optimization of CO2 bio-mitigation by Chlorella vulgaris. Bioresour. Technol. 139, 149–54 (2013).
18. O’ Kelley, J. C. (universit. of A. D. MINERAL NUTRITION OF ALGAE. Annu. Rev. Plant. Physiol. 19, 89–112 (1968).
19. Metzler, D. E. Biochemistry The Chemical Reactions Of Living Cells. 1 & 2, (Elsevier academic press, 1996).
20. Myers, J. PHYSIOLOGY OF THE ALGAEl. Annu Rev microbiol 5, 157–180 (1951).
21. Sandmann, G. & Malkin, R. Iron-sulfur centers and activities of the photosynthetic electron transport chain in iron-deficient cultures of the blue-green alga aphanocapsa. Plant Physiol. 73, 724–728 (1983).
22. Doucette, G.J., Harrison, P. J. Aspects of iron and nitrogen nutrition in the red tide dinoflagellate Gynodinium sanguineum: I . Effects of iron depletion and nitrogen source on biochemical composition. Marin 110, 165–173 (1991).
23. Cid, A., Herrero, C., Torres, E. & Abalde, J. Copper toxicity on the marine microalga Phaeodactylum tricornutum: effects on photosynthesis and related parameters. Aquat. Toxicol. 31, 165–174 (1995).
24. Wong, P. K. & Chang, L. Effects of copper, chromium and nickel on growth, photosynthesis and chlorophyll a synthesis of Chlorella pyrenoidosa 251. Environ. Pollut. 72, 127–139 (1991).
25. Llamas, A., Tejada-Jiménez, M., Fernández, E. & Galván, A. Molybdenum metabolism in the alga Chlamydomonas stands at the crossroad of those in Arabidopsis and humans. Metallomics 3, 578–590 (2011).
26. Osman, M. E. H., El-Naggar, A. H., El-Sheekh, M. M. & El-Mazally, E. E. Differential effects of Co2+ and Ni2+ on protein metabolism in Scenedesmus obliquus and Nitzschia perminuta. Environ. Toxicol. Pharmacol. 16, 169–178 (2004).
27. Cheng, P., Wang, J. & Liu, T. Effects of nitrogen source and nitrogen supply model on the growth and hydrocarbon accumulation of immobilized biofilm cultivation of B. braunii. Bioresour. Technol. 166, 527–533 (2014).
28. Li, M. et al. Cobalt and manganese stress in the microalga Pavlova viridis (Prymnesiophyceae): Effects on lipid peroxidation and antioxidant enzymes. J. Environ. Sci. 19, 1330–1335 (2007).
29. Tewari, R. K., Kumar, P., Sharma, P. N. & Bisht, S. S. Modulation of oxidative stress responsive enzymes by excess cobalt. Plant Sci. 162, 381–388 (2002).
30. Stauber, J. L. & Florence, T. M. Mechanism of toxicity of ionic copper and copper complexes to algae. Mar. Biol. 94, 511–519 (1987).
31. Meisch, H. U. & Bielig, H. J. Effect of vanadium on growth, chlorophyll formation and iron metabolism in unicellular green algae. Arch. Microbiol. 105, 77–82 (1975).
32. Costa Pessoa, J., Garribba, E., Santos, M. F. a. & Santos-Silva, T. Vanadium and proteins: Uptake, transport, structure, activity and function. Coord. Chem. Rev. (2015). doi:10.1016/j.ccr.2015.03.016
33. Gojkovic, Ž., Garbayo, I., Ariza, J. L. G., Márová, I. & Vílchez, C. Selenium bioaccumulation and toxicity in cultures of green microalgae. Algal Res. 7, 106–116 (2015).
34. Ibrahim, A. M. & Spacie, A. Toxicity of inorganic selenium to the green alga. Environ. Exp. Bot. 30, (1990).
35. Carrano, C. J., Schellenberg, S., Amin, S. a., Green, D. H. & Küpper, F. C. Boron and marine life: A new look at an enigmatic bioelement. Mar. Biotechnol. 11, 431–440 (2009).
36. Peng, W., Wu, Q., Tu, P. & Zhao, N. Pyrolytic characteristics of microalgae as renewable energy source determined by thermogravimetric analysis. Bioresour. Technol. 80, 1–7 (2001).
37. Official Methods of Analysis. (Association of Official Analytical Chemists, 1990).


















