ISBN 978-85-85905-15-6
Área
Química Analítica
Autores
Bobeda, C.R.R. (IFRJ - CAMPUS NILÓPOLIS) ; Monteiro, S.P.P. (IFRJ - CAMPUS NILÓPOLIS) ; Costa, A.S. (IFRJ - CAMPUS NILÓPOLIS) ; Maia, L.L. (IFRJ - CAMPUS NILÓPOLIS) ; Teixeira, F.T. (IFRJ - CAMPUS NILÓPOLIS) ; Godoy, R.L.O. (EMBRAPA AGROINÚSTRIA DE ALIMENTOS) ; Torquilho, H.S. (IFRJ - CAMPUS NILÓPOLIS)
Resumo
Hidrocarbonetos policíclicos aromáticos (HPAs) podem ser absorvidos por seres humanos através do consumo de alimentos de origem animal e vegetal. HPAs são descritos como contaminantes em vários tipos de alimentos. Assim, o objetivo desse trabalho foi analisar HPAs em amostras de salmão defumado. O preparo das amostras foi realizado utilizando extração por solvente em “soxhlet” e a separação e quantificação dos contaminantes foi realizada por CLAE-UV-FLC. Os limites de detecção e de quantificação variaram de 0,0035 a 0,3523µg/Kg e 0,0107 a 0,9576µg/Kg, respectivamente. Foram encontrados os HPAs benzo(b)fluoranteno, benzo(k)fluoranteno, benzo(a)pireno, dibenzo(a,h)antraceno e benzo(g,h,i)perileno, em concentrações de 0,0420 a 2,5052µg/Kg.
Palavras chaves
HPAs; CLAE; salmão defumado
Introdução
Os Hidrocarbonetos policíclicos aromáticos (HPAs) constituem um grupo de mais de 100 diferentes substâncias químicas formadas por dois ou mais anéis benzênicos condensados. Consequência da combustão incompleta de matéria orgânica, os HPAs encontram-se largamente distribuídos em nosso meio ambiente e caracterizam-se pela constituição exclusiva de carbono e hidrogênio, pela sua fluorescência, pelo seu elevado ponto de ebulição e pelo alto grau de solubilidade em solventes orgânicos (STOLYHWO e SIKORSKI, 2005). A contaminação de alimentos é fruto da disseminação de HPAs no meio ambiente (ar atmosférico, solo ou água) ou do processo de processamento e de cozimento. As principais fases de processamento são a secagem e a defumação; as de cozimento são aquelas que empregam altas temperaturas, como as atividades de grelhar, de assar e de fritar. Em zonas afastadas de grandes centros urbanos e industriais, os índices de HPAs comprovados em alimentos não processados são proporcionais à contaminação ambiental (POSTER, 2006). Ao longo dos anos, diversos estudos vêm sendo realizados com o intuito de identificar e avaliar os grupos de alimentos mais relevantes para a ingestão humana de HPAs. Com base em alimentos representativos da dieta de onze regiões do Brasil, em valores médios de consumo per capta de alimentos e em dados analíticos dos índices de HPAs totais e carcinogênicos, pesquisadores estimaram a ingestão diária de HPAs pela população do país. Em primeiro lugar, o grupo de óleos e de gorduras assinalaram os maiores índices de HPAs, seguido do grupo de açúcares e do grupo de vegetais. O grupo de óleos e de gorduras foi evidenciado como fonte de HPAs em dez regiões do Brasil. Belém foi a única cidade do país a apresentar o grupo das carnes como vetor significativo para a ingestão diária de HPAs (CAMARGO e TOLEDO, 2001, 2002). Outros estudos, por sua vez, assinalam a ocorrência de HPAs em diversas categorias de alimentos, como óleos vegetais, margarinas, maionese, produtos defumados, chás, café, leite e produtos lácteos, cereais, frutas, vegetais, carnes, peixes e frutos do mar (FALCO et al., 2003). Inúmeros países manifestaram a necessidade de estabelecimento de limites de HPAs em alimentos. O Comitê Conjunto FAO/OMS, em 1991, reavaliou o benzo(a)pireno e determinou a elaboração de procedimentos a serem adotados pelas empresas e pelos consumidores a fim de reduzir a exposição humana a este tipo de contaminante. Em fevereiro de 2005, em Roma, o mesmo Comitê classificou treze HPAs como genotóxicos e carcinogênicos, a saber: benzo(a)antraceno, benzo(b)fluoranteno, benzo(j)fluoranteno, benzo(k)fluoranteno, benzo(a)pireno, criseno, dibenzo(a,h)antraceno, dibenzo(a,e)pireno, dibenzo(a,h)pireno, dibenzo(a,i)pireno, dibenzo(a,l)pireno, indeno[1,2,3-cd]pireno e 5-metilcriseno (WHO/JECFA, 2005). O processamento do alimento é capaz de influenciar na contaminação do produto, visto que os que evidenciam os maiores índices de HPAs são os gêneros alimentícios que foram submetidos a processos de elevadas temperaturas, como secagem, torrefação e defumação. (CARUSO e ALABURDA, 2008). No vasto grupo de HPAs, o benzo(a)pireno (BaP) constitui o representante mais importante. Devido as suas características físico-químicas e toxicológicas, BaP tem sido um foco de vários tipos de pesquisas em diversas áreas do conhecimento científico a partir de sua descoberta na primeira metade do século XX. Em sistemas aquosos, o BaP se concentra, normalmente, em sedimentos ou permanece ligado à matéria orgânica em suspensão (SOUZA, 2010). Por ser embriotóxico e teratogênico, o BaP é tido como um dos contaminantes carcinogênicos mais potentes e comuns para mamíferos. Como consequência, vem sendo largamente empregado como indicador da existência dos demais HPAs em amostras ambientais, de alimentos e de bebidas. Após a absorção de HPAs por animais, o BaP é biotransformado no fígado por meio de uma classe enzimática conhecida como citocromo P-450 monooxigenases (PANDEY, 2011). Em vista do exposto, o presente trabalho teve como objetivo analisar hidrocarbonetos policíclicos aromáticos (HPAs) em amostras de salmão defumado, vendidos comercialmente em supermercados da Cidade do Rio de Janeiro, utilizando a técnica de cromatografia líquida de alta eficiência com detecção por ultravioleta e fluorescência (CLAE-UV-FLC) para verificar a presença de benzo(a)pireno e outros HPAs considerados prioritários além de quantificar estes contaminantes, comparando os resultados de concentração obtidos com os valores de referência descritos na regulamentação 835/2011 da Comunidade Europeia (CE).
Material e métodos
As amostras de salmão defumado foram adquiridas mensalmente no período de outubro a dezembro de 2014, em redes de supermercados da Cidade do Rio de Janeiro, observando-se o número do lote de fabricação para a sua diferenciação. As amostras de pescado foram liofilizadas na Embrapa Agroindústrias de Alimentos e no Instituto Federal do Rio de Janeiro a -49°C, sob pressão reduzida de 0,632mmHg, em liofilizador Liotop modelo L101. A extração de HPAs foi realizada através de hidrólise alcalina, utilizando extrator “soxhlet”, em aproximadamente 20g de amostra liofilizada, com 200mL de KOH 0,4mol/L em metanol:água (9:1 V/V), por um período de 24h a 65°C. Em seguida, foi realizada a partição desta solução alcalina com três porções de 100mL de hexano. As frações deste extrato foram reunidas lavadas por 3 vezes com 50mL de água ultrapura, em funil de separação. O extrato hexânico obtido foi seco com 3,00g sulfato de sódio anidro e centrifugado. Finalmente, o extrato foi concentrado para um volume de 300µL em evaporador rotatório, à pressão reduzida e temperatura de 40°C e filtrado em membrana de politetrafluoretileno (PTFE). Todos os extratos foram transferidos para tubos eppendorf e guardados em freezer a -18ºC, para posterior análise cromatográfica. A análise cromatográfica dos HPAs nas amostras foi realizada usando sistema de cromatografia líquida de alta eficiência (CLAE) modelo Alliance (Waters Corporation), com injetor automático e detectores de ultravioleta com arranjo de diodos (UV-DAD) e fluorescência (FLC) com comprimento de onda variável, modelos 998 e 475 (Waters Corporation), respectivamente, acoplados em série. O sistema foi composto também por coluna cromatográfica YMC C30, 4,6x250mm, 3,0μm de diâmetro de partícula (YMC Inc.), com temperaturas de 35°C e 20°C para a coluna e para o injetor automático, respectivamente. O volume de injeção utilizado foi de 15μL e a fase móvel utilizada foi composta de acetonitrila e água com programação de fluxo e gradiente linear. A detecção cromatográfica por UV-DAD foi realizada em 254,0nm. A detecção por FLC foi realizado usando-se programação para os comprimentos de onda de excitação e emissão, que variaram de 250 a 290nm e de 330 a 505nm, respectivamente. As soluções padrão utilizadas na elaboração das curvas analíticas de calibração foram preparadas em balões volumétricos a partir de uma solução padrão de concentração igual a 100µg/Kg, em acetonitrila. Foram preparadas soluções com cinco níveis de concentrações diferentes: 0.50; 1.00; 5.00; 10.00; 15.00 e 20.00µg/Kg. A quantificação dos HPAs foi realizada por padronização externa nas condições de separação cromatográficas descritas anteriormente. Cada solução padrão foi injetada em triplicata. A confiabilidade analítica foi avaliada usando os parâmetros de linearidade, limite de detecção (LOD), limite de quantificação (LOQ) e faixa linear dinâmica conforme método descrito por RIBANNI (2004).
Resultado e discussão
As análises das amostras de salmão defumado mostraram cromatogramas com perfis semelhantes, conforme Figura 1. Observa-se, que no intervalo de tempo de retenção entre 4 e 14 minutos, apesar de ser utilizado um detector de fluorescência multivariado com uma programação de valores de excitação e emissão dos diferentes comprimentos de onda, para elevar a sensibilidade de detecção para os diferentes HPAs, existem sinais cromatográficos que não puderam ser distinguidos entre HPAs com baixo peso molecular (analitos
de interesse) e contaminantes presentes nos extratos das amostras, dificultando uma identificação adequada. Por outro lado obteve-se resultados positivos para os HPAs de peso molecular elevado contendo 5 ou 6 anéis aromáticos conjugados, sendo identificados qualitativamente o benzo(b)fluoranteno (BbF), o benzo(k)fluoranteno (BkF), o benzo(a)pireno (BaP), o dibenzo(a,h)antraceno (DaA) e o benzo(g,h,i)perileno (BgP). Os valores dos coeficientes de regressão ajustados para as curvas analíticas de calibração variaram no intervalo de 0,9863 a 0,9983, indicando que os modelos matemáticos utilizados para a obtenção de cada uma delas conseguem explicar adequadamente cerca de 98,00 a 99,00% das variações dos sinais analíticos de cada um dos picos cromatográficos em função das concentrações de padrão utilizadas, evidenciando uma excelente correlação quando comparado com o parâmetro de referência citado por INMETRO (2011), que é de 90,00%. Os valores elevados para a estatística de Fisher (F), maior que o valor crítico (Fcrítico = 4,49), indicam a homocedasticidade para cada conjunto de dados utilizados para a construção das curvas analíticas de calibração de cada contaminante, confirmando a homogeneidade de variância para os dados obtidos. A linearidade da resposta do detector para as variações de sinal observadas em cada um dos 6 níveis de concentração usadas para a construção das curvas analíticas de calibração de cada contaminante foi confirmada através da observação do padrão aleatório dos valores de resíduos na faixa de trabalho utilizada, evidenciando um sistema de pontos livre de tendências e confirmando a linearidade do método. Os respectivos valores de LOD e LOQ variaram de 0,0035 a 0,3523 µg/Kg e de 0,0107 a 0,9576 µg/Kg e estão de acordo com as orientações da resolução 835/2011 da Comunidade Europeia (CE). Utilizando as curvas analíticas de calibração foram determinados os valores para os limites de detecção e de quantificação, verificando-se que os mesmos estão dentro dos parâmetros aceitos pela Comunidade Europeia LOD ≤ 0,3 µg/Kg e LOQ ≤ 0,9 µg/Kg para cada HPA, ressaltando que a utilização dos parâmetros da CE foram escolhidos neste trabalho por não existir no Brasil uma legislação específica que defina os limites máximos de concentração para esses contaminantes, nas matrizes de amostras analisadas. Outra informação obtida através das curvas analíticas de calibração foram as concentrações individuais de 5 contaminantes em cada um dos 3 extratos das amostras de salmão defumado estudadas. As concentrações de BaA e CHY não puderam ser calculadas por estarem em concentrações abaixo dos limites de detecção e do limite de quantificação. Como os sinais destes dois contaminantes poderiam encontrar-se na região de 4 a 14 minutos, estes não puderam ser detectados pelas mesmas razões descritas anteriormente. Assim utilizou-se como critério analítico não ausentá-los da amostra e deixá-los como possibilidade analítica abaixo dos respectivos LOD e LOQ determinados. As respectivas concentrações calculadas encontram-se listadas na tabela 1. Comparando nossos resultados com os valores de concentração de HPAs indicados pela Resolução 835/2011 da CE para os Limites máximos de contaminantes (LMC) permitidos para BaP de 2µg/Kg e a soma de 4 HPAs (BaA, CHY, BbF e BaP) de 12µg/Kg em peixes defumados, pode-se concluir que as amostras de salmão defumado analisadas possuem concentrações de contaminantes menores que os limites indicados pela CE, estando assim aptas para consumo humano (tabela 5).
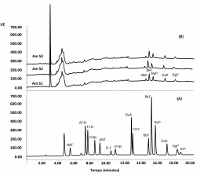
Cromatograma obtido por CLAE-UV-FLC:(A)padrões HPAs e(B)amostras de salmão defumado.

Conclusões
As concentrações de HPAs encontradas no presente estudo evidenciam um nível de contaminação baixo nas amostras de mexilhão e salmão defumado analisadas, indicando que os mesmos estão seguros para serem consumidos sem riscos de intoxicação aguda para a saúde humana. Os parâmetros de confiabilidade analítica apresentaram excelentes resultados para método de separação cromatográfica proposto, com seus respectivos limites de detecção de quantificação abaixo dos valores limites estabelecidos pela Resolução 835/2011 da Comunidade Européia. O uso da coluna C30 mostrou ser uma alternativa inovadora para ser utilizada na separação cromatográfica concomitante dos 16 isômeros de HPAs, indicando que por possuir maior hidrofobicidade, este tipo de coluna também pode ser utilizada para a análize de contaminantes apolares que possuam grande volume molecular (“bulky”), em amostras de alimentos. O processamento utilizado no preparo para comercialização salmão defumado não é capaz de eliminar a contaminação de HPAs, mostrando a necessidade do constante monitoramento destes contaminantes e o desenvolvimento de procedimentos que permitam a produção de pescado dentro de normas de segurança sanitária adequadas.
Agradecimentos
Instituto Federal de Educação Ciência e Tecnologia do Rio de Janeiro - IFRJ. Embrapa Agroindústria de Alimentos. CNPq.
Referências
CARUSO, M. S.; ALABURDA, J. Hidrocarbonetos policíclicos aromáticos – benzo(a)pireno: uma revisão. Revista do Instituto Adolfo Lutz, v 67, n. 1, p. 1-27, 2008.
CAMARGO, M. C. R.; TOLEDO, M. C. F. Avaliação da ingestão de hidrocarbonetos policíclicos aromáticos (HPAs) através da dieta, em diferentes regiões do Brasil. Revista Brasileira de Toxicologia, v.2, n.14, p.23-30, 2001.
CAMARGO, M. C. R.; TOLEDO, M. C. F. Avaliação da contaminação de diferentes grupos de alimentos por hidrocarbonetos policíclicos aromáticos, Brazilian Journal of Food Technology, n.5, p.19-26, 2002.
FALCO, G. et al.. Polycyclic aromatic hydrocarbons in food: human exposure through the diet in Catalonia, Spain, Journal of Food Protection, v.66, n.12, p.2325-2331, 2003.
INMETRO. Instituto Nacional de Metrologia, Normalização e Qualidade Industrial. Orientações sobre Validação de Métodos de Ensaios Químicos. DOQ-CGCRE-008, revisão 03, 2011.
PANDEY, S. K. et al. A review of techiniques for the determination of polycyclic aromatic hydrocarbons in air. Track and Trends in Analytical Chemistry, 30(11):1716-1719, 2011.
POSTER, D. L. et al.. Analysis of polycyclic aromatic hydrocarbons (PAHs) in environmental samples: a critical review of gas chromatographic (GC) methods. Analytical and Bioanalytical Chemistry, v.386, n.4, p.859-881, 2006.
RIBANI, M. et al.. Validação em métodos cromatográficos e eletroforéticos. Quimica Nova, v.27, n.5, p.71-780, 2004
SOUSA, M.M.; NASCIMENTO, V. L. V. Benzo(a)pireno em alimentos. Revista ACTA Tecnológica, v.5, n.1, 2010.
STOLYHWO, A. & SIKORSKI, Z. E. Polycyclic aromatica hydrocarbons in smoked fish – a critical review. Food Chemistry, n. 91, p. 303-311, 2005.
WHO/JECFA (2005). Joint FAO/WHO Expert Committee on food additives, Roma. Acessado em 03/07/2015). Disponóvel em: www.who.int/ipcs/food/jecfa/en.