ISBN 978-85-85905-15-6
Área
Ambiental
Autores
Furmanski, L.M. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; Benedet, K.M. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; Santos, K.G. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; de Noni Jr, A. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; Arnt, A.B.C. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; Rocha, M.R. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC) ; Peterson, M. (UNIVERSIDADE DO EXTREMO SUL CATARINENSE - UNESC)
Resumo
Sulfato ferroso pode ser obtido a partir de fontes à base de ferro, como a carepa. A amostra deste resíduo metalúrgico foi caracterizada por FRX e DRX para identificar composição química e fases cristalinas; apresentando-se com 97% de óxidos de ferro (FeO, Fe3O4 e Fe2O3). A produção de sulfato ferroso se deu por rota química com ataque de H2SO4, filtragem, concentração, resfriamento e secagem. Por fim, submeteu-se a ensaios de DRX e DSC-TGA, confirmando a presença de FeSO4.H2O e acompanhando a variação de massa e as reações envolvidas. A análise térmica de uma amostra padrão de FeSO4.7H2O foi realizada para comparação de ambas, indicando relação entre reações e temperaturas de decomposição do sulfato. No entanto, otimizações devem ser feitas a fim de maximizar a pureza do material.
Palavras chaves
Carepa; Sulfato ferroso; Análise térmica
Introdução
O sulfato ferroso pode estar nas fases cristalinas FeSO4, FeSO4.H2O, FeSO4.4H2O, FeSO4.5H2O e FeSO4.7H2O. Sua produção pode ocorrer por fontes alternativas como nos estudos de Peterson (2008) utilizando pirita dos rejeitos de carvão, Vigânico (2009) com rejeitos de carvão e Cardoso (2012) com resíduo da mineração de ferro. Nessa pesquisa desenvolveu-se sulfato ferroso a partir da carepa oriunda da laminação a quente de aço. Este resíduo metalúrgico é composto basicamente por óxidos de ferro (wustita, magnetita e hematita) com percentual superior a 90% (Martins, 2006; Cunha et al, 2006), possuindo baixo teor de impurezas e elevado teor de ferro (Ahmed et al, 2009). Devido a isso, pode ser precursor de produto químico a base de ferro, como o sulfato ferroso. Esta valorização do resíduo contribui com as questões ambientais, econômicas e tecnológicas, diminuindo os impactos negativos gerados e desenvolvendo um produto alternativo de valor agregado. É comum a realização de análise térmica do sulfato ferroso obtido para acompanhamento da variação de massa e das reações exo e endotérmicas envolvidas na desidratação, desidroxilação, decomposição e oxidação. Swamy et al (1979) cita estudos de análise térmica do FeSO4.7H2O em atmosfera de ar para compreender sua oxidação-decomposição. No período inicial chega-se ao FeSO4.H2O. A partir deste, FeSO4 e Fe(OH)SO4 são formados pela decomposição e oxidação respectivamente, à medida que a temperatura aumenta. Após, FeSO4 e Fe(OH)SO4 são convertidos em Fe2O(SO4)2 por oxidação e decomposição respectivamente. Pode ocorrer de Fe2O(SO4)2 não se formar ao todo, e que FeSO4 transforma-se em Fe2(SO4)3 e Fe2O3. Com relação ao Fe2O(SO4)2, este se decompõe à Fe2O3 por duas vias, uma formando SO3 e outra Fe2(SO4)3, a qual forma Fe1203(SO4)15 e SO3.
Material e métodos
A amostra representativa de carepa foi coletada seguindo a ABNT NBR 10007/2004 em uma metalúrgica que trabalha com laminação a quente de aço, utilizando aços de diferentes composições. A preparação da amostra se deu por moagem durante 30 min em moinho excêntrico (Servitech/CT-242) com esferas de alta alumina no Laboratório de Cerâmica do Instituto de Engenharia e Tecnologia – IDT da UNESC. A carepa passante em malha 200 mesh foi encaminhada para análises de caracterização por difração de raios X (DRX) a fim de determinar fases cristalinas presentes e fluorescência de raios X (FRX) para avaliar composição química. A análise por DRX foi realizada em difratômetro de raios X (Shimadzu/XRD- 6000) no Laboratório de Caracterização de Materiais do IDT/UNESC. A análise química se deu em espectrômetro de FRX (Axios Max Panalytical) no Centro de Tecnologia de Materiais – CTCmat do SENAI. A obtenção do sulfato ferroso inicia-se com a reação da carepa com ácido sulfúrico (H2SO4) em meio aquoso, com a solução em aquecimento e agitação. Uma filtragem ocorre para remoção da massa residual e, então, se sucede a etapa de concentração com novo aquecimento. O precipitado formado foi submetido à resfriamento para favorecer a cristalização e, por fim, secagem em estufa. O material foi encaminhado para ensaio por DRX. A análise térmica por calorimetria exploratória diferencial (DSC) e termogravimetria (TGA) também foi realizada com a amostra de sulfato ferroso obtida nesta pesquisa, assim como a de um padrão (FeSO4.7H2O comercial). Este ensaio foi realizado no Laboratório de Cerâmica Técnica na UNESC em equipamento TA Instruments/SDT-Q600, com taxa de aquecimento 10 ºC/min em atmosfera de nitrogênio até a temperatura de 1350 ºC.
Resultado e discussão
A análise química identificou 97,03% de óxidos de Fe com presença de outros
óxidos de: Al (0,69%), Mn (0,72%), Si (1,12%) e Cr (0,18%), devido à
composição dos aços que geraram a amostra e à contaminação durante moagem e
lavagem do moinho. O resultado por DRX está na Figura 1.
O ensaio identificou as fases wustita (majoritária), magnetita e hematita.
Ambas análises auxiliaram na determinação das condições da rota química.
Nesta obteve-se o sulfato ferroso mono hidratado (FeSO4.H2O – szomolnokite),
identificado por DRX (Figura 2A), que foi submetido a ensaio por DSC-TGA
(Figura 2B).
O gráfico de análise térmica constata perda de massa inicial devido a perdas
de água, como de adsorção e cristalização. Além disso, como nos trabalhos de
Peterson (2008) e Cardoso (2012), a partir de 600 ºC ocorre um pico
endotérmico representando a decomposição do FeSO4. Segundo Pelovski et al
(1996), entre 550 e 800 ºC, ocorrem reações referentes à dessulfurização.
Esses dados podem ser evidenciados na análise por DSC com a amostra padrão e
a produzida no estudo. No entanto, o percentual de perda de massa neste
evento, comparando com a amostra padrão, é cerca de 7% superior, indicando
grau de pureza inferior pela presença de outras fases. Contudo, otimizações
serão realizadas visando aumentar a pureza do material obtido.
A análise térmica pôde auxiliar na investigação a respeito do pico inicial
indefinido na Figura 2A. Assim, com a amostra de FeSO4.H2O, realizou-se uma
secagem em 240 ºC em estufa, temperatura esta de término da perda de massa
inicial diagnosticada na Figura 2B. Com a amostra já seca, o resultado por
DRX apresentou o desaparecimento do pico próximo a 11º em 2θ, evidenciando
relação com a água de cristalização, visto que as perdas iniciais na TGA
referem-se à perda de água.
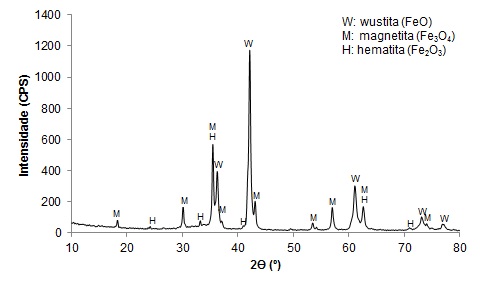
Caracterização por DRX da amostra representativa de carepa
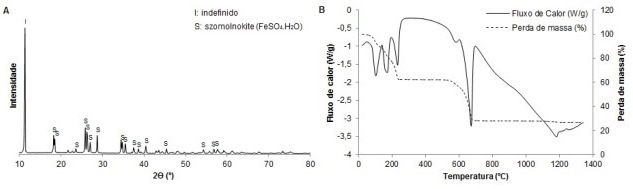
Caracterização da amostra de FeSO4.H2O produzido a partir da carepa por ensaios de A: DRX e B: DSC- TGA
Conclusões
Os resultados da análise térmica do FeSO4.H2O obtido a partir da carepa indicaram aproximação com os resultados de um padrão de FeSO4.7H2O. A secagem do FeSO4.H2O em 240 ºC ocasionou na formação de fases com menor grau de hidratação e o pico a 11º em 2θ no DRX não estava mais presente, inclusive identificando algumas das fases oriundas das reações citadas por Swamy et al (1979). Relacionando o FeSO4.H2O obtido anteriormente (FURMANSKI et al, 2015), pôde-se produzir o material, nesse ensaio, em temperatura de reação mais elevada e com maior pureza, visto que não se identificou residuais no DRX.
Agradecimentos
Ao PROSUP/CAPES e ao PIBIC/CNPq/UNESC, pelos recursos disponibilizados.
Referências
AHMED, Y. M. Z.; HESSIEN, M. M.; RASHAD, M. M.; IBRAHIM, I. A. Nano-crystalline copper ferrites from secondary iron oxide (mill scale). Journal of Magnetism and Magnetic Materials, v. 321, p. 181-187, 2009.
ASSOCIAÇÃO BRASILEIRA DE NORMAS TÉCNICAS – ABNT. NBR 10.007: amostragem de resíduos sólidos. Rio de Janeiro: 2004. 25 p.
CARDOSO, K. A. Produção de sulfato ferroso a partir do resíduo proveniente da mineração de ferro. 2012. 81 f. Dissertação (Pós-Graduação em Engenharia Química). Universidade Federal de Santa Catarina, Florianópolis.
CUNHA, A. F. da; ARAÚJO FILHO, G. de; MARTINS JÚNIOR, A.; GOMES, O. C. B.; ASSIS, P. S. Aspectos técnicos da utilização da carepa gerada em processos siderúrgicos e tratada por desagregação ultra-sônica. Tecnologia em Metalurgia e Materiais, São Paulo, v. 3, n. 2, p. 1-5, 2006.
FURMANSKI, L. M.; BENEDET, K. M.; MACHADO, C. M.; ARNT, A. B. C.; da ROCHA, M. R.; PETERSON, M. Produção de sulfato ferroso mono hidratado a partir de carepa. In: Anais do XI Congresso Brasileiro de Engenharia Química em Iniciação Científica [=Blucher Chemical Engineering Proceedings, v. 1, n.3]. São Paulo: Blucher, 2015. p. 147-152. ISSN impresso 2446-8711, ISSN 2359-1757, DOI 10.5151/chemeng-cobeqic2015-399-34012-261332.
MARTINS, F. M. Caracterização química e mineralógica de resíduos sólidos industriais minerais do estado do Paraná. 2006. 140 f. Dissertação (Pós-Graduação em Química). Universidade Federal do Paraná, Curitiba.
PELOVSKI, Y.; PETKOVA, V.; NIKOLOV, S. Study of the mechanism of the thermochemical decomposition of ferrous sulphate monohydrate. Thermochimica Acta, v. 274, p. 273–280, 1996.
PETERSON, M. Produção de sulfato ferroso a partir da pirita: desenvolvimento sustentável. 2008. 127 f. Tese (Pós-Graduação em Engenharia Química). Universidade Federal de Santa Catarina, Florianópolis.
SWAMY, M. S. R.; PRASAD, T. P.; SANT, B. R. Thermal analysis of ferrous sulphate heptahydrate in air. Journal of Thermal Analysis, v. 15, p. 307–314, 1979.
VIGÂNICO, E. M. Produção de sulfato ferroso a partir de rejeitos de carvão. 2009. 70 f. Dissertação (Pós-Graduação em Engenharia de Minas, Metalúrgica e de Materiais). Universidade Federal do Rio Grande do Sul, Porto Alegre.


















