ISBN 978-85-85905-15-6
Área
Ambiental
Autores
Santos, I.C.A. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Monteiro, L.P.C. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Mainier, F.B. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Santos, I.O. (UNIVERSIDADE FEDERAL FLUMINENSE) ; Pontual, L.V. (UNIVERSIDADE FEDERAL FLUMINENSE)
Resumo
Os metais traços possuem alta reatividade e são bioacumuláveis. O cádmio, o chumbo e o cobre são exemplos de metais traços que causam malefícios ao meio ambiente e à saúde humana. Não obstante, esses metais possuem grande aplicação industrial, sendo necessário o desenvolvimento de técnicas para o tratamento dos efluentes gerados nesses processos. Neste trabalho, foi estudada a remoção de íons de cádmio, cobre e chumbo de efluentes aquosos, através do processo de eletrodeposição, utilizando-se telas de aço-carbono galvanizado como catodo. Verificou-se a influência do tempo de reação na remoção destes metais. Foram obtidas eficiências de até 94,07% para o Cádmio, 94,71% para o Chumbo e 96,19% para o Cobre.
Palavras chaves
ELETRODEPOSIÇÃO; TRATAMENTO DE EFLUENTES; REMOÇÃO DE METAIS TRAÇOS
Introdução
Os metais foram descobertos há milhares de anos pelos seres humanos, sendo amplamente utilizado ao longo da história. Apesar das emissões naturais, as emissões oriundas da atividade humana são as principais fontes de contaminação por metais traços. O elemento cádmio é um metal de transição do grupo IIB da tabela periódica, possuindo peso atômico igual a 102,41 u e número atômico igual a 48. O cádmio metálico é macio e possui coloração prata-esbranquiçada. É um elemento raro, sendo sua concentração na crosta terrestre da ordem de 0,1- 0,5 mg.L-1. Raramente é encontrado na forma pura na natureza, sendo encontrado normalmente associado em minérios de zinco, chumbo e cobre (ATSDR, 2012). O cádmio é usado principalmente em baterias recarregáveis, em pigmentos, nos estabilizadores de calor e luz para PVC, em revestimentos metálicos, em certas ligas ou compostos eletrônicos (OECD, 1994). A produção de cádmio refinado em 2014 foi igual a 22.200t (USGS, 2015). Ao longo prazo, a exposição ocupacional ao cádmio causam efeitos crônicos graves, principalmente nos pulmões e nos rins. Efeitos renais crônicas também foram observados entre a população em geral. Após alta exposição ocupacional, alterações pulmonares são caracterizadas principalmente por doença pulmonar obstrutiva crônica (IPCS, 1992). O elemento chumbo é um metal do grupo IVB da tabela periódica, possuindo peso atômico igual a 207,2 u e número atômico 82. O chumbo é um metal macio e de cor cinza claro (LIDE, 2005). Raramente é encontrado na natureza em seu estado elementar, estando, em geral, associado a outros elementos. A concentração de chumbo na crosta terrestre é de aproximadamente 15-20mg/Kg (ATSDR, 2007). O chumbo é largamente utilizado na fabricação de acumuladores/baterias de chumbo. O chumbo também é usado para revestimento de cabo, de tubulação e de munição. O metal é muito eficaz como um absorvedor de som, é usado para blindagem de radiação em equipamento de raios-X e reatores nucleares, e é utilizado para absorver vibração (LIDE, 2005). Em 2014, a produção global de minério de chumbo foi de 5,46 Mt (USGS, 2015). A exposição ao chumbo pode causar efeitos adversos sobre várias partes do corpo. Os órgãos potencialmente mais afetados são o cérebro e os rins, sendo afetados, também, todo sistema nervoso, circulatório e reprodutor de ambos os sexos. Níveis de chumbos relativamente baixos podem afetar o desenvolvimento do feto e de crianças jovens, prejudicando o seu desenvolvimento mental e causando uma diminuição pequena, mas mensurável no QI (ILA, 2001). O elemento químico cobre é um metal de transição do grupo IIB, possuindo peso atômico 63,54u e número atômico 29. O cobre é de cor avermelhada, dúctil e maleável (RIBEIRO, 2001). O cobre é encontrado naturalmente em rochas, no solo, na água, em sedimentos e, em níveis mais baixos, no ar. Sua concentração média na crosta da Terra é de cerca de 50 partes por milhão (mg.L-1) (ATSDR, 2004). O cobre é utilizado como condutores para circuitos elétricos e eletrônicos, em bobinas e comutadores de motores elétricos, em interruptores elétricos, tubulações, aquecedores, na construção civil, plantas de processamento químico e farmacêutico, em catalisadores, trocadores de calor industriais e automotivos e produtos domésticos, incluindo utensílios de cozinha (OCDE, 1995). Em 2014, a produção mundial de minério de cobre foi de 18,7 milhões de toneladas (USGS, 2015). A ingestão de cobre pode causar dor de cabeça, náuseas, tonturas, vômitos e diarreia, taquicardia, dificuldade respiratória, anemia hemolítica, hematúria, hemorragia aguda digestiva, insuficiência hepática e renal, e morte. A exposição cutânea pode induzir respostas alérgicas em pessoas sensíveis (IPCS, 1998). Os principais processos utilizados para o tratamento de efluentes líquidos industriais são a aeração, floculação, sedimentação simples ou após floculação, filtração lenta ou rápida, desinfecção e correção de pH (RIBEIRO, 2002). O processo eletrolítico tem se mostrado uma tecnologia promissora, por não envolver o uso de reagentes químicos e a geração de grandes quantidades de resíduos sólidos contendo substâncias tóxicas (LEMOS, 2008). Um dos processos eletrolíticos utilizados é a eletrodeposição, que possibilita um processo eficaz tendo como atrativo a possibilidade de recuperação dos metais em uma única etapa (SCOTT e PATON, 1993). Desta forma, o tratamento por eletrodeposição foi escolhido por representar uma tecnologia promissora no tratamento de efluentes contendo metais traços, sendo muito importante o seu estudo e desenvolvimento. O objetivo deste trabalho foi estudar a tecnologia de eletrodeposição para a remoção de íons de cádmio, chumbo e cobre de soluções aquosas, utilizando-se tela de aço-carbono galvanizado como catodo. Foram calculadas as eficiências de remoção no tempo teórico para cada metal traço e, posteriormente, as eficiências em tempos reacionais maiores.
Material e métodos
O estudo de remoção de íons de cádmio, chumbo e cobre iniciou-se com o preparo das soluções simulando os efluentes, sendo utilizado o acetato de cádmio dihidratado (Cd(C2H3O2)2.2(H2O), acetato de chumbo trihidratado (Pb(C2H3O2)2.3H2O) e sulfato de cobre anidro(CuSO4), respectivamente. A concentração inicial do metal a ser analisado em cada experimento foi de 100 mg.L-1. Foi utilizada água deionizada no preparo das soluções. A célula eletrolítica foi montada utilizando-se um béquer de vidro de 0,250L, sendo o volume reacional igual a 0,250L. Para a aplicação da tensão nas células, foi utilizada uma fonte de alimentação regulável de corrente contínua, da marca HIKARI, modelo HF3003S. Para a agitação, foi utilizada uma placa de agitação magnética, da marca Nova Instruments, modelo NI1102. O catodo foi elaborado utilizando-se tela de aço-carbono galvanizado (malha 30, diâmetro do arame de 0,00030m, abertura da malha de 0,00055m) com medida de 0,08mx 0,04 m, ficando imersos na solução 0,065mx0,04 m. Para o anodo, foi utilizada uma placa fina de platina com área de 0,00042m2. Os eletrodos foram previamente limpos antes de cada experimento. A limpeza foi feita por imersão, primeiramente, em uma solução de NaOH e, posteriomente, em uma solução de HCl. No final de cada imersão, os eletrodos foram lavados com água deionizada. Para marcação do tempo, foi utilizado um cronômetro, da marca Cronobio, modelo SW-2018. Para verificar se houve variação na temperatura, foi utilizado um termômetro de Mercúrio da marca Incoterm. Foi utilizado, ainda, um suporte para prender os fios, o termômetro e para dar a sustentação necessária aos eletrodos.
Resultado e discussão
Todos os ensaios foram realizados com uma tensão de operação de 20V, o que
resultou em uma corrente de 0,02A para o Cádmio, 0,01A para o Chumbo e 0,10A
para o Cobre. Os processos foram realizados a temperatura e pressão
ambiente. Os tempos teóricos (tT)foram calculados utilizando-se a lei de
Faraday, descrita abaixo:
mEL = ( E x i x t ) / F ;
Onde i é a corrente aplicada (A), t é o tempo de aplicação da corrente (s),
E é o equivalente eletroquímico (massa atômica/carga) e F é a constante de
Faraday (96485 C.mol-1 ).
Todos os ensaios foram realizados em triplicatas, sendo os resultados
expostos neste trabalho médias aritméticas desses ensaios. A eficiência de
remoção foi calculada através do parâmetro Er, conforme equação abaixo:
Er = [( Ci - Cf) / Ci ]*100 .
As análises das concentrações dos metais foram feitas em analisador
voltamétrico, da marca Metrohm, modelo 797 VA Computrace.
Os resultados obtidos são mostrados na tabela 1.
Pode-se observar que, no tempo teórico, calculado a partir da Lei de
Faraday, não foi obtida a eficiência igual a 100%. Para isso, seria
necessário que toda a corrente aplicada fosse utilizada na deposição do
metal de interesse, o que não ocorre de fato, sendo a corrente utilizada
também para a deposição de outros contaminantes e/ou em reações secundárias.
Pode-se observar, ainda, que, com o aumento do tempo, houve aumento da
eficiência de remoção.
No tempo teórico, o chumbo teve a melhor eficiência de remoção, porém, houve
pouco ganho de eficiência de remoção deste metal com o aumento do tempo. O
cobre foi o metal que apresentou a menor eficiência de remoção no tempo
teórico, porém, apresentou o maior ganho de eficiência de remoção com o
aumento do tempo. Isto pode ter ocorrido pelo fato do cobre ter um tempo
teórico menor que dos outros metais, visto que possui massa molecular menor
que o cádmio e o chumbo, além do seu meio reacional ter possibilitado a
maior corrente elétrica à 20V.
Estes resultados são compatíveis com os obtidos na literatura. Fernandes et
al (2012), em seus estudos sobre eletrodeposição, obteve uma eficiência de
remoção de cádmio de 98%, utilizando como cátodo duas telas de aço carbono,
potência de 30 V, tempo de 120 minutos e concentração inicial de 500 mg.L-1.
Lemos (2008) estudou a utilização de catodos na forma de telas de aço
inoxidável e titânio, e anodos de telas de titânio revestidas com óxidos de
rutênio, para a remoção de cobre, ouro e prata de efluente de mineração de
ouro, obtendo eficiências de até 100%.
Não foi percebida a variação da temperatura durante o processo.
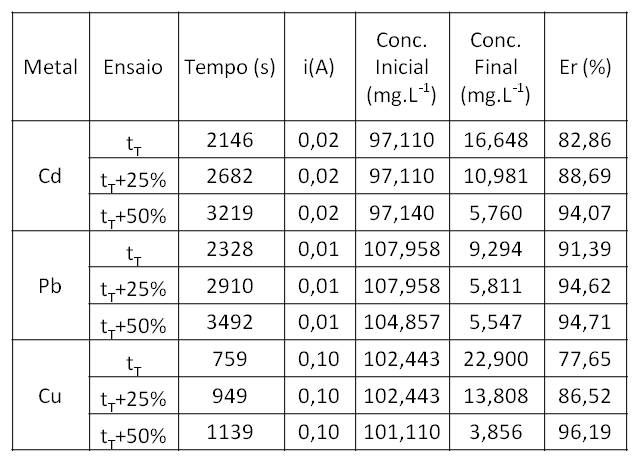
Tabela com as eficiências de remoção (Er), à 20V, para os ensaios com cada metal.
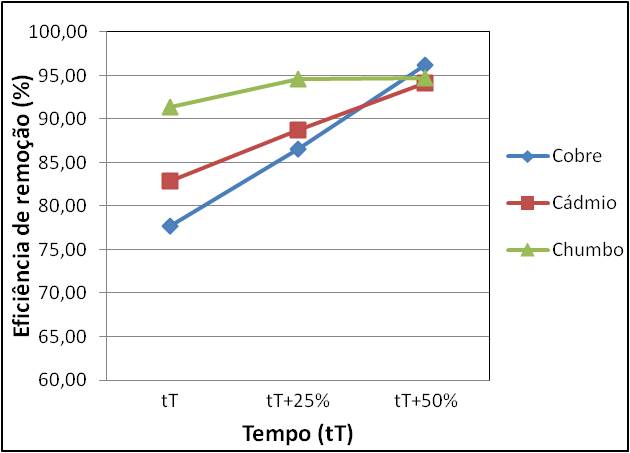
Gráfico com as eficiências de remoção (Er) para cada metal em diversos tempos reacionais.
Conclusões
As eficiências de remoção obtidas não foram de 100% para o tempo teórico, mostrando que não foi possível utilizar toda corrente elétrica aplicada na deposição dos metais, existindo a utilização da mesma para outros fins. Foram obtidas eficiências de remoção superiores a 90% para todos os metais estudados, sendo verificado que houve aumento da eficiência de remoção com o aumento do tempo reacional. As maiores eficiências de remoção observadas foram de 94,07% para o Cádmio, 94,71% para o Chumbo e 96,19% para o Cobre, todas elas referentes aos ensaios com o tempo reacional igual ao tempo teórico mais 50% (tT+50%). Os resultados obtidos demonstram que a eletrodeposição é uma técnica eficiente para a remoção dos metais traços em efluentes aquosos, sendo apropriada a utilização de tela de aço-carbono galvanizado como catodo. Outros fatores podem afetar a eletrodeposição, sendo salutar o estudo deste processo em condições distintas.
Agradecimentos
Referências
ATSDR- AGENCY FOR TOXIC SUBSTANCES AND DISEASE REGISTRY. Toxicological profile for Cadmium. U.S. Department of Health and Human Services, Public Health Service. Atlanta, GA. 2012.
ATSDR- AGENCY FOR TOXIC SUBSTANCES AND DISEASE REGISTRY. Toxicological Profile for Copper. U.S. Department of Health and Human Services, Public Health Service. Atlanta, GA. 2004.
ATSDR- AGENCY FOR TOXIC SUBSTANCES AND DISEASE REGISTRY. Toxicological Profile for Lead. U.S. Department of Health and Human Services, Public Health Service. Atlanta, GA. 2007.
FERNANDES, L. H.; MAINIER, F. B.; MONTEIRO, L. P. C. Remoção de íons cádmio de efluentes líquidos através de técnicas eletroquímicas utilizando telas de aço-carbono como catodo. Engevista, v. 14, n. 1, 2011.
ILA– INTERNATIONAL LEAD ASSOCIATION. Lead: The facts. Imperial College Consultants Ltd. London, UK. 2001.
IPCS- INTERNATIONAL PROGRAMME ON CHEMICAL SAFETY. Environmental health criteria 134: Cadmium. World Health Organization (WHO). Geneva. 1992.
IPCS- INTERNATIONAL PROGRAMME ON CHEMICAL SAFETY. Environmental health criteria 135: Cadmium- Environmental Aspects. World Health Organization (WHO). Geneva, 1992.
IPCS- INTERNATIONAL PROGRAMME ON CHEMICAL SAFETY. Environmental health criteria 200: Copper. World Health Organization (WHO). Geneva, 1998.
LEMOS, F. A. Recuperação eletrolítica de cobre, ouro e prata de efluentes de mineração de ouro. Tese (Doutorado)- COPPE/ Universidade Federal do Rio de Janeiro. Rio de Janeiro, RJ. 2008.
LIDE, D. R. (Ed.). CRC Handbook of Chemistry and Physics. Internet Version 2005. CRC Press. Boca Raton, FL. 2005. Disponível em: <http://www.hbcpnetbase.com>. Acesso em: 16 de julho de 2015.
OECD- ORGANISATION FOR ECONOMIC CO-OPERATION AND DEVELOPMENT. Environment Monograph Series Nº. 104. Risk reduction monograph nº. 5: Cadmium. Background and National Experience with Reducing Risk. Paris, 1994.
OECD- ORGANISATION FOR ECONOMIC CO-OPERATION AND DEVELOPMENT. Environment Monograph Series Nº. 109. Recycling of Copper, Lead and Zinc Bearing Wastes. Paris, 1995.
RIBEIRO, J. A. S. "Cobre" em Balanço Mineral Brasileiro 2001. Departamento Nacional de Produção Mineral (DNPM). Brasília, 2001. Disponível em: <http://www.dnpm.gov.br/dnpm/paginas/balanco-mineral/arquivos/balanco-mineral-brasileiro-2001 >. Acesso em: 16 de julho de 2015.
RIBEIRO, M. A. Estudos sobre a remoção de metais tóxicos em efluentes industriais após a irradiação com feixe de elétrons. Tese (Doutorado)- Universidade de São Paulo. São Paulo, SP. 2002.
SCOTT, K.; PATON, E. M. An analysis of metal recovery by electrodeposition from mixed metal ion solutions—part I. Theoretical behaviour of batch recycle operation. Electrochimica acta, v. 38, n. 15, p. 2181-2189, 1993.
USGS- U.S. GEOLOGICAL SURVEY. Mineral commodity summary: Cadmium. Reston, Virginia. 2015.
USGS- U.S. GEOLOGICAL SURVEY. Mineral commodity summary: Copper. Reston, Virginia. 2015.
USGS- U.S. GEOLOGICAL SURVEY. Mineral commodity summary: Lead. Reston, Virginia. 2015.


















