ISBN 978-85-85905-15-6
Área
Química Tecnológica
Autores
Oliveira, M.A. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Silva, G. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Silveira, L.M. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Campos, M.S.T. (UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO) ; Pires, S.A. (UNIVERSIDADE FEDERAL DE MINAS GERAIS)
Resumo
Os Fibratos são fármacos usados no tratamento da hipertrigliceridemia e na prevenção da aterosclerose. Os fibratos escolhidos para o projeto foram: ciprofibrato, fenofibrato e bezafibrato. Para avaliação da estabilidade intrínseca, os fármacos foram expostos às condições de estresses (temperatura, umidade, oxidação, exposição à luz UV, hidrólise em diferentes valores de pH e solução de íons metálicos), e submetidas à análise por CLAE. Os três fármacos mostraram-se muito instáveis degradando em todas as condições utilizadas. A degradação mais significativa foi referente às hidrólises ácida e básica. A partir dessa degradação foi realizado o estudo cinético onde os fibratos foram submetidos às hidrólises ácida e básica em diferentes temperaturas e tempos.
Palavras chaves
Fibratos; CLAE ; cinética de degradação
Introdução
Os Fibratos são fármacos usados no tratamento da hipertrigliceridemia e na prevenção da aterosclerose, são representados pelos fármacos: clorfibrato, ciprofibrato, bezafibrato, geozila e fenofibrato. Os fibratos diminuem os níveis de triglicerídeos, aumentam HDL-C, sendo este efeito mais pronunciado em pacientes com hipertrigliceridemia. O efeito sobre os níveis de LDL-C é variável; reduzem os níveis em pacientes com triglicerídeos baixos, mas os níveis podem até se elevar em pacientes com níveis altos de triglicerídeos (SCHULZ, 2006). Os fibratos apresentam ainda baixa solubilidade em meio aquoso e alta permeabilidade, sendo classificados no sistema de classificação biofarmacêutica (SCB) como fármacos de Classe II (BENET, 2006). Qualquer alteração de qualidade de um medicamento de Classe II influencia diretamente na sua biodisponibilidade (YOSHIDA et al., 2011a; YOSHIDA et al., 2010). Dentre os fibratos, foram escolhidos para execução do projeto três fármacos: ciprofibrato, fenofibrato e benzafibrato. Os fármacos foram escolhidos diante da disponibilização de matéria prima e da evidência de pouca publicação científica a respeito dos fármacos em relação ao assunto de pesquisa proposto. Assim, para Ciprofibrato, Benzafibrato e Fenofibrato, algumas metodologias analíticas de análise já foram desenvolvidas por CLAE/UV (Cromatografia Líquida de Alta Eficiência) (NASCIMENTO et al., 2011; SALAMA et al., 2011; JAIN et al., 2012; KUMBHAR et al., 2013; WEI et al., 2008) e foram utilizados como parâmetro no projeto. No entanto, poucos artigos foram publicados à respeito de dados de estabilidade dos fibratos escolhidos (SALAMA et al., 2011; JAIN et al., 2012; KUMBHAR et al., 2013), sem qualquer identificação de produto de degradação ou hipótese de rota de síntese, e nenhum dado relacionado à aspectos da cinética de degradação destes fármacos foram encontrados em publicações, o que torna o projeto de interesse científico. No desenvolvimento de uma formulação farmacêutica, é importante determinar a estabilidade intrínseca do fármaco para prever possíveis reações e produtos de degradação (SILVA et al., 2009). A estabilidade intrínseca da substância deve ser avaliada quanto à temperatura, umidade, oxidação, exposição à luz e hidrólise em diferentes valores de pH. O teste de fotoestabilidade pode ser avaliado submetendo a substância à irradiação ultravioleta. Alguns caminhos de degradação podem ser complexos. Nem sempre os produtos de decomposição formados nas condições de estabilidade intrínseca, mais drásticas, são observados nos medicamentos submetidos às condições oficiais dos estudos de estabilidade (UNITED, 2014; SILVA et al., 2009; BRASIL, 2005). Desta forma, a estabilidade intrínseca dos fármacos é parte fundamental na pesquisa de possíveis produtos de degradação dos fármacos, no entanto, estes produtos podem não acontecer nas condições normais de armazenamento dos medicamentos. Diante da classificação do fármaco como classe II, baixa solubilidade e alta permeabilidade, é de grande importância, estudos relacionados à produtos de degradação e velocidade de possíveis reações; visto que quaisquer alterações nos produtos farmacêuticos, como a redução de ativo influenciam diretamente na biodisponibilidade do fármaco. Desta forma, estudos para identificar rotas de degradação do fármaco; e determinar a velocidade (cinética) destas reações de degradação para avaliar a verdadeira importância da mesma são extremamente importantes para garantir a qualidade dos medicamentos do mercado.
Material e métodos
A análise por CLAE utilizou equipamento da Marca Waters® provido de detector UV/DAD, autoinjetor e forno. A metodologia teve como princípio a cromatografia em fase reversa, com uso de coluna RP-18 com comprimento de 30 cm para facilitar a separação de possíveis produtos de degradação, e utilizou do recurso do detector UV/DAD, que facilita a identificação dos produtos e evidencias de possíveis co-eluições. As condições cromatográficas estabelecidas para análise dos fármacos bezafibrato, ciprofibrato e fenofibrato estão descritas a seguir: comprimentos de onda: bezafibrato 254 nm; ciprofibrato 236 nm; fenofibrato 290 nm; fase móvel: ácido fosfórico 0,1% e acetonitrila (35:65 %v/v); fluxo: 1,0 mL.min-1; temperatura: 30 ºC; volume de injeção: 20 µL; tempo de analise: em torno de 20 minutos. As condições que utilizamos para avaliar a estabilidade intrínseca foram: exposição ao calor seco, hidrólise neutra, hidrólise alcalina, hidrólise ácida, oxidação com peróxido de hidrogênio a 3%, exposição à luz ultravioleta e solução com íons metálicos (FeSO4). E depois do período de exposição, as amostras foram retiradas de cada condição do estresse, e procedeu a análise por CLAE. Os parâmetros de performance (system suitability) foram calculados segundo fórmulas preconizadas pela Farmacopéia Brasileira (BRASIL, 2010): fator de retenção (k’); assimetria (As); número de pratos teóricos (N); resolução (Rs). Após os estudos de degradação, os fármacos foram submetidos às condições em que sofreram maior degradação, Hidrólise Ácida e Hidrólise Básica, nas diferentes temperaturas de 50 °C, 60 ºC, 70 °C e 80 °C. Foram coletadas amostras após 4, 5, 6 e 7 horas. Avaliou- se a cinética de degradação com os modelos de zero, primeira e segunda ordem. Definido o melhor modelo de ajuste: zero, primeira ou segunda ordem, foi possível calcular a velocidade de degradação (K) para cada temperatura com auxílio da inclinação das retas. Em seguida, diante das velocidades de degradação (K) de cada temperatura, possibilitou a determinação, com auxílio da Equação de Arrhenius, de qual seria K a 25 ºC e assim indicar em quanto tempo o fármaco degrada 10 % (t90). Esta é uma forma de determinar o prazo de validade de um fármaco ou medicamento, também chamado t90, ou vida útil.
Resultado e discussão
Após a otimização do método de análise por HPLC os parâmetros de performance
encontrados para os padrões dos fármacos bezafibrato, ciprofibrato e
fenofibrato estão descrito a seguir: Fator de retenção (k’): Bezafibrato:
0,67; Ciprofibrato: 1,09; Fenofibrato: 3,51; Assimetria do pico (As):
Bezafibrato: 1,41; Ciprofibrato: 1,35; Fenofibrato: 1,07; Número de
pratos teóricos (N): Bezafibrato: 4.299; Ciprofibrato: 6.052; Fenofibrato:
13.258; Resolução (Rs): Ciprofibrato: 3,95; Fenofibrato: 17,77. Os
resultados mostram-se satisfatórios de acordo com os limites estabelecidos
para cada parâmetro, que são: fator de retenção (k’): k’> 0,5; pratos
teóricos (N): N > 2.000; e fator de cauda (T): T ≤ 2 e Resolução (Rs): Rs >
2 ( RABANI et al, 2004).
Às análises dos fármacos bezafibrato, ciprofibrato, e fenofibrato antes e
após submissão às condições de estresse sob calor seco, hidrólise neutra,
hidrólise alcalina, hidrólise ácida, oxidação com peróxido de hidrogênio a
3%, exposição à luz ultravioleta e com solução de íons metálicos (FeSO4)
apresentaram tempo de cromatografia de 20 minutos. Os fármacos mostraram
picos nos tempos: 4,31 min para bezafibrato; 5,4 min para ciprofibrato e
11,6 min para fenofibrato. O pico de tempo de retenção em 2,58 minutos
refere-se ao t0 (tempo morto) que é mais evidenciado nas amostras que foram
submetidas à oxidação devido à sobreposição com o peróxido de hidrogênio, e
após exposição à íons metálicos devido à sobreposição com FeSO4.
Os três fármacos mostraram-se muito instáveis degradando em todas as
condições utilizadas. Os resultados da redução de área dos fármacos após
submissão às condições de estresse demonstraram que a redução mais
significativa foi referente à hidrólises ácida e básica. Diante destes
resultados de estabilidade intrínseca, decidiu-se trabalhar com cinética de
degradação sob hidrólise ácida e básica inicialmente, nas temperaturas de
50, 60, 70 e 80 °C.
Para o Bezafibrato os estudos cinéticos de degradação sob hidrólise ácida e
básica não demonstraram nenhuma relação de proporcionalidade entre o tempo e
a temperatura de degradação que seria possível de ser ajustado pelos modelos
cinéticos. Isto pode ser devido a sua estrutura molecular, já que existe a
possibilidade de formação de um aminoácido como produto de degradação da
hidrólise no grupamento amida, e sabe-se que a detecção de aminoácidos por
HPLC/UV com fase reversa pode apresentar deformação no perfil cromatográfico
do pico quando não à ajuste de pH adequado (NETO, 2010).
Para o ciprofibrato os estudos cinéticos apontaram um ajuste matemático
apenas para cinética de formação de um produto de degradação no tempo de
retenção de 6,61 min em meio ácido. Os achados por JAIN et al (2012)
mostraram-se de acordo com os resultados do presente trabalho, onde o
ciprofibrato também apresentou-se instável em hidrolise ácida, hidrolise
básica e sob oxidação.
O fenofibrato apresentou uma redução significativa da área do pico em
hidrolise básica e neutra. Como já relatado KUMBHAR et al (2013) o fármaco
fenofibrato apresenta rápida degradação sob hidrolise básica, sob hidrolise
ácida e em peróxido de hidrogênio em diferentes tempo e diferentes
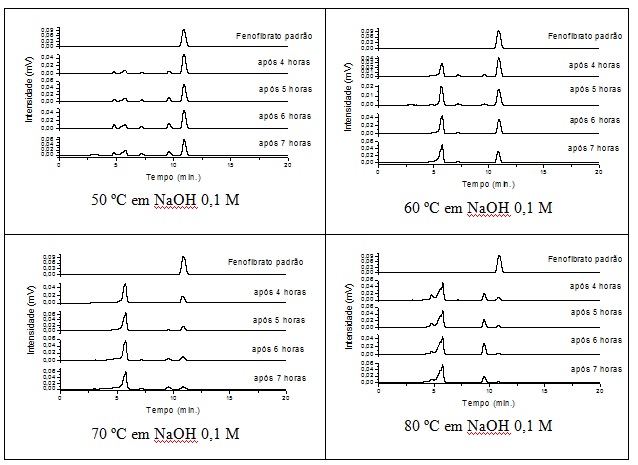
concentrações da condição de estresse. A figura 1 apresenta o cromatograma
do estudo de cinética do Fenofibrato em hidrólise básica. Os valores
referentes aos ajustes matemáticos dos modelos de zero, primeira e segunda
ordem para as temperaturas de 50, 60, 70 e 80 ºC do fármaco fenofibrato
obtidos sugere que a cinética de reação que melhor descreve a redução do
fármaco fenofibrato em função da temperatura, é a de primeira ordem, ou
seja, a velocidade da reação depende de um fator, seja ele reagente ou
produto envolvido na reação (BROWN, et al, 2005 ).
Após a determinação da ordem de reação, foram calculadas as constantes de
velocidade de degradação para cada temperatura, sendo: k50°c= 0,148797926,
k60°c= 0,181610946, k70°c= 0,381299703, k80°c= 0,591997704. Contudo também
foi possível calcular K25 ºC, que foi de 0,031406672. Assim t90 foi de 3,34
horas. Isto significa que o fármaco degrada 10% após 3,34 horas quando
exposto a NaOH 0,1 M, ou em pH equivalente. De acordo com o gráfico da
equação de Arrhenius, log k em função T-1 (Figura 2). A inclinação da reta é
definida pela equação Ea (2,303 × R)-1, diante disso foi possível calcular a
energia de ativação, sendo então Ea= 455,14 J mol-1.

Conclusões
O método de analise por HPLC foi otimizado, apresentando parâmetros de performance adequados para os três fármacos. Os três fármacos mostraram-se extremamente instáveis em meio líquido, sofrendo reações em todas as condições de estresse, entretanto demonstraram que a redução mais significativa foi referente às hidrólises ácida e básica. Não foi possível estudar a cinética de degradação de Bezafibrato e Ciprofibrato, pois esses fármacos não apresentam nenhuma proporcionalidade entre o tempo e a temperatura de degradação que seria possível de ser ajustado pelos modelos cinéticos. No entanto pôde-se estudar a cinética de formação do produto de degradação do ciprofibrato. Para fenofibrato foi possível estudar a cinética de degradação em hidrolise básica, a reação demonstrou ser de primeira ordem, e tendo como t90 o valor de 3,34 horas, isso demonstra o quanto o fármaco é instável quando exposto a compostos NaOH 0,1 M, ou em pH equivalente. Diante da instabilidade dos fármacos em meio líquido nota-se a ausência de formas farmacêuticas líquidas destes fibratos no mercado, o que pode ser entendido pelos estudos de degradação e cinéticos.
Agradecimentos
À FAPES (Fundação de Amparo à Pesquisa do Espírito Santo) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro.
Referências
BENET, L. Z. Can the BCS be modified to expand the inclusion of drugs in class 1 based on transporter-enzyme interplay. In: AAPS Annual Meeting, 2006, San Antonio. San Antonio: University of California, 2006. Disponível em: <www.aapspharmaceutica.com/meetings/files/103/ LesBenetChallengesRoundtableinBCS.pdf>. Acesso em: 20 jun. 2015.
BRASIL. Agência Nacional de Vigilância Sanitária. Resolução RE nº 1, 29 de julho de 2005. Publicação do Guia para a Realização de Estudos de Estabilidade. Diário Oficial da União, Poder Executivo, Brasília, DF, 01 de agosto de 2005.
BROWN, T. L.; JUNIOR, H. E. L.; BURSTEN, B. E.; BURDGE, J. R. Química a ciência central. 9. ed. São Paulo: Pearson Prentice Hall, 2005.
FARMACOPEIA. Resolução RDC nº 49, de 23 de novembro de 2010. Agência Nacional de Vigilância Sanitária. Aprova a 5 ª edição da Farmacopéia Brasileira. Diário Oficial da União, Brasília, 24 nov. 2010.
JAIN, P. S.; JIVANI, H. N.; KHATAL, R. N.; SURANA, S. J. Stability-indicating HPLC determination of ciprofibrate in bulk drug and pharmaceutical dosage form. Chemical Industry & Chemical Engineering Quarterly, v. 18, n.1, p. 95−101, 2012.
KUMBHAR, S. T.; LONI, A. B.; KOTHALI, V. Development and validation of stability indicating LC method for the estimation of fenofibrate. World Journal of Pharmacy and Pharmaceutical Sciences, v. 2, n. 5, p. 4061-4078, 2013.
NASCIMENTO, G. N. L.; ROSA, D. L.; NISHIJO, H.; AVERSI-FERREIRA, T. A.Validation of a spectrophotometric method to determine ciprofibrate content in tablets. Brazilian Journal of Pharmaceutical Sciences, v. 47, n. 1, p. 23-29, 2011.
NETO, A. J. S.; Problemas com o Formato dos Picos em Cromatografi a Líquida – Parte 4. Scientia Chromatographica. v. 2, n. 3, p. 61-67, 2010.
RABANI, M.; BOTTOLI, C. B. G.; COLLINS, C. H.; JARDIM,I. C. S. F.; MELO, L. F. C. Validação em métodos cromatográficos e eletroforéticos. Química Nova, v. 27, n. 5, p. 771-780, 2004.
SALAMA, F. M. M.; NASSAR, M. W. I.; SHARAF EL-DIN, M. M. K.; ATTIA, K. A. M.; KADDAH, M. Y. Detemination of fenofibrate and the degradation product using simultaneous UV-derivate spectrometric method and HPLC. American Journal of Analytical Chemistry, v. 2, p. 332-343, 2011.
SCHULZ, I. Tratamento das dislipidemias – Como e quando indicar a combinação de medicamentos hipolipemiantes. Arq. Bras. Endocrinol. Metab., v. 50, n. 2, p. 344-359, 2006.
SILVA, K. E. R.; ALVES, L. D. S.; SOARES, M. F. R.; PASSOS, R. C. S.; FARIA, A. R.; ROLIM NETO, P. J. Modelos de avaliação da estabilidade de fármacos e medicamentos para a indústria farmacêutica. J. Basic Appl. Pharm. Sci., 30, 2, p. 1-8, 2009.
UNITED States Pharmacopoeia. 37.ed. Rockville: United States Pharmacopeial Convention, 2014.
WEI, Z.; BING-REN, X.; YING, Z.; LIYAN, Y.; TENG, W.; CAI-YUN, W. HPLC method for the determination of bezafibrate in human plasma and application to a pharmacokinetic study of bezafibrate dispersible tablet. J. Chromatogr. Sci., v. 46, n. 10, p. 844-847, 2008.
WEI, Z.; BING-REN, X.; YING, Z.; LIYAN, Y.; TENG, W.; CAI-YUN, W. HPLC method for the determination of bezafibrate in human plasma and application to a pharmacokinetic study of bezafibrate dispersible tablet. J. Chromatogr. Sci., v. 46, n. 10, p. 844-847, 2008.
YOSHIDA, M. I.; LIMA GOMES, E. L.; VIANNA-SOARES, C. D.; CUNHA, A. F.; OLIVEIRA, M. A. Thermal analysis applied to verapamil hydrochloride characterization in pharmaceutical formulations. Molecules, v. 15, p. 2439-2452, 2010.
YOSHIDA, M. I.; LIMA GOMES, E. L.; VIANNA-SOARES, C. D.; OLIVEIRA, M. A. Thermal behavior study and decomposition kinetics of amiodarone hydrochloride under isothermal conditions. Drug Development and Industrial Pharmacy, early online, p. 1-10, 2011a.


















