ISBN 978-85-85905-15-6
Área
Química Tecnológica
Autores
Gonçalves, G.R.F. (UESB) ; Gandolfi, O.R.R. (UESB) ; Santos, C.M.S. (UESB) ; Bonomo, R.C.F. (UESB) ; Santos, L.S. (UESB) ; Veloso, C.M. (UESB) ; Fontan, R.C.I. (UESB)
Resumo
A necessidade de produção de adsorventes que mantenham a bioatividade das moléculas após sua purificação é crescente. Entre tais adsorventes, um que vem apresentando grande potencial de aplicação são os criogéis poliméricos. Diante disso, objetivou-se nesse trabalho produzir e caracterizar um criogel supermacroporoso ativado com etilenodiamina para a imobilização do carboidrato modificado n-acetil-D-glicosamina visando à purificação de lectinas por técnicas de afinidade. Conseguiu-se imobilizar 32,47 mg de carboidrato por grama de criogel seco. Os resultados obtidos para a caracterização indicaram elevada capacidade de hidratação e comprovaram a natureza macroporosa da estrutura dos criogéis, o que reforça sua utilização com meios altamente concentrados ou particulados.
Palavras chaves
Inovação; Adsorvente; Monólitos
Introdução
As lectinas são definidas como proteínas de origem não imune que reconhecem e se associam a carboidratos ou glicoconjugados de forma reversível, com alta afinidade e especificidade (PANDEY et al., 2009). Em virtude dessa habilidade, tais biomoléculas apresentam importantes efeitos biológicos, como ação inseticida (COELHO et al., 2007), bactericida (SANTI-GADELHA et al., 2006), antitumoral (PETROSSIAN et al., 2007), fungicida (SITOHY et al., 2007), além de ação inibitória sobre a protease HIV-I (NG et al., 2002). Podem também ser utilizadas na produção de biossensores para a indústria de alimentos, verificando a presença de microrganismos, assegurando assim a qualidade de matérias primas e produtos industrializados (RAHAIE E KAZEMI, 2010). Devido as excelentes propriedades oferecidas pelas lectinas, o interesse na purificação das mesmas vem apresentando grande potencial. A utilização de técnicas cromatográficas está entre os processos mais utilizados para purificação de proteínas (KILIKIAN, 2005). Porém, a presença de grandes biomoléculas e meios muito concentrados desafiam os limites dos métodos cromatográficos tradicionais. Para superar esses inconvenientes, vem ocorrendo o desenvolvimento de materiais monolíticos poliméricos supermacroporosos, que permitem a separação de grandes biomoléculas e até mesmo de células inteiras em materiais não clarificados (STICKEL e FOTOPOULOS, 2001). Dentre os monólitos utilizados como colunas cromatográficas, os criogéis poliméricos vêm apresentando destaque. Estes possuem elevada porosidade, com grandes poros interconectados, apresentando baixa resistência ao escoamento, permitindo o uso de soluções mais viscosas, além de serem mais econômicos que as colunas tradicionais (HAHN et al., 2002; PODGORNIK et al., 2000. Em contrapartida, a área superficial dessas colunas é menor do que as tradicionais colunas cromatográficas, possuindo uma menor capacidade de ligação, o que acaba diminuindo a eficiência da purificação. Para aumentar a eficiência dos criogéis em processos de imobilização e purificação de biomoléculas, várias metodologias de ativação de sua superfície são apontadas. As modificações da superfície do criogel são normalmente realizadas por meio da circulação das soluções contendo os agentes de ativação através da matriz polimérica ou por imersão do suporte (geralmente para criogéis em formato de disco) na solução contendo os grupos ligantes (KIM; HAGE, 2005). Visando a possibilidade de modificações dos criogéis tem-se produzido tais monólitos utilizando o monômero alil-glicicil-éter (AGE). Tal composto provoca um aumento na resistência estrutural dos criogéis, além de fornecer grupos epóxi reativos na superfície dos mesmos (ARVIDSSON et al., 2003). Tais suportes estão entre os mais utilizados devido ao fato de os grupos epóxi poderem facilmente reagir com grupos amina (NH2), tiol (SH) ou hidroxila (OH) e formar uma interação covalente bem estável (MATEO et al., 2000; MATEO et al., 2003). Diversos métodos de ativação da superfície dos criogéis seguido da imobilização de biomoléculas têm sido relatados (MALLIK; HAGE, 2006; KHAN et al., 2012; TÜZMEN; KALBURCU; DENIZLI, 2012; UYGUN et al., 2012). Porém, não foram encontrados relatos da imobilização de biomoléculas em criogéis diretamente ativados com etilenodiamina. Diante do exposto, o objetivo nesse trabalho foi produzir e caracterizar um criogel supermacroporoso ativado com etilenodiamina visando à purificação de lectinas.
Material e métodos
REAGENTES Foram utilizados os monômeros Acrilamida (AAm), Bis-Acrilamida (BAAm) e alil-glicidil-éter (AGE) para produção dos criogéis. Os demais reagentes utilizados no experimento estão descritos ao longo da metodologia. Todos os reagentes utilizados possuíam, no mínimo, grau de pureza PA-ACS. SÍNTESE DOS CRIOGÉIS Os criogéis foram produzidos utilizando metodologia proposta por KUMAR et al. (2006). Resumidamente, uma solução aquosa contendo 6% de monômeros (AAm + AGE + BAAm), na proporção mássica de 4:1 (AAm+AGE):BAAm e 5:1 AAm:AGE foi preparada em banho de gelo. Foram adicionados então 1% APS e 1% de TEMED em relação à massa total de monômeros. Após a homogeneização, a solução foi vertida em seringas e mergulhada em banho termostático a -20,0°C por 24 h. Em seguida, as seringas foram colocadas à temperatura de 4°C por 4 h para descongelamento. Os criogéis foram secos em estufa a 60°C e pesados em balança analítica. Por fim, foram lavados com 150 ml de água destilada, e foram novamente secos e pesados, para verificar por diferença a quantidade de monômeros que não se polimerizou. Todas as soluções de lavagem e ativação foram circuladas pelos criogéis utilizando uma bomba peristáltica. FUNCIONALIZAÇÃO DOS CRIOGÉIS Primeiramente, os criogéis foram lavados com 30 mL de etanol puro, seguido de 30 mL de etanol + água destilada (1:1) e por fim 30 mL de água destilada. Os criogéis foram então lavados com 30 mL de tampão carbonato em pH 9,5, na concentração de 50 mM. Lavou-se então com 40 mL de etilenodiamina 0,5 M em tampão carbonato, em recirculação por 4,5 horas. Após essa etapa os criogéis foram lavadas com água até a solução de lavagem atingir pH neutro. Lavou-se então com 30 mL de tampão fosfato em pH 7,2, na concentração de 0,1 M. Em seguida, foi preparada uma solução de 4 mg.ml-1 de n-acetil-D- glicosamina no tampão fosfato, e recirculada nas colunas por 16 horas. Após esse tempo, a quantidade de carboidrato imobilizado foi quantificado por diferença na solução de n-acetil-D-glicosamina antes e após a recirculação, utilizando o método do DNS (MILLER, 1959). As colunas foram então lavadas com 40 mL de borohidreto de sódio 0,1 M em tampão carbonato, em recirculação por 3,5 horas. Lavou-se então com 100 mL de água destilada, seguido de 40 mL de etanolamina 0,1 M no tampão carbonato e novamente 40 mL de água destilada. Finalmente, os criogéis foram lavadas com 50 mL do tampão fosfato em pH 7,2 na concentração de 0,1 M. CARACTERIZAÇÃO DOS CRIOGÉIS Seis criogéis foram caracterizados em relação à capacidade de inchamento, grau de expansão, fração de macroporos e fração de polímero seco. Para a capacidade de inchamento e grau de expansão foram utilizadas metodologias propostas por SAVINA et al. (2005) e FONTAN (2013), respectivamente. Já as frações de macroporos e de polímero seco foram obtidas de acordo com PLIEVA et al. (2004).
Resultado e discussão
Os criogéis foram produzidos a partir da polimerização dos monômeros Aam, MBAAm
e AGE pela técnica conhecida como crio-geleificação. Durante a crio-
geleificação, os cristais de gelo em crescimento são os responsáveis pela
formação da estrutura macroporosa. A Aam é o principal monômero utilizado e é o
agente responsável pela linearidade da cadeia. O MBAAm, um composto com duas
moléculas de acrilamida com terminações não reativas nas extremidades, irá
promover a formação das ligações cruzadas necessárias para a formação do gel
(COOPER, 1977). O AGE é o monômero responsável por aumentar a resistência
estrutural do criogel e criar grupos epóxi na superfície (ARVIDSSON et al.,
2003), e são frequentemente utilizados por reagirem facilmente com grupos amina
(NH2), tiol (SH) ou hidroxila (OH) e formar uma ligação covalente bem estável
(MATEO et al., 2000; MATEO et al., 2003).
Os criogéis produzidos possuíram uma boa resistência estrutural,
apresentando características elásticas e esponjosas, conforme relatado na
literatura para outros tipos de criogéis (PERSSON et al., 2004; ARVIDSSON et
al., 2002), tendo facilidade em recuperar a forma original após os processos de
compressão ou secagem e hidratação.
ATIVAÇÃO E CARACTERIZAÇÃO DOS CRIOGÉIS
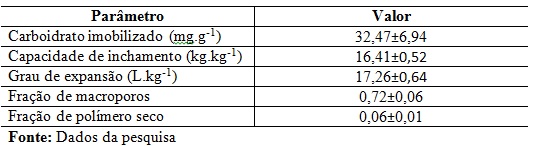
Os valores encontrados para a imobilização do carboidrato e as
características avaliadas dos criogéis são apresentados na Tabela 1.
A quantidade de carboidrato imobilizada foi de 32,47 mg de carboidrato por grama
de criogel seco, não tendo sido encontrados na literatura trabalhos sobre
criogéis envolvendo a imobilização de carboidratos utilizando tal técnica.
Comparado a outras técnicas de imobilização de carboidratos tal valor não foi
elevado (PERÇIN E AKSÖZ, 2012). No entanto, tal quantidade imobilizada
corresponde a cerca de 8,8x1019 moléculas do carboidrato por grama de
criogel seco, o que pode implicar em um grande número de sítios ativos no
adsorvente em questão.
A capacidade de inchamento encontrada foi de 16,41 kg.kg-1.
Isso significa que cada kg de criogel seco pode absorver cerca de 16,41 kg de
água. Tal valor está um pouco abaixo, mas encontra-se próximo ao obtido por
SAVINA et al. (2005), ao produzir um criogel apenas com os monômeros AAm e BAAm
em sua estrutura. É possível que a utilização do AGE, por aumentar a resistência
do criogel, tenha diminuído a capacidade de inchamento de tal monólito.
O grau de expansão fornece uma relação da massa do criogel em condições
de armazenamento e o seu volume quando em uso. O valor encontrado foi de 17,26
L.kg-1, o que comprova a natureza porosa da estrutura do criogel. O
valor obtido para o grau de expansão demonstrou que uma pequena massa de criogel
ocupa um grande volume quando hidratado, o que reforça a natureza porosa de sua
estrutura.
O valor encontrado para fração de macroporos foi de 72%, o que significa
que 72% da água de um criogel saturado se localiza nos macroporos. A fração de
polímero seco encontrada ao se hidratar os criogéis foi de 6%, o que demonstra a
elevada capacidade que o criogel tem de armazenar água.
Conclusões
Foi realizada a imobilização do n-acetil-D-glicosamina em um criogel supermacroporoso contendo 6% de monômeros. A imobilização foi realizada em um criogel amina-ativado e apresentou um valor de 32,47 mg de carboidrato por grama de criogel seco. Não foram encontrado relatos de imobilização de carboidratos na literatura utilizando tal técnica. Os criogéis foram caracterizados em relação a capacidade de inchamento, grau de expansão, fração de macroporos e fração de polímero seco. Os resultados encontrados reforçaram a natureza macroporosa apresentada pelos criogéis.
Agradecimentos
Referências
ARVIDSSON, P.; PLIEVA, F. M.; LOZINSKY, V. I.; GALAEV, I. Y.; MATTIASSON, B. Direct chromatographic capture of enzyme from crude homogenate using immobilized et al affinity chromatography on a continuous supermacroporous adsorbent. Journal of Chromatography A, v. 986, n. 2, p. 275-290, 2003.
ARVIDSSON, P.; PLIEVA, F. M.; SAVINA, I. N.; LOZINSKY, V. I.; FEXBY, S.; BÜLOW, L.; YU. GALAEV, I.; MATTIASSON, B. Chromatography of microbial cells using continuous supermacroporous affinity and ion-exchange columns. Journal of Chromatography A, v. 977, n. 1, p. 27-38, 2002.
COELHO, M. B.; MARANGONI, S.; MACEDO, M. L. R. Comparative Biochemistry and Physiology Part C. Toxicology & Pharmacology, v.146, p.406-414, 2007.
COOPER, T. G. The Tools of Biochemistry, Wiley (New York) 423p, 1977.
FONTAN, R. C. I. Desenvolvimento e caracterização de trocador catiônico supermacroporoso para a purificação de macromoléculas. 2013. 147 p. Tese (Doutorado em Ciência e Tecnologia de Alimentos). Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa, Viçosa-MG.
HAHN, R.; PANZER, M.; HANSEN, E.; MOLLERUP, J.; JUNGBAUER, A.. Mass transfer properties of monoliths. Separation Science and Technology, v.37, n.7, p.1545-1565, 2002.
KHAN, S.; LINDAHL, S.; TURNER, C.; KARLSSON, E. N. Immobilization of thermostable β-glucosidase variants on acrylic supports for biocatalytic processes in hot water. Journal of Molecular Catalysis B: Enzymatic, v. 80, n. 0, p. 28-38, 2012.
KILIKIAN, B. V. Purificação de produtos biotecnológicos. Ed. Manole – Barueri, SP. 2005.
KIM, H. S.; HAGE, D. S. Handbook of Affinity Chromatography. Boca Raton: CRC Press, 2005.
KUMAR, A.; BANSAL, V.; ANDERSSON, J.; ROYCHOUDHURY, P. K.; MATTIASSON, B. Supermacroporous cryogel matrix for integrated protein isolation. immobilized metal affinity chromatographic purification of urokinase from cell broth of a human kidney cell line. Journal of Chromatography A, v.1103, n.1, p.35-42, 2006.
MALLIK, R.; HAGE, D. S. Affinity monolith chromatography. Journal of Separation Science, v. 29, n. 12, p. 1686-1704, 2006.
MATEO, C.; ABIAN, O.; FERNANDEZ–LAFUENTE, R.; GUISAN, J. M. Increase in conformational stability of enzymes immobilized on epoxy-activated supports by favoring additional multipoint covalent attachment. Enzyme and Microbial Technology, v. 26, n. 7, p. 509-515, 2000.
MATEO, C.; TORRES, R.; FERNÁNDEZ-LORENTE, G.; ORTIZ, C.; FUENTES, M.; HIDALGO, A.; LÓPEZ-GALLEGO, F.; ABIAN, O.; PALOMO, J. M.; BETANCOR, L.; PESSELA, B. C. C.; GUISAN, J. M.; FERNÁNDEZ-LAFUENTE, R. EpoxyAmino Groups: A New Tool for Improved Immobilization of Proteins by the Epoxy Method. Biomacromolecules, v. 4, n. 3, p. 772-777, 2003.
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, v.31, n.3, p.426-428, 1959.
NG, T. B.; AU, T. K.; LAM, T. L.; YE, X. Y.; WAN, D. C. C. Inhibitory effects of antifungal proteins on human immunodeficiency vírus type 1 reverse transcriptase, protease and integrasse. Life Sciences, v.70, n. 8, p. 927-935, 2002.
PANDEY, G., FATMA, T., COWSIK, S.M.; KOMATH, S.S. Specific interaction of jacalin with phycocyanin, a fluorescent phycobiliprotein. Journal of Photochemistry and Photobiology, v.97, n. 2, p.87-93, 2009.
PERSSON, P.; BAYBAK, O.; PLIEVA, F.; GALAEV, I. Y.; MATTIASSON, B.; NILSSON, B.; AXELSSON, A. Characterization of a continuous supermacroporous monolithic matrix for chromatographic separation of large bioparticles. Biotechnology and Bioengineering, v. 88, n. 2, p. 224-236, 2004.
PETROSSIAN, K.; BANNER, L. R.; OPPENHEIMER, S. B. Lectin bindiing and effects in culture on human cancer and non-cancer cell lines: Examination of issues of interest in drug design strategies. Acta Histochemica, v.109, n.6, p.491-500, 2007.
PLIEVA, F. M.; ANDERSSON, J.; GALAEV, I. Y.; MATTIASSON, B. Characterization of polyacrylamide based monolithic columns. Journal of Separation Science, v.27, n.10-11, p.828-836, 2004.
PODGORNIK, A.; BARUT, M.; STRANCAR, A.; JOSIC, D.; KOLOINI, T. Construction of Large-Volume Monolithic Columns. Analytical Chemistry, v.72, n.22, p.5693-5699, 2000.
RAHAIE, M.; KAZEMI, S. S. Lectin-based biosensor: As powerful toods in bioanalytical applications. Biotechnology, v.9, n.4, p.428-443, 2010.
SANTI-GADELHA, T.; GADELHA, C. A. A.; ARAGÃO, K. S.; OLIVEIRA, C. C. et al. Purification and biological effects of Araucaria angustifólia (Araucariaceae) seed lectin. Biochemical and Biophysical Research Communications, v.350, n.4, p.1050-1055, 2006.
SAVINA, I.; MATTIASSON, B.; GALAEV, I. Y. Graft polymerization of acrylic acid onto macroporous polyacrylamide gel (cryogel) initiated by potassium diperiodatocuprate. Polymer, v.46, n.23, p.9596-9603, 2005.
SITOHY, M.; DOHEIM, M.; BADR, H. Isolation and characterization of a lectin with antifungal activity from Egyptian Psum sativum seed. Food Chemistry, v. 104, n.3, p.971-979, 2007.
STICKEL, J. J.; FOTOPOULOS, A. Pressure-Flow Relationships for Packed Beds of Compressible Chromatography Media at Laboratory and Production Scale. Biotechnology Progress, v.17, n.4, p.744-751, 2001.
TÜZMEN, N.; KALBURCU, T.; DENIZLI, A. Immobilization of catalase via adsorption onto metal-chelated affinity cryogels. Process Biochemistry, v. 47, n. 1, p. 26-33, 2012. TYAGI, R.; AGARWAL, R.; GUPTA, M. N. Purification of peanut lectin using guar gum as an affinity ligand. Journal of Biotechnology, v.46, n.2, p.79-83, 1996.
UYGUN, M.; UYGUN, D. A.; ÖZçALıŞKAN, E.; AKGÖL, S.; DENIZLI, A. Concanavalin A immobilized poly(ethylene glycol dimethacrylate) based affinity cryogel matrix and usability of invertase immobilization. Journal of Chromatography B, v. 887–888, n. 0, p. 73-78, 2012.