ISBN 978-85-85905-15-6
Área
Química Tecnológica
Autores
Gonçalves, G.R.F. (UESB) ; Gandolfi, O.R.R. (UESB) ; Santos, C.M.S. (UESB) ; Bonomo, R.C.F. (UESB) ; Veloso, C.M. (UESB) ; Santos, L.S. (UESB) ; Fontan, R.C.I. (UESB)
Resumo
Objetivou-se neste trabalho produzir e caracterizar um criogel supermacroporoso ativado com glutaraldeído visando à purificação de lectinas. Para isso uma solução contendo o carboidrato modificado n-acetil-D-glicosamina foi recirculada entre os criogéis ativados. O criogel produzido apresentou uma imobilização de 147,77 miligramas de carboidrato por grama de criogel seco, apresentando boa capacidade de imobilização. Em seguida, os criogéis foram caracterizados, e as análises realizadas indicaram elevada capacidade que os criogéis possuem de armazenar água em sua estrutura, além de uma elevada fração de macroporos. Mais estudos são necessários, mas a produção de tais matrizes é promissora, com potencial para serem utilizados em processos de purificação de lectinas.
Palavras chaves
SEPARAÇÃO; MONÓLITOS; BIOMOLÉCULAS
Introdução
As lectinas são uma classe estruturalmente diversa de proteínas, que possuem habilidade de se ligar a carboidratos com considerável especificidade (SHARON, 1993). São proteínas ligantes de origem não imunológica e oligomérica, ou seja, constituídas de monômeros arranjados tridimensionalmente, formando dímeros, tetrâmeros ou heterodímeros. Podem ser monovalentes (um sítio glicídico por monômero) ou polivalentes (mais de um sítio glicídico por monômero). Devido às propriedades ligantes, essas biomoléculas possuem diversas atividades biológicas, tais como a habilidade de aglutinar eritrócitos, linfócitos, fibroblastos, espermatozoides, fungos, bactérias e células vegetais (SINGH et al., 1999). Diversas técnicas comuns na purificação de proteínas podem ser utilizados para a purificação de lectinas. Algumas técnicas comumente utilizadas são cromatografia de troca iônica (SANTI-GADELHA et al., 2006), cromatografia de filtração em gel (MOURA et al., 2006), precipitação com sulfato de amônio (COELHO E SILVA, 2000), entre outras. Porém, devido a habilidade das lectinas em se ligar a carboidratos e outras glicoproteínas, a técnica mais utilizada na purificação deste grupo de proteínas é a cromatografia de afinidade (TYAGI et al., 1996; OLIVEIRA et al., 2002; ROY et al., 2005). Tal princípio vem sendo amplamente explorado, sendo estudada a interação com goma guar (TYAGI et al., 1996), derivados de galactose (OLIVEIRA et al. 2002), manose (OURTH E ROSE, 2011) e proteínas (JUNG et al., 2003), dentre outros. Os leitos fixos cromatográficos tradicionais apresentam uma alta capacidade de saturação, devido à elevada área superficial das partículas adsorventes. Entretanto, a presença de grandes biomoléculas ou meios altamente concentrados desafiam sua capacidade e produtividade. Além disso, a ampliação de escalas em leitos empacotados contendo adsorventes pouco resistentes é muito limitada, devido a fatores mecânicos e instabilidade do leito (STICKEL e FOTOPOULOS, 2001). Esses problemas, em especial os problemas de transferência de massa levaram ao desenvolvimento de monólitos macroporosos para purificação de macromoléculas. As colunas monolíticas poliméricas, também denominadas de materiais cromatográficos de quarta geração, são consideradas o que há de mais moderno no setor de matrizes cromatográficas. Devido à estrutura de macroporos interconectados de grandes dimensões, o fluxo através dos poros é puramente convectivo e a resistência à transferência de massa é baixa (HAHN et al., 2002; PODGORNIK et al., 2000; GUIOCHON, 2007). Entre os possíveis polímeros empregado na síntese desses compostos destaca-se os monólitos macroporosos de poliacrilamida, obtidos da polimerização de moléculas de acrilamida (Aam) com o agente formador de ligações cruzadas N, N’-metileno-bis-acrilamida (BAam) adicionados ou não de outros monômeros (como o alil-glicidil éter, AGE), sob condições de congelamento moderado (-10 °C a -20 °C), pela técnica conhecida como criogeleificação (PLIEVA et al., 2004b). Os monólitos assim sintetizados são chamados de criogéis pAam, e sua utilização vem sendo reportada por diversos autores (DRAGAN et al., 2012; PLIEVA et al., 2004a; YAO et al., 2007). Modificações podem ser realizadas na estrutura dos criogéis visando aumentar sua capacidade de purificação. Para propósitos de purificação de lectinas uma alternativa potencial é a imobilização de carboidratos modificados (contendo grupamento amina) na superfície dos criogéis, dada a sua habilidade em se ligar a tais compostos. Diversos métodos de ativação da superfície dos criogéis seguido da imobilização de biomoléculas têm sido relatados (MALLIK; HAGE, 2006; KHAN et al., 2012; TÜZMEN; KALBURCU; DENIZLI, 2012; UYGUN et al., 2012). Uma das técnicas que pode ser utilizada para imobilização de carboidratos modificados na superfície dos criogéis é o método do glutaraldeído. Nessa técnica há um maior espaçamento entre o agente imobilizado e a superfície monólito, o que acaba evitando efeitos de impedimento estérico (LUO et al., 2012), podendo aumentar a capacidade de ligação dos biocompostos a serem imobilizados e até mesmo a capacidade de purificação da coluna. Diante do exposto, o objetivo nesse trabalho é a produção e caracterização de um criogel supermacroporoso ativado com glutaraldeído, visando à purificação de lectinas.
Material e métodos
REAGENTES Os reagentes utilizados no experimento estão descritos ao longo da metodologia. Todos os reagentes utilizados possuíam, no mínimo, grau de pureza PA-ACS. SÍNTESE DOS CRIOGÉIS Para síntese dos criogéis, foi adaptada metodologia proposta por KUMAR et al. (2006). Resumidamente, uma solução aquosa contendo 6% de monômeros (AAm + AGE + BAAm), na proporção mássica de 4:1 (AAm+AGE):BAAm e 5:1 AAm:AGE foi preparada em banho de gelo. Foram adicionados então 1% APS e 1% de TEMED em relação a massa total de monômeros. A solução foi vertida em seringas e mergulhada em banho termostático a -20,0°C por 24 h. Em seguida, as seringas foram colocadas a temperatura de 4°C por 4 h para descongelamento. Os criogéis foram secos em estufa a 60°C e pesados em balança analítica. Por fim, foram lavados com 150 ml de água destilada, e foram novamente secos e pesados, para verificar por diferença a quantidade de monômeros que não se polimerizou. As soluções de lavagem e ativação foram percoladas através da coluna utilizando bomba peristáltica. FUNCIONALIZAÇÃO DOS CRIOGÉIS Para a imobilização do n-acetil-D-galactosamina utilizando o método do glutaradeído foram utilizadas metodologias adaptadas propostas por KUMAR et al. (2003) e PETRO et al. (1996). Primeiramente, os criogéis foram lavados com 30 mL de etanol puro, seguido de 30 mL de etanol + água destilada (1:1) e por fim 30 mL de água destilada. Os criogéis foram então lavados com 30 mL de tampão carbonato 50 mM (pH 9,5). Lavou-se então com 40 mL de etilenodiamina 0,5 M em tampão carbonato, em recirculação por 4,5 horas. Após, os criogéis foram lavados com água até atingir pH neutro, seguido de 30 mL de tampão fosfato 0,1 M em pH 7,2. Posteriormente, foram lavados com 40 mL de uma solução de glutaraldeído 5% m/v em tampão fosfato, em recirculação por 4,5 horas. Em seguida, foi preparada uma solução de 4 mg.ml-1 de n-acetil-D-glicosamina no tampão fosfato, e recirculada nas colunas por 16 horas. Após esse tempo, a quantidade de carboidrato imobilizado foi quantificado por diferença na solução de n-acetil-D- glicosamina antes e após a recirculação, segundo MILLER (1959). As colunas foram lavadas com 40 mL de borohidreto de sódio 0,1 M em tampão carbonato, em recirculação por 3,5 horas. Lavou-se então com 100 mL de água destilada, seguido de 40 mL de etanolamina 0,1 M no tampão carbonato e novamente 40 mL de água destilada. Finalmente, os criogéis foram lavadas com 50 mL do tampão fosfato 0,1 M (pH 7,2). CARACTERIZAÇÃO DOS CRIOGÉIS Seis criogéis foram caracterizados em relação à capacidade de inchamento, grau de expansão, fração de macroporos e fração de polímero seco. Para a capacidade de inchamento e grau de expansão foram utilizadas metodologias propostas por SAVINA et al. (2005) e FONTAN (2013), respectivamente. Já as frações de macroporos e de polímero seco foram obtidas de acordo com PLIEVA et al. (2004).
Resultado e discussão
O criogel monolítico supermacroporoso foi produzido pela crio-
copolimerização (polimerização em temperaturas de congelamento) dos monômeros
AAm (principal monômero da estrutura), MBAAm e AGE. A utilização da MBAAm é
fundamental para promover o enlace das cadeias de Aam formando as ligações
cruzadas necessárias para a formação da cadeia polimérica (COOPER, 1977). Já a
utilização do AGE provoca um aumento na resistência estrutural do criogel, além
de promover a formação de grupos epóxi na superfície dos criogéis (criogel
epóxi-ativado) (ARVIDSSON et al., 2003), que são de fundamental importância na
imobilização de carboidratos modificados utilizando o método do glutaraldeído,
como será explicado posteriormente. O APS e o TEMED funcionam como agente
iniciador e acelerador da reação de polimerização, respectivamente.
Os criogéis produzidos apresentaram estruturas consistentes,
cilíndricas, esponjosas quando umedecidas, lisas e porosas, conforme relatado
por diversos autores (PERSSON et al., 2004; ARVIDSSON et al., 2002; YAO et al.,
2006a). Ao serem retirados das colunas, os criogéis puderam ser espremidos,
removendo o excesso de água livre no interior dos poros, sem ter a sua estrutura
danificada. Após serem mergulhados em água, os criogéis facilmente voltaram à
sua forma original. O mesmo ocorreu após os processos de secagem e reidratação
de tal monólito.
IMOBILIZAÇÃO DOS CARBOIDRATOS PELO MÉTODO DO GLUTARALDEÍDO
A ativação de criogéis com glutaraldeído apresenta-se como uma
alternativa potencial para a imobilização de moléculas em sua estrutura.
Diversos trabalhos de imobilização de enzimas e proteínas utilizando tal método
são facilmente encontrados na literatura (PETRO et al., 1996; LUO et al.,2002),
porém não foram encontrados trabalhos para imobilização de carboidratos
utilizando tal técnica. Para que essa imobilização torne-se possível, os
carboidratos a serem imobilizados devem ser aminados, ou seja, possuírem o
grupamento amina na estrutura, o mesmo encontrado nas enzimas e proteínas.
Nessa técnica, o criogel epóxi-ativado é convertido à forma amina-
ativada pela reação dos grupos epóxi com etilenodiamina. O criogel amina-ativado
reage com o glutaraldeído, formando um criogel aldeído-ativado, capaz de ligar-
se aos grupamentos aminas, formando uma base de Schiff (MALLIK e HAGE, 2006).
Como descrito anteriormente, a quantidade de carboidrato modificado n-
acetil-D-glicosamina que ficou imobilizado na superfície do criogel ativado com
glutaraldeído foi obtida por diferença a partir da solução de carboidrato antes
e após a recirculação. A quantidade imobilizada encontrada nesse experimento foi
de 147,77 mg de carboidrato por g de criogel seco, correspondendo a uma elevada
quantidade de carboidrato imobilizado. Tal valor pode ser explicado
primeiramente pelo fato de o criogel produzido possuir uma grande quantidade de
grupos epóxi reativos e também pelo fato de ao se utilizar a ativação com
glutaraldeído ocorrer a formação de braços espaçadores entre a superfície e a
molécula imobilizada, evitando efeitos de impedimento estérico, e
consequentemente aumentando a capacidade de imobilização de biomoléculas (LUO et
al., 2012).
CARACTERIZAÇÃO DOS CRIOGÉIS
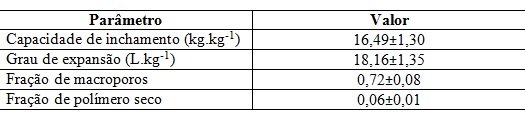
A Tabela 1 mostra os valores de capacidade de inchamento, grau de
expansão, fração de polímero seco e fração de macroporos após utilizar-se o
método do glutaraldeído para imobilização do carboidrato modificado.
A avaliação da capacidade de inchamento é uma medida da expansão da matriz do
criogel, e quanto maior o seu valor, mais maleáveis são as matrizes após o
inchamento e provavelmente menores pressões elas suportam (CARVALHO, 2010). O
valor encontrado nesse trabalho foi de aproximadamente 16,5 quilogramas de água
para cada quilograma de criogel desidratado, estando próximo ao encontrado por
SAVINA et al. (2005), ao produzir criogéis supermacroporosos sem grupos
funcionais imobilizados, contendo 6% de monômeros.
Outra medida útil para avaliação da expansão do criogel é o grau de
expansão. Tal parâmetro possui grande importância, pois fornece uma relação
entre a massa do criogel seco (em condição de armazenamento) e o volume que o
mesmo ocupa em condições operacionais. O valor obtido para o grau de expansão
demonstrou que uma pequena massa de criogel ocupa um grande volume quando
hidratado, o que reforça a natureza porosa de sua estrutura.
O valor encontrado para fração de macroporos foi de 72%. Tal valor está
dentro da faixa de 70% a 85% encontrado em diversos trabalhos sobre criogéis
(YAO et al., 2006a, 2006b e 2007). A fração de polímero seco encontrada ao se
hidratar os criogéis foi de 6%, o que demonstra a elevada capacidade que o
criogel tem de armazenar água em sua estrutura.
Fonte: Dados da pesquisa.
Conclusões
Foi realizada a ativação do criogel supermacroporoso contendo 6% de monômeros utilizando o método do glutaraldeído para verificar a capacidade de ligação do criogel. A quantidade de n-acetil-D-glicosamina encontrada foi de 147,77 mg de carboidrato por g de criogel seco, correspondendo a uma elevada quantidade de carboidrato imobilizado. Foi realizado análises para verificar a capacidade de inchamento e o grau de expansão dos criogéis, com os valores obtidos comprovando a elevada capacidade de absorção que os criogéis possuem em armazenar água em sua estrutura. Foi calculado também o valor da fração de macroporos, o que comprovou a natureza macroporosa da superfície dos criogéis. Mais estudos são necessários, mas a produção e utilização dessas matrizes são promissoras para serem utilizadas em processos de purificação de macromoléculas.
Agradecimentos
Referências
ARVIDSSON, P.; PLIEVA, F. M.; LOZINSKY, V. I.; GALAEV, I. Y.; MATTIASSON, B. Direct chromatographic capture of enzyme from crude homogenate using immobilized et al affinity chromatography on a continuous supermacroporous adsorbent. Journal of Chromatography A, v. 986, n. 2, p. 275-290, 2003.
ARVIDSSON, P.; PLIEVA, F. M.; SAVINA, I. N.; LOZINSKY, V. I.; FEXBY, S.; BÜLOW, L.; YU. GALAEV, I.; MATTIASSON, B. Chromatography of microbial cells using continuous supermacroporous affinity and ion-exchange columns. Journal of Chromatography A, v. 977, n. 1, p. 27-38, 2002.
COELHO, L. C. B. B.; SILVA, M. B. R. Simple method to purify milligram quantities of the galactose-specific lectin from the leaves of Bauhinia monandra. Phytochemical Analysis v. 11, p. 295-300, 2000.
COOPER, T. G. The Tools of Biochemistry, Wiley (New York) 423p, 1977.
DRAGAN, E. S.; LAZAR, M. M.; DINU, M. V.; DOROFTEI, F. Macroporous composite IPN hydrogels based on poly(acrylamide) and chitosan with tuned swelling and sorption of cationic dyes. Chemical Engineering Journal, v.204-206, n.15, p.198-209, 2012.
FONTAN, R. D. C. I. Desenvolvimento e caracterização de trocador catiônico supermacroporoso para a purificação de macromoléculas. 2013. 147 p. Tese (Doutorado em Ciência e Tecnologia de Alimentos). Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa, Viçosa-MG.
GUIOCHON, G. Monolithic columns in high-performance liquid chromatography. Journal of Chromatography A, v.1168, n.1-2, p.101-168, 2007.
HAHN, R.; PANZER, M.; HANSEN, E.; MOLLERUP, J.; JUNGBAUER, A.. Mass transfer properties of monoliths. Separation Science and Technology, v.37, n.7, p.1545-1565, 2002.
JUNG, W.-K.; PARK, P.-J.; KIM, S.-K. Purification and characterization of a new lectin from the hard roe of skipjack tuna, Katsuwonus pelamis. The International Journal of Biochemistry & Cell Biology, v.35, n.2, p.255-265, 2003.
KHAN, S.; LINDAHL, S.; TURNER, C.; KARLSSON, E. N. Immobilization of thermostable β-glucosidase variants on acrylic supports for biocatalytic processes in hot water. Journal of Molecular Catalysis B: Enzymatic, v. 80, n. 0, p. 28-38, 2012.
KUMAR, A.; PLIEVA, F. M.; GALAEV, I. Y.; MATTIASSON, B. Affinity fractionation of lymphocytes using a monolithic cryogel. Journal of Immunological Methods, v. 283, n. 1–2, p. 185-194, 2003.
KUMAR, A.; BANSAL, V.; ANDERSSON, J.; ROYCHOUDHURY, P. K.; MATTIASSON, B. Supermacroporous cryogel matrix for integrated protein isolation. immobilized metal affinity chromatographic purification of urokinase from cell broth of a human kidney cell line. Journal of Chromatography A, v.1103, n.1, p.35-42, 2006.
LUO, Q.; ZOU, H.; ZHANG, Q.; XIAO, X.; NI, J. High-performance affinity chromatography with immobilization of protein A and L-histidine on molded monolith. Biotechnology and Bioengineering, v. 80, n. 5, p. 481-489, 2002.
MALLIK, R.; HAGE, D. S. Affinity monolith chromatography. Journal of Separation Science, v. 29, n. 12, p. 1686-1704, 2006.
MILLER, G. L. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry, v.31, n.3, p.426-428, 1959.
MOURA, R. M. et al. CvL, a lectin from the marine sponge Cliona varians: Isolation, characterization and its effects on pathogenic bacteria and Leishmania promastigotes. Comparative Biochemistry and Physiology A, v. 145, n. 4, p. 517-523, 2006.
OLIVEIRA, J. T. A.; MELO, V. M. M.; CÂMARA, M. F. L.; VASCONCELOS, I. M.; BELTRAMINI, L. M. et al. Purification and physicochemical characterization of a cotyledonary lectin from Luetzelburgia auriculata. Phytochemistry, v.61, n.3, p.301-310, 2002.
OURTH, D. D.; ROSE, W. W. Purification, characterization and seasonal variation of mannose-binding C-type lectin in Ictalurid catfish. Aquaculture, v.321, n.3-4, p.191-196, 2011.
PERSSON, P.; BAYBAK, O.; PLIEVA, F.; GALAEV, I. Y.; MATTIASSON, B.; NILSSON, B.; AXELSSON, A. Characterization of a continuous supermacroporous monolithic matrix for chromatographic separation of large bioparticles. Biotechnology and Bioengineering, v. 88, n. 2, p. 224-236, 2004.
PETRO, M.; RÉCHET, J. M. J. Immobilization of trypsin onto “molded” macroporous poly(glycidyl methacrylate-co-ethylene dimethacrylate) rods and use of the conjugates as bioreactors and for affinity chromatography. Biotechnology and Bioengineering, v. 49, n. 4, p. 355-363, 1996.
PLIEVA, F. M.; ANDERSSON, J.; GALAEV, I. Y.; MATTIASSON, B. Characterization of polyacrylamide based monolithic columns. Journal of Separation Science, v.27, n.10-11, p.828-836, 2004
PODGORNIK, A.; BARUT, M.; STRANCAR, A.; JOSIC, D.; KOLOINI, T. Construction of Large-Volume Monolithic Columns. Analytical Chemistry, v.72, n.22, p.5693-5699, 2000.
ROY, I.; SARDAR, M.; GUPTA, M. N. Cross-linked alginate–guar gum beads as fluidized bed affinity media for purification of jacalin. Biochemical Engineering Journal, v.23, n.3, p.193-198, 2005.
SAVINA, I.; MATTIASSON, B.; GALAEV, I. Y. Graft polymerization of acrylic acid onto macroporous polyacrylamide gel (cryogel) initiated by potassium diperiodatocuprate. Polymer, v.46, n.23, p.9596-9603, 2005.
SHARON, N. Lectin-carbohydrate complexes of plants and animals: an atomic view. Trends Biochemical Science, v. 18, n. 6, p. 221-226, 1993.
SINGH, R. S.; TIWARY A. K.; KENNEDY, J. F. Lectins: Sources, Activities and Aplications. Critical Reviews in Biotechnology, v. 19, n. 2, p. 145-178, 1999.
STICKEL, J. J.; FOTOPOULOS, A. Pressure-Flow Relationships for Packed Beds of Compressible Chromatography Media at Laboratory and Production Scale. Biotechnology Progress, v.17, n.4, p.744-751, 2001.
TÜZMEN, N.; KALBURCU, T.; DENIZLI, A. Immobilization of catalase via adsorption onto metal-chelated affinity cryogels. Process Biochemistry, v. 47, n. 1, p. 26-33, 2012. TYAGI, R.; AGARWAL, R.; GUPTA, M. N. Purification of peanut lectin using guar gum as an affinity ligand. Journal of Biotechnology, v.46, n.2, p.79-83, 1996.
UYGUN, M.; UYGUN, D. A.; ÖZçALıŞKAN, E.; AKGÖL, S.; DENIZLI, A. Concanavalin A immobilized poly(ethylene glycol dimethacrylate) based affinity cryogel matrix and usability of invertase immobilization. Journal of Chromatography B, v. 887–888, n. 0, p. 73-78, 2012.
YAO, K.; SHEN, S.; JUNXIANYUN; WANG, L.; HE, X.; YU, X. Preparation of polyacrylamide-based supermacroporous monolithic cryogel beds under freezing-temperature variation conditions. Chemical Engineering Science, v. 61, n. 20, p. 6701-6708, 2006a.
YAO, K.; YUN, J.; SHEN, S.; WANG, L.; HE, X.; YU, X. Characterization of a novel continuous supermacroporous monolithic cryogel embedded with nanoparticles for protein chromatography. Journal of Chromatography A, v. 1109, n. 1, p. 103-110, 2006b.
YAO, K.; YUN, J.; SHEN, S.; CHEN, F. In-situ graft-polymerization preparation of cation-exchange supermacroporous cryogel with sulfo groups in glass columns. Journal of Chromatography A, v.1157, n.1-2, p.246-251, 2007.