ISBN 978-85-85905-19-4
Área
Química Orgânica
Autores
de Oliveira, C.H.C.S. (UFRRJ) ; Chaves, O.A. (UFRRJ) ; Ferreira, R.C. (UFRRJ) ; de Barros, L.S. (UFRRJ) ; Ferreira, S.B. (UFRJ) ; de Sant'anna, C.M.R. (UFRRJ) ; Ferreira, A.B.B. (UFRRJ) ; Cesarin-sobrinho, D. (UFRRJ) ; da Silva, F.A. (UFRRJ) ; Netto-ferreira, J.C. (UFRRJ)
Resumo
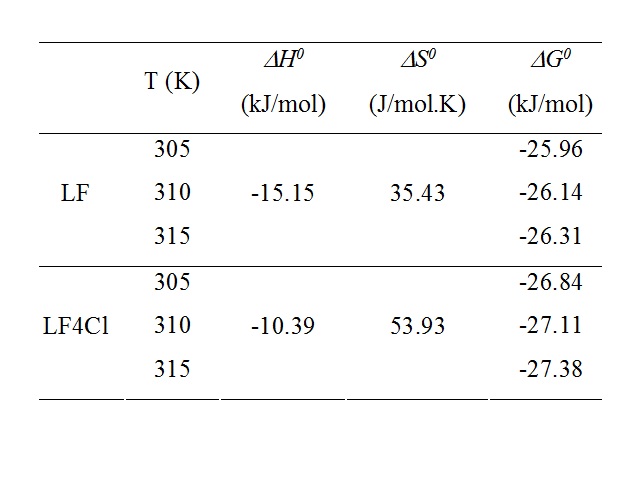
Estudos da interação entre derivados furânicos de 1,2-naftoquinonas (LF e LF4Cl) e Albumina Sérica Humana (ASH) foram realizados por técnicas espectroscópicas (fluorescência, dicroísmo circular) e método computacional (ancoramento molecular). Valores da constante de velocidade de supressão (kq) e constante de ligação (Ka), indicam associação LF:ASH e LF4Cl:ASH no estado fundamental e tal associação é forte, sendo que os resultados de dicroísmo circular demonstram que não há perturbação significativa na estrutura proteica. Parâmetros termodinâmicos (ΔG°<0, ΔH°<0 e ΔS°>0)indicam espontaneidade no processo de ligação, sugerindo interação hidrofóbica como a principal força de associação. Em contrapartida estudos por ancoramento molecular sugerem que também há presença de ligação de hidrogênio
Palavras chaves
Espectroscopia; 1,2-Naftoquinonas; Albumina Sérica Humana
Introdução
As albuminas séricas (ASs) encontram-se em grande abundância no plasma sanguíneo (aproximadamente 60% da proteína total) [Stan et al. 2009], e possui diversas funções fisiológicas, como sua capacidade de transporte, distribuição e metabolização de inúmeros ligantes endógenos e exógenos, como por exemplo, compostos bioativos, metabólitos, ácidos graxos, aminoácidos, hormônios, etc [Stan et al., 2009; Li et al., 2009 e Takehara et al., 2009]. A albumina sérica humana (ASH) é um polipeptídio simples e não-glicosilado [Li et al., 2009] com aproximadamente 67% de hélice-α [Stan et al., 2009]. A estrutura da ASH apresenta três domínios compostos de estrutura do tipo hélice-α (I, II e III) [Yue et al., 2008]. Análises cristalográficas da estrutura revelam que os sítios de ligação com os compostos bioativos estão localizados nos subdomínios IIA, uma grande cavidade hidrofóbica que possui um resíduo de triptofano [Li et al., 2009]. Naftoquinonas são uma importante classe de quinonas naturais ou sintéticas com uma grande diversidade de atividades farmacológicas [Ferreira et al., 2010]. Seu mecanismo de ação está relacionado à parte quinoidal da molécula, que atua como agente redutor responsável pelo transporte de elétrons. Neste trabalho, o efeito do substituinte na interação das 1,2-naftoquinonas 2-fenil-2,3-diidronafto[1,2-b]furano-4,5-diona e 2-(4-clorofenil)-2,3- diidronafto[1,2-b]furano-4,5-diona com albumina plasmática foi investigado através de técnicas espectroscópicas e computacional. Estas moléculas apresentaram promissoras atividades antifúngicas e anticânceres [Freire et al., 2010; e Ferreira et al., 2013].
Material e métodos
Materiais: LF e LF4Cl utilizadas neste estudo foram gentilmente cedido pelo Dr. Victor F. Ferreira e Dr. Sabrina Baptista Ferreira. Albumina de sérica humana (ASH) e saches de PBS , da Aldrich. Espectrofotômetro Jasco J-815 com sistema termostatizado Jasco PFD-425S15F (UV-visível, fluorescência e dicroísmo circular). Métodos: Foram obtidos de uma solução de 3 mL de ASH (10,0 μmol/L de concentração) em PBS (pH = 7,4) espectros de emissão para a intensidade de fluorescência inicial (F0) de ASH. Em seguida, foram realizadas adições de alíquotas sucessivas dos derivados de 1,2-naftoquinona substituídos (LF, LF4Cl e LF4Me) com uma concentração de aproximadamente 1,00 mmol/L. Condições: comprimento de onda de excitação (λexc = 280 nm); espectro de emissão de fluorescência (290 nm a 450 nm) e temperaturas: 305 K, 310 K e 315 K. Foram calculados através das equações de Stern-Volmer e Stern-Volmer modificada as constantes de associação. A partir destas constantes de associação foram obtidos os parâmetros termodinâmicos ΔG°, ΔH° e ΔS° através da equação de van't Hoff. [Lakowicz, 2006]. Para o dicroísmo circular (CD), analisa-se uma alíquota de 3 ml de uma solução de ASH 1,0 μmol/L em PBS (pH = 7,4). A essa solução foram adicionadas alíquotas de 12 μL, 24 μL, 48 μL e 96 μLde uma solução 1,00 mmol/L dos derivados de 1,2-naftoquinona (LF e LF4Cl). Para a modelagem, as estruturas LF e LF4Cl foram construídas e energia minimizada com o método semi-empírico PM6 [Stewart, 2007] disponível no programa Spartan'14 (Wavefunction, Inc.). O Docking foi realizado com o programa GOLD 5,2 (CCDC) [Jones et al. 1997] e foi estabelecido um raio de 10 Å do resíduo de Trp-214 na cavidade selecionada da albumina para o encaixe.
Resultado e discussão
Os valores de kq > 10 Lmol indicam que o
mecanismo mais
provável para o processo de supressão seja estático.
Os elevados valores de Ka e Kb sugerem a formação de complexos
relativamente estáveis. A leve curvatura ascendente observada nos
gráficos de Stern-Volmer, sugerem a participação de um mecanismo
baseado na esfera efetiva de supressão.
Os valores de Ho<0 indicam que a interação apresenta caráter
hidrofóbico, e os valores de So>0 sugerem uma participação favorável
desse parâmetro no processo de interação.
Os valores negativos para a energia livre de Gibbis indicam que em
todos os casos estudados os processos de interação são espontâneos e
a sua grandeza ( Go ~ -25kJmol-1) indicam que o processo é
reversível.
• Os valores obtidos nos estudos por espectroscopia de dicroísmo
circular para a interação entre 1,2-naftoquinonas com ASH nas
temperaturas de 305 K, 310 K e 315 K, mostraram que ocorreu uma
diminuição da % de hélice- da estrutura secundária da proteína
(ASH), como consequência apenas do aumento da concentração e
independente da variação da temperatura.
Os resultados de modelagem molecular, sugerem que a LF e LF4Cl interagem
através de t-Stacking com resíduo de Trp-214 e via ligação de hidrogênio com
resíduos de aminoácidos diferentes, como: Lys-198, Ser-201 e Arg-221.
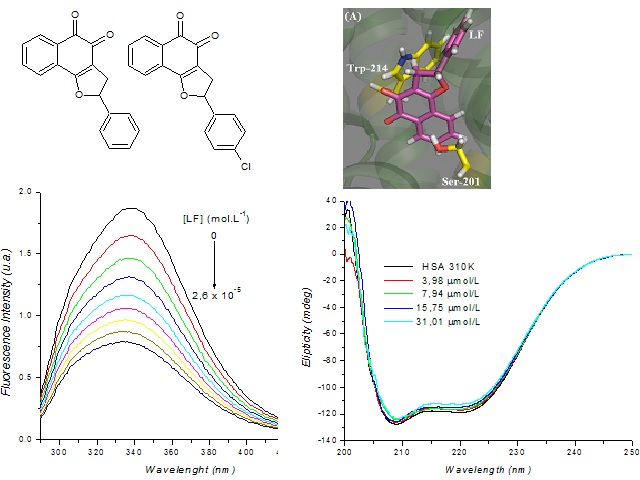
a) LF e LF4Cl; b) Docking de LF em ASH; c) Supressão de fluorescência de ASH por LF; d) Dicroísmo circular (DC) de ASH.
Conclusões
Os resultados encontrados sugerem que a albumina sérica humana pode ser um bom carreador dos compostos analisados. Independentemente dos grupos substituintes e sua posição na estrutura dos derivados furânicos da 1,2-naftoquinona, os parâmetros estruturais e eletrônicos são todos favoráveis tanto do ponto de vista entrópico quanto entálpico.
Agradecimentos
UFRRJ, CAPES, CNPQ E FAPERJ.
Referências
FERREIRA, S. B.; DA SILVA, F. C.; BEZERRA, F. A. F. M.; LOURENÇO, M. C. S.; KAISER, C. R.; PINTO, A. C.; FERREIRA, V. F. Synthesis of a- and b-pyran naphthoquinones as a new class of antitubercular agents, Arch. Pharm. Chem. Life Sci. 343 (2010) 81-90.
FERREIRA, F. R.; FERREIRA, S. B.; ARAÚJO, A. J.; MARINHO FILHO, J. D. B.; PESSOA, C.; MORAES, M. O.; COSTA-LOTUFO, L. V.; MONTENEGRO, R. C.; DA SILVA, F. C.; FERREIRA, V. F.;, COSTA, J. G.; DE ABREU, F. C.; GOULART, M. O. F.. Arylated - and -dihydrofuran naphthoquinones: Electrochemicalparameters, evaluation of antitumor activity and their correlation, Electrochimica Acta 110 (2013) 634– 640
C.P.V. Freire, S.B. Ferreira, N.S.M. de Oliveira, A.B.J. Matsuura, I.L. Gama, F.C. da Silva, M.C.B.V. de Souza, E.S. Lima, V.F. Ferreira, Synthesis and biological evaluation of substituted - and -2,3-dihydrofuran naphthoquinones as potent anticandidal agentes, Med. Chem. Commun. 229 (1) (2010) 229-232.
G. Jones, P. Willett, R.C. Glen, A.R. Leach, R. Taylor, Development and validation of a genetic algorithm for flexible docking, J. Mol. Biol. 267 (1997) 727-748.
J.R Lakowicz,. Principles of Fluorescence Spectroscopy, 3rd ed.; Springer: New York, NY, USA, 2006; pp. 277-330.
D. Li, B. Ji, H. Sun, Probing the binding of 8-acetyl-7-hydroxycoumarin to human serum albumin by spectroscopic methods and molecular modeling, Spectrochim. Acta Part A 73 (2009) 35-40.
D. Stan, I. Matei, C. Mihailescu, M. Savin, M. Matache, M. Hillebrand, I. Baciu, Spectroscopic investigations of the binding interaction of a new indanedione derivative with human and bovine serum albumins, Molecules 14 (2009) 1614-1626.
J.J.P. Stewart, Optimization of parameters for semiempirical methods V: Modification of NDDO approximations and application to 70 elements, J. Mol. Model. 13 (2007) 1173-1213.
K. Takehara, K. Yuri, M. Shirasawa, S. Yamasaki, S. Yamada, Binding properties of hydrophobic molecules to human serum albumin studied by fluorescence titration, Anal. Sci. 25 (2009) 115-120.
Y. Yue, Y. Zhang, Y. Li, J. Zhu, J. Qin, X. Chen, Interaction of nobiletin with human serum albumin studied using optical spectroscopy and molecular modeling methods, J. Luminesc. 128 (2008) 513-520.











