ISBN 978-85-85905-19-4
Área
Química Orgânica
Autores
Ferreira, R.C. (UFRRJ) ; de Oliveira, C.H.C.S. (UFRRJ) ; Chaves, O.A. (UFRRJ) ; de Barros, L.S. (UFRRJ) ; Ferreira, S.B. (UFRJ) ; Ferreira, V.F. (UFF) ; Ferreira, A.B.B. (UFRRJ) ; Cesarin-sobrinho, D. (UFRRJ) ; Netto-ferreira, J.C. (UFRRJ)
Resumo
A interação entre albumina sérica humana (ASH) e 1,4-naftoquinonas substituídas, LF e LF4Br, foi estudada por espectroscopia de emissão de fluorescência, UV-vis e dicroísmo circular. A distância entre doador e aceptor indica ocorrência de forte interação independente da temperatura. ΔH ° e ΔS° varia de acordo com o substituinte (H ou Br) na interação com ASH. Em ASH/LF o valor negativo de ΔH° evidencia que a interação ocorre principalmente por ligação de hidrogênio. Para ASH/LF4Br, com valor de ΔH° positivo, o processo de interação ocorre principalmente por interações hidrofóbicas. Os valores de ΔG° (-25 e -26 kJ/mol) mostram espontaneidade na interação com ASH e a diminuição do % α-hélice da ASH (208 nm e 222 nm) foi devido ao aumento da concentração de naftoquinona (LF ou LF4Br).
Palavras chaves
Albumina sérica humana; 1,2-naftoquinona; fluorescência
Introdução
Naftoquinonas são substâncias com colorações que variam de amarelo a vermelho intenso. São encontradas em maior quantidade nos vegetais superiores do que em fungos e equinodermos. O lapachol e outras quinonas derivadas deste composto são representantes importantes da contribuição dos conhecimentos populares da população latino americana aos tratos à saúde humana. São constituintes químicos de várias espécies de Tabebuia e se destacam pelas propriedades microbicidas, tripanossomicidas, viruscidas, antitumorais e inibidoras de sistemas celulares reparadores, processos nos quais atuam de diferentes formas, o que geram muitos estudos e uma grande expectativa quanto ao uso medicinal. A α-lapachona (2,2-dimetil-3,4-diidro- 5,10-dioxo-2H-benzo-[g]-cromanona) é uma naftoquinona que pode ser extraída de plantas medicinais brasileiras como a Tabebuia Bignoniaceae [FUJII, N.; et al. 1997] e tem sido utilizada em pesquisas no estudo do tratamento de doenças infecciosas, com potencial atividade antimicrobiana contra bactérias multirresistentes [MACHADO, T.B. et al. 2003]. Esta naftoquinona mostra menor citotoxicidade e atividade redox quando comparada a outras quinonas bioativas [KRISHNAN, P.; et. al. 2001]. Assim, a α-lapachona não pode ser classificada como um agente tóxico, tampouco um inibidor catalítico. Isto faz com que a α-lapachona seja uma forte candidata para o desenvolvimento de fármacos para o tratamento de linhas de células resistentes a múltiplas drogas como tumores resistentes a hiperatividade com menor expressão de topoisomerase II [FONSECA, S. G. C.; et al. 2003]. A albumina sérica humana (ASH) é a proteína predominante no plasma sanguíneo e por conta disso é uma das proteínas mais estudadas [TAKEHARA et al. 2009]. Sintetizada no fígado, a concentração de ASH no plasma sanguíneo é de 40 mg/mL (4-5 g/100mL) [TANG et al. 2005] e seu peso molecular é de 66-66,5 kDa (66.000-66.500 g/mol) [HE et al. 2006], correspondendo a cerca de 50% das proteínas plasmáticas. Além da sua ação como transportadora, distribuidora e metabolizadora de inúmeros ligantes endógenos e exógenos, como por exemplo, fármacos, metabólitos, ácidos graxos, amino ácidos (geralmente triptofano e cisteína), hormônios, esteróides, cátions e ânions, metais (como cálcio, cobre, zinco, níquel, mercúrio, prata e ouro etc.), a interação destes ligantes com albuminas resulta no aumento da solubilidade de compostos bioativos no plasma, diminuindo a sua toxicidade [HE et al. 2006]. A interação entre compostos exógenos e ASH é um fator determinante e importante para a farmacodinâmica e farmacocinética de um fármaco, dependendo da concentração administrada, o que pode afetar a sua distribuição e eliminação [LI et al. 2009]. A capacidade da ASH se ligar a compostos aromáticos e heterocíclicos se dá por conta da existência de duas regiões de ligação, conhecidas como sítios I e II de Sudlow [YUE et al. 2008]. Análises cristalográficas da estrutura da ASH revelam que os sítios de ligação com os compostos bioativos estão localizados nos subdomínios IIA e IIIA [YUE et al. 2008], os quais são consistentes com os sítios I e II, respectivamente [SHAW e PAL 2008]. O sítio I, denominado sítio de ligação da warfarina, está localizado no subdomínio IIA, enquanto que o sítio de ligação II, chamado de sítio de ligação indol/benzodiazepina, está localizado no subdomínio IIIA. Dentre esses sítios, o sítio I parece ser mais versátil, porque ele pode se ligar com alta afinidade a ligantes que são muito diferentes do ponto de vista químico [STAN et al. 2009]. Uma grande cavidade hidrofóbica, na qual está contido um resíduo de triptofano (Trp-214), está presente no subdomínio IIA [SHAW e PAL 2008]. A principal região para ocorrência de ligação dos compostos bioativos está situada no sítio I, formado por uma grande cavidade hidrofóbica presente no subdomínio IIA, onde muitos compostos bioativos, como por exemplo, 1,4-naftoquinonas e α-lapachonas, podem se ligar [SUDLOW et al. 1975]. O presente estudo teve como objetivo investigar a influência da variação estrutural de derivados de 1,4 naftoquinonas, comparando os análogos furânicos LF (2-fenil-2,3-diidronafto[2,3-b]furan-4,9-diona) e LF4Br (2-(4-bromofenil)-2,3-diidronafto[2,3-b]furan-4,9-diona) na interação com albumina sérica humana (ASH). Foram empregadas as seguintes técnicas espectroscópicas: Uv-vis, emissão de fluorescência no estado estacionário e dicroísmo circular, em diferentes temperaturas.
Material e métodos
Equipamentos Os experimentos de espectroscopia de emissão de fluorescência, espectroscopia de absorção no ultravioleta e espectroscopia de dicroísmo circular foram realizados utilizando um espectrofluorímetro Jasco modelo J- 815 possuindo sistema de temperatura termostatizado Jasco PFD-425S15F com precisão de 0,1°C.Nos espectros de ultravioleta e dicroísmo circular foi utilizada uma cubeta de duas faces polidas (quartzo) de caminho óptico de 1 cm, enquanto que nos espectros de fluorescência foi utilizada cubeta de 4 faces polidas (quartzo) de caminho óptico de 1 cm. Vidraria Todo o material de vidro utilizado nos processos de preparação e na manipulação das amostras foi limpo de acordo com o roteiro abaixo: - A vidraria foi colocada em imersão em uma solução de etanol/água 1:1, com acréscimo de 10% de NaOH, durante 24 horas; - Enxaguada com água corrente; - Enxaguada com água destilada; - Enxaguada com metanol grau espectroscópico. - Enxaguada com acetona grau espectroscópico. - Seca à temperatura ambiente. Reagentes As 1,4-naftoquinonas empregadas no presente trabalho foram sintetizados no Laboratório de Síntese de Carboidratos e Nucleosídeos, do Instituto de Química da Universidade Federal Fluminense, de acordo com método descrito em FREIRE, et. al. 2010. Metanol grau espectrofotométrico e hidróxido de sódio P.A. foram adquiridos da Vetec. Albumina sérica humana (ASH) foi adquirido da Aldrich. Os sachês de PBS utilizados neste trabalho são produtos comerciais adquiridos da Aldrich, com os quais foram preparadas soluções tampão fosfato (PBS) de pH = 7,4. Água, grau milli-Q foi obtida através do aparelho DIRECT-Q, modelo MILLIPORE, que se encontra na sala 22 do departamento de química da Universidade Federal Rural do Rio de janeiro (UFRRJ) no LBBMA (Laboratório de bioquímica e biologia molecular de artrópodes). Métodos As 1,4-naftoquinonas foram analisados em soluções de PBS com albumina sérica humana (ASH) por técnicas de espectroscopia no ultravioleta/visível (UV- Vis), espectroscopia de emissão de fluorescência com variação de temperatura (λexc = 280 nm; T =305K, 310K, 315K) e espectroscopia de dicroísmo circular na temperatura constante de 310K.
Resultado e discussão
A adição de alíquotas de naftoquinona a uma solução de ASH (C = 0,01 mmol/L)
levou a uma diminuição gradativa na intensidade de emissão máxima de
fluorescência de ASH, indicando que a adição da naftoquinona resulta em uma
localização do supressor próxima ao resíduo de triptofano [WEI et. al. 2006
e CHENG et al. 2009]. O aumento na concentração das naftoquinonas,
decorrente de adições sucessivas, resultou em um leve deslocamento na banda
de emissão de fluorescências da albumina para o azul, o que sugere a
ocorrência da interação do composto na cavidade hidrofóbica da albumina,
gerando pequenas mudanças estruturais nesta região, e acarretando uma
diminuição da polaridade ao redor do resíduo de triptofano [SHI et. al.
2007, TANG et. al. 2006 e CHENG et. al. 2009]. Os valores de Ksv (entre 10^4
e 10^5 L/mol) demonstram que o provável mecanismo de supressão de ASH pela
interação com as naftoquinonas é estático e o processo é pouco dependente da
temperatura. Os altos valores encontrados para as constantes de velocidade
de supressão pelas naftoquinonas (10^12 a 10^13L/mol.s), empregando-se o
valor para o tempo de vida de fluorescência de ASH de τo= 1x10^-8 s [SKLAR,
L.A. et. al. 1977], muito mais altos do que a constante de velocidade de
difusão (5 x 10^9 L/mol.s, em água) [MUROV, et. al., 1993], indicam a
formação de uma pré-associação ASH/naftoquinonas. As constantes de ligação
(Ka) mostram que as naftoquinonas ligam-se fortemente a ASH, visto que os
valores de Ka foram bem parecidos com os da literatura para outras moléculas
bioativas (104 a 105 L/mol) que apresentam fortes interações com albumina
[LI et al. 2007, ZHANG et al. 2008 e LI et al. 2009]. Com o uso dos valores
de Ka calculados para a supressão de ASH foram construídos gráficos de Van’t
Hoff. A partir destes gráficos foram feitas as determinações dos parâmetros
termodinâmicos de variação de entalpia (ΔH) e entropia (ΔS) envolvidos na
supressão da ASH e, através destes, foram calculados os valores de variação
de energia livre de Gibbs (ΔG). As temperaturas de 305K, 310K e 315K foram
escolhidas, pois a albumina sérica humana (ASH) não apresenta qualquer
degradação estrutural nestas temperaturas [KANDAGAL et al. 2006, YUE et al.
2008, WANG et al. 2008, ZHANG et al. 2008, CHENG et al. 2009, QING et al.
2009 e LI et al. 2009].Para interação composto bioativo-proteína valores
positivos de ΔS freqüentemente levam à evidência de que a interação é
hidrofóbica, devido à diminuição do nível de organização das moléculas de
água que estão arranjadas ao redor do ligante. Já valores negativos para a
variação de entalpia indicam a possível ocorrência de interação hidrofílica
com provável formação de ligações de hidrogênio [ROSS e SUBRAMANIAN 1981,
YUE et 50 al. 2008 e LI et al. 2009]. Os valores de ΔS positivos
evidenciaram que o tipo de interação entre as naftoquinonas e a ASH foi
hidrofóbico, e os valores de ΔG negativos (-24 a -29kJ/mol) demonstraram a
espontaneidade de ligação das naftoquinonas com a ASH. O átomo de bromo em
LF4Br causa, além da hidrobicidade, efeito de impedimento estérico, por
conta de seu elevado volume. Os valores de ΔH e ΔS para LF, mostram que as
interações são hidrofílicas, e a diferença entre ΔH de LF e ΔH de LF4Br é
consequência da presença do átomo de bromo por conta da hidrobicidade e
efeito de impedimento estérico, por conta de seu elevado volume. O cálculo
da distância entre o resíduo de triptofano (doador de energia) e a molécula
supressora (aceptor de energia) pode ser feito de acordo com a teoria de
transferência de energia não-radiativa de Förster [FÖRSTER 1948], onde a
eficiência de transferência de energia (E) tem relação com as distâncias R0
e r entre doador e aceptor [YUE et al. 2008]. O valor da distância entre as
naftoquinonas e o resíduo de triptofano (r entre 2 e 3 nm) foi menor que 7
nm [HE et al. 2006 e YUE et al. 2008], para todos os casos de interação
entre ASH e naftoquinonas. Isto é, portanto, um indício da possibilidade de
ocorrência do fenômeno de transferência de energia entre ASH e
naftoquinonas, estando de acordo com a teoria de transferência de energia
não radiativa de Förster (Teoria de Förster) [YUE et al. 2008], por indicar
que ocorreu realmente um processo de supressão estática na interação entre
naftoquinonas e ASH [LAKOWICZ 2006]. Espectros de dicroísmo circular (DC)
foram obtidos para avaliar a mudança estrutural de ASH induzida pela adição
das naftoquinonas. A interação das α-naftoquinonas com a ASH resultou na
diminuição na intensidade das bandas características (208nm e 222nm),
sugerindo que ocorreram mudanças na estrutura secundária da proteína, sendo
mais um indicativo da formação de complexos entre ASH e as naftoquinonas.
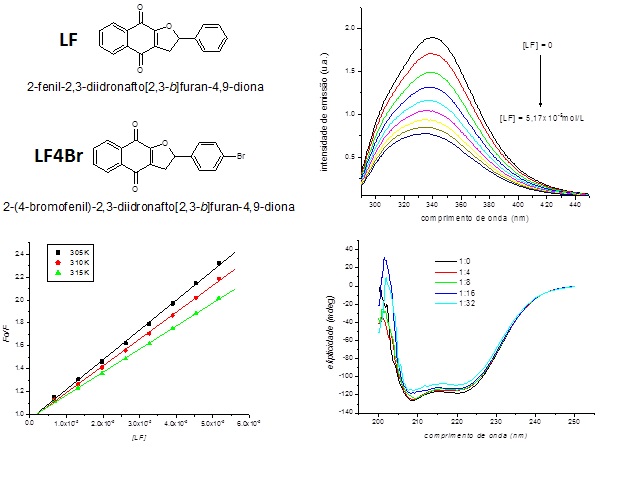
Estruturas de LF e LF4Br, gráfico de Stern-Volmer e espectros de emissão de fluorescência e dicroísmo circular.
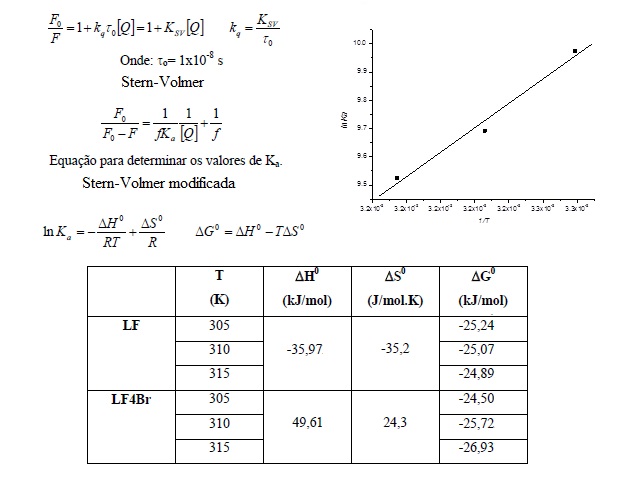
Equações de Stern-Volmer, Stern-Volmer modificada, vant' Hoff e parâmetros termodinâmicos.
Conclusões
Os resultados dos estudos por espectroscopia de emissão de fluorescência da interação entre ASH e as naftoquinonas, nas temperaturas de 305 K, 310 K e 315 K, mostraram que ocorreu a supressão da banda de emissão de fluorescência da albumina (ASH) que apresenta um máximo de emissão a 340 nm, indicando que a interação entre as naftoquinonas e a ASH deve envolver os resíduos de triptofano da proteína. O leve efeito hipsocrômico observado com o aumento da concentração das naftoquinonas, na banda de emissão da proteína (ASH), sugere que o cromóforo da proteína (ASH) está em um ambiente diferente daquele anterior à adição das naftoquinonas (ASH livre), sendo levado para um ambiente mais hidrofóbico para LF4Br e mais hidrofílico para LF. Os efeitos na polaridade do microambiente ao redor do resíduo de triptofano indicam uma provável formação do complexo ASH/naftoquinona. As constantes de supressão de Stern-Volmer (Ksv) indicam que o provável processo de supressão de ASH pela interação com as lapachonas é estático, com a formação de pré-associação ASH/naftoquinonas antecedendo o processo de transferência de energia. A variação de entalpia positiva para LF4Br mostrou que o processo de ligação com a ASH foram preferencialmente hidrofóbicos, e os valores de entropia também positivos evidenciaram que o tipo de interação com ASH é hidrofóbico. Os resultados de dicroísmo circular mostraram que não houve mudança significativa na estrutura secundária de ASH.
Agradecimentos
UFRRJ, CNPq, CAPES e FAPERJ.
Referências
CHENG, Y.; LUI, B.; ZHOU, X.; XIAO, H.; LIU, Y.; Spectrochim. Acta Part A. 72 (2009) 922-928.
FONSECA, S. G. C.; BRAGA, R. M. C.;SANTANA, D. P.; Rev. Bras. Farm. 84 (2003) 9-16.
FÖRSTER, T. ; Ann. Phys. 2 (1948) 55.
FREIRE, C.P.V.; FERREIRA, S.B.; DE OLIVEIRA, N.S.M.; MATSUURA, A.B.J.; GAMA, I.L.; DA SILVA, F.C.; DE SOUZA, M.C.B.V.; LIMA, E.S.; FERREIRA, V.F.; Med. Chem. Commun. 229 (2010) 229-232.
FUJII, N.; YAMASHITA, Y.; MIZUKAMI, T.; NAKANO, H.; Mol. Pharmacol. 51 (1997) 269-276.
HE, W. Y.; LI, Y.; SI, H. Z.; DONG, Y. M.; SHENG, F. L.; YAO, X. J.; HU, Z. D.; J. Photochem. Photobiol. A: Chem. 182 (2006) 158.
KANDAGAL, P. B.; ASHOKA, S.; SEETHARAMAPPA, J.; SHAIKH, S. M. T.; JADEGOUD, Y.; IJARE, O. B.; J. Pharm. Biomed. Anal. 41 (2006) 393-399.
KRISHNAN, P.; BASTOW, K. F.; Cancer Chem. Pharm. [sl.]. 47 (2001) 187.
LAKOWICZ, J.R; Principles of Fluorescence Spectroscopy, 3rd ed.; Springer: New York, NY, USA, 2006; pp. 277-330.
LI, Y.; YAO, X.; JIN, J.; CHEN, X.; HU, Z.;Biochim. Biophys. Acta 1774 (2007) 51-58
LI, D.; JI, B.; SUN, H.; Spectrochim. Acta part A 73 (2009) 35-40.
MACHADO, T. B.; PINTO, A. V.; PINTO, M. C. F. R.; LEAL, I. C. R.; SILVA, M. G.; AMARAL, A. C. F.; KUSTER, R. M. A.; SANTOS, K. R. N.; Int. J. Antimicrob. Agents, 84 (2003) 279-284.
MUROV, S.; CARMICHAEL, I.; HUG, G. L.; Handbook of Photochemistry, 2nd ed., Marcel Dekker, inc.: New York. (1993).
QING, W. Y.; PING, T. B.; MEI, Z. H.; HUA, Z. Q.; CHENG, Z. G. J. Photochem. Photobiol. B: Biol. 94 (2009) 183.
ROSS, P. D.; SUBRAMANIAN, S. Biochem. 20 (1981) 3096.
SHAW, A. K.; PAL, S. K.; J. Photochem. Photobiol B: Biol. 90 (2008) 69-77.
SHI, X. Y.; CAO, H.; REN, F. L.; XU, M.; Chem. Biodiver. 4 (2007) 2780.
SKLAR, L. A.; HUDSON, B. S.; SIMONI, R. D.; Biochemistry-US. 16 (1977) 5100-5108.
STAN, D.; MATEI, I.; MIHAILESCU, C.; SAVIN, M.; MATACHE, M.; HILLEBRAND, M.; BACIU, I.; Molecules. 14 (2009) 1614-1626.
SUDLOW, G.; BIRKETT, D. J.; WADE, D. N.; Mol. Pharmacol. 11 (1975) 824-832.
TAKEHARA, K.; YURI, K.; SHIRASAWA, M.; YAMASAKI, S.; YAMADA, S.; Anal. Sci. 25 (2009) 115-120.
TANG, J.; QI, S.; CHEN, X.; J. Mol. Struct. 779 (2005) 87-95
TANG, J.; LUAN, F.; CHEN, X.; Bioorg. Med. Chem. 14 (2006) 3210-3217.
WANG, Y. Q.; TANG, B. P.; ZHANG, Z. H. M.; ZHOU, Q. H.; ZHANG, G. C.; J. Phtotochem. Photobiol. B: biol. 94 (2009) 183-190.
WEI, Y. L.; LI, J. P; DONG, C.; SHUANG, S. M.; LIU, D. S.; HUIE, C. W.; Talanta 70 (2006) 377.
YUE, Y.; ZHANG, Y.; LI, Y.; ZHU, J.; QIN, J.; CHEN, X.;J. Luminesc. 128 (2008) 513-520.
ZHANG , G.; QUE, Q.; PAN, J.; GUO, J.; J. Mol. Struc. 881 (2008) 132-138











