ISBN 978-85-85905-19-4
Área
Química Orgânica
Autores
dos Santos Filho, J.M. (UFPE) ; de Queiroz e Silva, D.M.A. (UFPE)
Resumo
Malária, causada por várias espécies de Plasmodio, é uma das infecções parasitárias mais mortais do planeta. A resistência do parasita às drogas estruturalmente relacionadas à quinolona torna premente a descoberta de novos agentes antimaláricos estruturalmente diversos daqueles atualmente em uso. O planejamento estrutural com base na estratégia de hibridação molecular deu origem a novas séries de derivados N-acil-hidrazona-1,2,4- oxadiazol com atividade antiparasitária comprovada, sugerindo que esta estratégia poderia levar à descoberta de novos agentes antimaláricos. A síntese de duas novas séries de híbridos moleculares contendo as porções cinamil e ferrocenil, ambas associadas à atividade biológica, foi realizada com o objetivo de estudar seu perfil antimalárico.
Palavras chaves
N-Acil-hidrazona; 1,2,4-Oxadiazol; Atividade antimalárica
Introdução
A química de N-acil-hidrazonas é uma área de intensa pesquisa, sobretudo devido ao amplo espectro de atividades biológicas apresentadas por estas substâncias[1]. Derivados N-acil-hidrazona têm sido extensivamente sintetizados no Laboratório de Planejamento e Síntese Aplicados à Química Medicinal-SintMed® e sua atividade biológica explorada, sobretudo como antichagásisos[2]. Tem-se observado que sua associação ao anel 1,2,4- oxadiazólico leva a propriedades estruturais e farmacológicas importantes dos derivados obtidos, sobretudo por serem os oxadiazois farmacóforos importantes no desenvolvimento de compostos antiparasitários[3]. Duas novas séries de derivados 4-arilssubstituído-1,2,4-oxadiazol-N-acil- hidrazona foram planejadas incorporando as porções cinamil SintMed (1-8) e ferrocenil SintMed (9-16), conforme mostrado na Figura 1. Estas modificações moleculares foram investigadas devido ao importante papel desempenhado pelo grupo cinamil presente em moléculas com atividade antimalárica comprovada[4]. Do mesmo modo, a porção ferrocenil tem sido associada por longo tempo a moléculas bioativas, incluindo compostos antimaláricos[5].
Material e métodos
A síntese dos compostos SintMed (1-16) foi baseada na metodologia desenvolvida previamente no SintMed®[2]. Arilnitrilas obtidas comercialmente foram convertidas a arilamidoximas 4-substituídas por refluxo durante 4 horas na presença de hidroxilamina, com rendimentos de 70-92%. Heterocicloadição das arilamidoximas em presença de cloreto de metiloxalila sob refluxo em THF seco levou a derivados 4-arilssubstituído-1,2,4- oxadiazolcarboxilato de metila com rendimentos de 80-85%, os quais reagiram sob condições brandas com hidrazina hidrato por 2 horas a 0 °C, produzindo as hidrazidas correspondentes com rendimentos variando de 92-95% após purificação. A etapa final de obtenção dos derivados SintMed (1-16) ocorreu segundo o protocolo de catálise estereosseletiva mediada por CeCl3 desenvolvido em nosso grupo[6], dando os compostos de interesse com rendimentos superiores a 90%, exclusivamente como isômeros E, após refluxo a 40 °C por 10-30 minutos. A pureza enantiomérica de todos os derivados foi verificada para os produtos brutos por análise de ressonância magnética de hidrogênio (1H RMN) a 300 MHz, utilizando-se aparelho Varian Unitplus 300. Adicionalmente, todos os compostos foram também caracterizados por espectroscopia de infravermelho (IV) em espectrofotômetro Tensor27 Bruker, bem como por determinação de seu ponto de fusão em aparelho Farma 1500 da Gehaka e por cromatografia em camada fina (CCF), corroborando a pureza das amostras após recristalização em dioxano/água 1:1.
Resultado e discussão
As séries 4-arilssubstituído-1,2,4-oxadiazol-N-acil-hidrazona contendo os
grupos cinamil SintMed (1-8) e ferrocenil SintMed (9-16) têm suas estruturas
exibidas na Figura 1. Seguindo o comportamento geral de hidrazonas
sintetizadas sob catálise de CeCl3, todos os produtos foram obtidos
exclusivamente como isômeros E, comprovados pela análise de 1H RMN. Este
resultado foi analisado com base no sinal do hidrogênio imínico (-N=CH-),
que ressona a 8,50-8,30 ppm. Em trabalhos anteriores, determinou-se que
esse valor é característico para E-isômeros[2,6]. A pureza diasteromérica
também pode ser estabelecida com base no sinal do grupo amida (-CONH-), o
qual não sofre desdobramento quando apenas um isômero é obtido. Em todos os
produtos obtidos, o padrão exclusivo do isômero E foi o único observado.
Os resultados obtidos para a análise de IV de todos os compostos mostraram
as bandas características esperadas, com destaque para os grupos (-NH-) a
cerca νmax 3300-3200 cm-1, (C=O) por volta de νmax 1700-1680 cm-1 e (C=N,
imina) na região de νmax 1620 cm-1. Os intervalos de fusão de todos os
compostos foram determinados e se mostraram com variação máxima de 2 °C,
corroborando sua pureza previamente observada também por CCF. A
caracterização completa de todos os compostos foi conduzida por outras
técnicas espectroscópicas, confirmando indubitavelmente as estruturas
descritas neste trabalho.
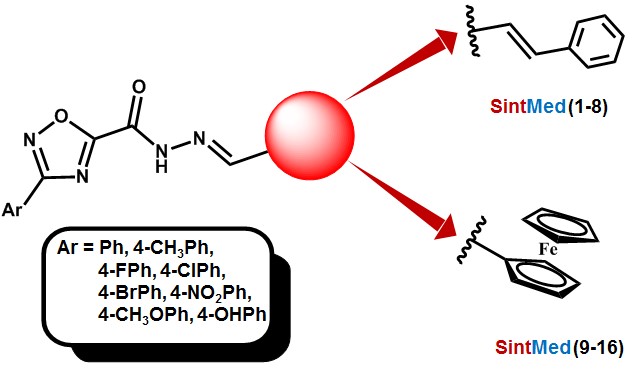
Estruturas gerais dos híbridos 1,2,4-oxadiazol-N- acil-hidrazona.
Conclusões
O planejamento de novos compostos potencialmente ativos no tratamento da malária teve como base a estratégia de hibridação molecular entre dois grupos privilegiados, a porção N-acil-hidrazona e o heterociclo 1,2,4-oxadiazol, incluindo as porções cinamil e ferrocenil. A estratégia de síntese utilizada foi desenvolvida com sucesso, levando aos produtos finais SintMed (1-16) em poucas etapas de síntese e com seletividade para o isômero E, resultado crucial para se conduzir testes biológicos e definir o perfil farmacológico dessas moléculas.
Agradecimentos
Os autores são gratos à equipe da Central Analítica do Departamento de Química Fundamental da UFPE pelas análises espectroscópicas.
Referências
[1] Padmini et al., Int. J. Pharma Res. Rev., 2013, 2(8), 43-58.
[2] dos Santos Filho et al., Bioorg. Med. Chem., 2012, 20, 6423-6433.
[3] Lepesheva et al., J. Infect. Dis., 2015, 212, 1439-1448.
[4] Gomes et al., ChemMedChem, 2014, 9, 305-310.
[5] Dubar et al., Angew. Chem. Int Ed. Engl., 3013, 52, 7690-7693.
[6] dos Santos Filho, J. M., Eur. J. Org. Chem., 2014, 6411–6417.











