ISBN 978-85-85905-19-4
Área
Química Orgânica
Autores
Araujo, R.N.M. (UFPA) ; Miranda, C.V.M. (UFPA) ; Ripardo Filho, H.S. (IFAP) ; Guilhon, G.M.S.P. (UFPA) ; Monteiro, W.R. (UFPA) ; Alves, C.N. (UFPA) ; Santos, L.S. (UFPA)
Resumo
A bergenina é uma isocumarina que apresenta diversas atividades biológicas como anti-oxidante, anti-HIV, anti-arritimica, hepatoprotetora, anti-inflamatoria, anti-microbiana entre outras. Neste trabalho, a partir das cascas do caule da espécie Endopleura uchi foi isolada a bergenina, e a partir desta foi obtido o derivado di-benzilado por meio da reação com o brometo de benzila (BnBr), K2CO3 como base e dimetil formamida (DMF) como solvente, em 95% de rendimento. Os compostos foram caracterizados por meio da análise dos seus dados espectrométricos de RMN de 1H e de 13C 1D e 2D. O derivado obtido será utilizado na síntese de outros derivados da bergenina e será utilizado em ensaios farmacológicos como anti-inflamatório, entre outros.
Palavras chaves
Bergenina; Endopleura uchi; Isocumarina
Introdução
Os produtos naturais têm se destacado no cenário da indústria farmacêutica nos últimos tempos como importantes materiais na constituição de medicamentos e/ou como material de partida de novos medicamentos voltados ao combate de patologias que acometem o ser humano, como por exemplo, câncer, HIV, inflamação, leishmaniose, malária, entre outros. O potencial das plantas como fonte de novas drogas ainda oferece grande campo para investigação científica, pois das espécies conhecidas, uma pequena porcentagem já foi avaliada fitoquímicamente, e apenas uma fração destas já foi avaliada quanto ao potencial farmacológico. Mesmo entre as plantas com uso medicinal tradicional ainda há um grande percentual que não foi objeto de estudo visando à comprovação da eficácia e da segurança de seu uso (BALBINO; DIAS, 2010; RUIZ et al, 2008). A procura por novos agentes farmacologicamente ativos obtidos de plantas têm levado à descoberta de muitas drogas clinicamente ativas. Assim, a investigação fitoquímica é de grande importância, pois o isolamento de princípios ativos e a modificação química destes podem resultar em descobertas de novos compostos com aplicação terapêutica. As plantas representaram, durante séculos, a única fonte de agentes terapêuticos para o homem. No início do século XIX, com o desenvolvimento da química farmacêutica, as plantas passaram a representar a primeira fonte de substâncias para o desenvolvimento de medicamentos (BALBINO; DIAS, 2010). Atualmente, apesar do grande desenvolvimento da síntese orgânica e de novos processos biotecnológicos, 25% dos medicamentos prescritos nos países industrializados são originários de plantas e 120 compostos de origem natural, obtidos a partir de cerca de 90 espécies de plantas, são utilizados na terapia moderna. Diversas plantas da flora brasileira são importantes fontes de substâncias biologicamente ativas. Entre essas plantas podemos citar a Endopleura uchi pertencente à família Humiriaceae. A espécie Endopleura uchi (Huber) Cuatrec., ou popularmente, uxizeiro, é uma árvore originária da Amazônia, cujo fruto é muito apreciado na alimentação e cuja casca do caule tem sido empregada há muitos anos com bons resultados na medicina popular e é uma rica fonte da substância bergenina (1). Bergenin (1) é um C-glicosidio do ácido 4-O-metilgalico que ocorre naturalmente em diversas espécies de plantas em todo o mundo, e exibe diversas atividades farmacológicas como antiasmática, antitussígena, anti-inflamatória, antifúngica (PRITHIVIRAJ et al., 1997), anti-HIV (PIACENTE et al., 1996), anti-hepatotóxica (KIM et al., 2000; LIM et al., 2000), entre outras. Além disso, essa substância tem sido usada por mais de 100 anos no Japão para o tratamento de doenças gastrintestinais, como úlcera gástrica, gastrite, diarréia e constipação (ABE et al., 1980). Recentemente, isolamos e identificamos a bergenina das cascas do caule de E. uchi e obtivemos seu derivado penta-acetilado, bem como demonstramos a potente atividade anti-inflamatória desse derivado, em modelos experimentais em camundongos (BORGES et al., 2011). Dando continuidade ao estudo, neste trabalho re-isolamos a bergenina das cascas de E. uchi e obtivemos o derivado di-benzilado para futura avaliação biológica e como intermediário de síntese de compostos com provável ação biológica.
Material e métodos
COLETA E IDENTIFICAÇÃO DO MATERIAL BOTÂNICO As cascas do caule de Endopleura uchi foram coletadas em abril/2010 no município de Ananindeua-PA. Uma exsicata do material encontra-se catalogada sob o Número de Registro MG 195862 no Herbário “João Murça Pires” do Museu Paraense Emílio Goeldi, em Belém-PA. OBTENÇÃO DOS EXTRATOS DE ENDOPLEURA UCHI As raízes (2 kg) de Endopleura uchi foram secadas, moídas e submetidas a extrações sucessivas com hexano (1x 3L) e MeOH (2x 3L) durante 72 horas. OBTENÇÃO DA ISOCUMARINA BERGENINA (1) O extrato metanólico das cascas do caule de Endopleura uchi( 40 g) foi fracionado em CC eluida com hexano, misturas entre hexano e AcOEt (em quantidades crescentes de AcOEt), AcOEt e misturas entre AcOEt e MeOH (em quantidades crescentes de MeOH), totalizando 9 frações. Após fracionamento, com o auxílio de CCD as frações que apresentaram perfil cromatográfico semelhante foram reunidas. Da reunião das frações Hex/AcOEt 10% e Hex/AcOEt 15% foram obtidos por cristalização e recristalização 1,3 g da isocumarina bergenina. As frações Hex/AcOEt 20%, Hex/AcOEt 25%, Hex/AcOEt 30% e Hex/AcOEt 35% foram reunidas fornecendo 9,5 g de material que foi cromatografado em coluna com sílica gel (CC) levando ao isolamento e identificação de 5,5 g de bergenina. OBTENÇÃO DO DERIVADO DI-BENZILADO 2 A 1,0 g (3 mmol) de bergenina (1) em 20 mL de dimetil formamida (DMF) anidro foram adicionados 3,3 (24 mmol) de K2CO3 anidro e 1,0g (6,0 mmol) de brometo de benzila (BnBr). A mistura de reação foi agitada a temperatura ambiente durante 24 horas e filtrada em papel de filtro utilizando diclorometano (DCM) para lavagem. O filtrado foi concentrado sob pressão reduzida até eliminação dos solventes (DCM e DMF). Foram adicionados 20 mL de H2O e formou uma pasta branca gelatinosa, de difícil tratamento. Tentativa de extração com DCM não foi eficiente. Após a eliminação do DCM sob pressão reduzida, foi adicionado AcOEt mas não houve separação de fases. Tentativa de “quebrar” a emulsão com solução aquosa saturada de NaCl não foi eficiente. O material no funil de separação (ainda com AcOEt) foi deixado na capela durante quatro dias e então extraído com AcOEt e DCM. Os extratos foram secados com Na2SO4 anidro e após filtração e eliminação dos solventes sob pressão reduzida foram obtidos 1,47 g (95% de rendimento) da bergenina di-benzilada 2 como um sólido branco.
Resultado e discussão
A bergenina (1) foi isolada da espécie Endopleura uchi como um sólido cristalino incolor a partir de fracionamentos cromatográficos dos extratos hexânico e metanólico das cascas do caule da planta. Sua molécula é composta de três anéis de seis membros: um anel aromático, um anel glucopiranose e um anel δ-lactona. O anel glucopiranose exibe apenas pequenos desvios a partir de uma conformação ideal do tipo cadeira. O anel δ-lactona possui a esperada conformação semi-cadeira (YE et al., 2004 ; RASTOGI et al., 2008).
A bergenina foi indentificada pela análise de seus dados espectrométricos de RMN de 1H e de 13C uni- e bi-dimensionais, além de comparação com dados da literatura. A partir da bergenina foi obtido seu derivado di-benzilado, conforme o esquema de reação da figura 1. A figura 2 apresenta as estruturas numeradas da bergenina e do derivado di-benzilado.
O espectro de RMN 1H (CD3OD, 500 MHz) de 1 apresenta um sinal simpleto em δ 7,08 (1H, s) devido ao hidrogênio aromático H-7, um sinal simpleto em δ 3,90 referente aos hidrogênios da metoxila aromática, um dupleto em δ 4,95 (1H, d, J=10,0 Hz) referente ao hidrogênio benzílico H-10b, além de sinais típicos do C-glicosídeo, como o multipleto em δ 4,10-4,00 (2H, m) devido aos hidrogênios H14a e H-11a, o tripleto largo em δ 3,81 (1H, tl) referente ao H-4, o multipleto em δ 3,73-3,64 (2H, m) é devido aos hidrogênios H-2 e H-11b e o tripleto largo em δ 3,43 (1H, tl) referente ao hidrogênio H-3.
O espectro de RMN 13C da bergenina evidenciou a presença de 14 sinais de carbonos, entre os quais o sinal relativo à carbonila em δ 165,7 (C-2), o grupo hidroximetileno em δ 62,7 (C-16) característico de açucares e o sinal em δ 60,9 (OMe-15) referente ao carbono da metoxila aromática. Os demais carbonos tiveram as seguintes atribuições: δ 152,4 (C-4), δ 149,4 (C-6), δ 142,3 (C-5), δ 119,4 (C-8), δ 117,3 (C-7), δ 111,0 (C-3), δ 83,0 (C-11), δ 81,4 (C-14), δ 75,6 (C-13), δ 74,2 (C-9) e δ 71,9 (C-12). Os dados espectrométricos da substância isolada estão de acordo com os dados relatados na literatura para a substância bergenina (1) (MAGALHÃES, et al., 2007; LUNA, et al., 2001).
A molécula da bergenina apresenta seis hidroxilas, quatro na unidade de açúcar e duas hidroxilas fenólicas. Devido à maior nucleofilicidade das hidroxilas fenólicas, a reação ocorre preferencialmente nessas posições.
O derivado di-benzilado 2 da bergenina foi obtido por meio da reação da bergenina com o brometo de benzila (BnBr) em dimetil formamida (DMF), em 95% de rendimento (Figura 1).
O derivado di-benzilado 2 foi caracterizado pela análise de seus dados espectrométricos de RMN de 1H e de 13C uni- e bi-dimensionais.
O espectro de RMN de 1H (CD3OD, 500 MHz) de 2 apresenta, entre outros sinais, um sinal simpleto em δ 3.96 (3H, s) referente aos hidrogênios do grupo metoxila, quatro conjuntos de multipletos centrados em δ3,37; 3,59; 3,76 e 4,02 referentes ao hidrogênios oximetínicos da unidade glicosídica, um sinal dupleto em δ 4,38 referente ao hidrogênio metínico oxi-benzílico da unidade glicosídica, dois sistemas de quarteto AB, um em δ 5,03 e outro em δ 5,18 referentes aos dois hidrogênios metilênicos benzílicos introduzidos na molécula, um multipleto em δ 7,34-7,50 referentes aos hidrogênios aromáticos das unidades benzílicas introduzidas e um simpleto em δ 7,56 referente ao hidrogênio aromatico da unidade isocumarínica.
O espectro de RMN de 13C (CD3OD, 125 MHz) do derivado 2 apresenta entre outros sinais, um sinal relativo ao carbono da carbonila em δ 164,59 (C-6), o sinal em δ 152,78 é referente ao carbono (C-8), um sinal em δ 149,63 devido ao carbono (C-9), o sinal em δ 149,19 é referente ao carbono (C-10), o sinal em δ 136,68 é devido ao carbono (C-1’’), o sinal em δ 135,84 é referente ao carbono (C-1’), um conjunto de sinais em δ 128,68-128,32 referentes aos carbonos (C-2’, C-3’, C-4’, C-5’, C-6’, C-2’’, C-3’’, C-4’’, C-5’’ e C-6’’), os sinais em δ 126,82; 118,69; 111,88; 80,64; 80,28; 76,29; 74,35; 72,13; 71,08 e 69,76 são devidos, respectivamente, aos carbonos C-6a, C10a, C-7, C-3, C-4a, C-7’, C-7’’, C-2, C-10b e C-4. O sinal em δ 61,27 é referente aos carbonos C-11 e da metoxila aromática.
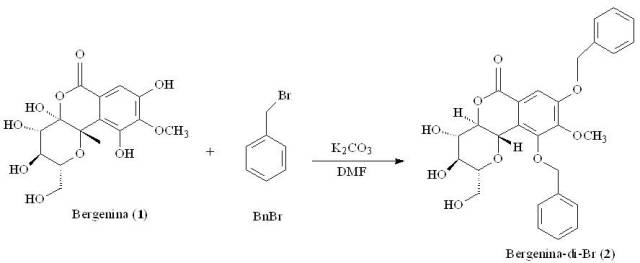
Esquema de reação de di-benzilação da bergenina
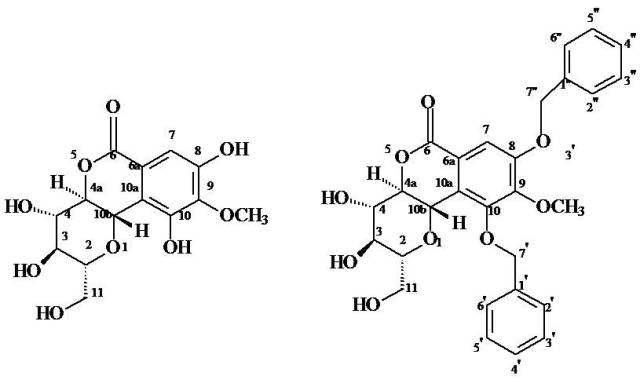
Estruturas numeradas da Bergenina e do derivado Di-benzilado
Conclusões
Das cascas do caule de Endopleura uchi foi isolada a isocumarina bergenina e a partir da reação com brometo de benzila em DMF utilizando K2CO3 como base foi obtido o derivado di-benzilado em 95% de rendimento. Os compostos foram identificados por meio da análise dos dados espectrométricos usuais (RMN de 1H e 13C uni- e bi-dimensionais).
Agradecimentos
À CAPES, CNPq, FAPESPA e UFPA.
Referências
ABE, KAKUKO; SAKAI, KIYOSHI; UCHIDA, MASAATSU. Effects of bergenin on experimental ulcers- prevention of stress induced ulcers in rats.Gen.Pharmac., v. 11, p. 361-368, 1980.
BORGES, J.C.M; RIPARDO FILHO, H.S; GUILHON, G.M.S.P.; CARVALHO, J.C.T.; SANTOS, L.S.; SOUSA, P.J.C. Antinociceptive Activity of Acetylbergenin in Mice. Latin American Journal of Pharmacy, 30(7): 1303-8 (2011).
KIM, HS.; LIM, HK.; CHUNG, MW.; KIM, YC. Antihepatotoxic activity of bergenin, the major constituent of Mallotus japonicus, on carbon tetrachloride-intoxicated hepatocytes.. Journal Ethnopharmacology, v. 69, p. 79-83, 2000.
LIM, HK.; KIM, HS.; CHOI, HS.; OH, S.; CHOI, J. Hepatoprotective effects of bergenin, a major constituent of Mallotus japonicus, on carbon tetrachloride-intoxicated rats. Journal Ethnopharmacology, 72, p. 469-474, 2000a.
LIM, HK.; KIM, HS.; CHUNG, MW.; KIM, YC. Protective effects of bergenin, the major constituent of Mallotus japonicus, on D-galactosamine-intoxicated rat hepatocytes. Journal of Ethnopharmacoly, 70, p. 69-72, 2000b.
PIACENTE, S.; PIZZA, C.; DE. T. N.; MAHMOOD, N. Constituents of Ardisia japonica and their in vitro anti-HIV activity. Journal of Natural Product, v. 59, p. 65-9, 1996.
PRITHIVIRAJ, B.; SINGH, U. P.; MANICKAM, M.; SRIVASTAVA, J. S.; RAY, A. B. Antifungal activity of bergenin, a constituent of Flueggea microcarpa. Plant Pathology, v. 46, p. 224-228, 1997.
RASTOGI, S.; RAWATA, A. K. S. A comprehensive review on bergenin- a potential hepatoprotective and antioxidative phytoconstituent. Herba Polonica, v. 54, n. 2, p. 76-79, 2008.
RUIZ, A. L. T. G.; TAFFARELLO, D. ; SOUZA, V. H. S.; CARVALHO, V. H. S.Farmacologia e Toxicologia de Peumus boldus e Baccharis genistelloides. Revista Brasileira de Farmacognosia, v.18, n. 2, p. 295-300, 2008.
YE, Y-P.; SUN, H-X.; PAN, Y-J. Bergenin monohydrate from the rhizomae of Astible chinesis. Acta Crystalografic, v. 60, p. 0397-0398, 2004.











