ISBN 978-85-85905-19-4
Área
Química Orgânica
Autores
Matos, D.M.A. (UECE) ; Maia, S.S.V. (UECE) ; Abreu, K.V. (UECE) ; Oliveira, M.R.F. (UECE) ; Soares, D.W.F. (UECE) ; Davi, D.M.B. (UECE) ; Maciel, J.R.F. (UECE) ; Alves, D.R. (UECE) ; Abreu, K.L. (UECE) ; Alves, C.R. (UECE)
Resumo
O objetivo deste trabalho foi a síntese, caracterização, e realização de teste toxicológico e fungicida frente ao fungo Lasiodiplodia theobromae do análogo do Cardanol Hidrogenado obtido a partir do LCC. A síntese química usou como base a Diazotização do Ácido Sulfanilico (Allinger, 1976 ) e foi utilizado o cardanol hidrogenado como reagente obtendo o produto (P2). Foram realizadas modificações químicas na estrutura do anel aromático do cardanol através de reações específicas. Seu potencial fungicida pôde ser observado com um percentual de inibição micelial de até 42,77% tendo disposição para produção de um biocida, A toxicidade foi avaliada sobre a Artemia salina. Finalmente o P2 foi caracterizado pelas técnicas de Ressonância Magnética Nuclear (RMN) de 13C e 1H.
Palavras chaves
Fungicida; Cardanol Hidrogenado; Lasiodiplodia Theobromae.
Introdução
O líquido da casca da castanha do caju, o LCC, é um dos produtos obtidos da indústria de processamento da castanha de caju que normalmente é descartado. Neste material encontra-se o cardanol que tem sido utilizado como agente precursor de novas moléculas com atividade antifúngica. Modificações químicas, no anel benzênico ou na cadeia lateral do cardanol, resultam em substâncias com características diferentes e/ou aumento de potenciais pré- existentes. (Oliveira, 2015). A cromatografia é um método físico-químico de separação. Fundamenta-se na migração diferencial dos componentes da mistura, com base nas suas diferentes interações, entre duas fases imiscíveis, a fase estacionaria e a móvel (Degani, 1995). O fungo Lasiodiplodia theobromae é um fitopatógeno considerado um dos agressores mais resistentes das regiões tropicais (Freire, 2004) atacando culturas de plantas. Diversos trabalhos tentam correlacionar a toxicidade sobre A. salina com atividade antifúngica (MACRAE, 1988). Neste cenário, objetivou-se a criação de uma síntese orgânica que produzisse análogos do cardanol com potenciais semelhantes ao seu percursor, para a sua implementação em pesquisas de novos biocidas que diminuíssem o uso de substancias nocivas a saúde e ao meio ambiente.
Material e métodos
Com o LCC bruto foi realizado a uma reação de hidrogenação catalítica utilizando um catalizador níquel-Raney durante 5 horas, a uma temperatura de 170 ºC sob agitação constante, obtendo-se então um sólido de cor marrom. Após a reação, foi realizada sua purificação em uma coluna cromatográfica, onde a fase estacionaria era gel de sílica e a fase móvel o solvente Hexano. Foram obtidas 10 frações que comparadas por CCD foram reunidas segundo sua constituição obtendo então o cardanol hidrogenado (Oliveira, 2007). Na reação que teve como base a Diazotização do Ácido Sulfanilico (Allinger, 1976), é formado o sal de diazônio que reage com o cardanol formando o P2. Depois da síntese o P2 foi analisado por RMN de 1H e de 13C. Para o ensaio de toxicidade, pesou-se 20 mg do P2 e realizou-se as diluições em series do mesmo com água salina em copos plásticos, obtendo assim as concentrações finais de 1000, 100, 10 e 1 μg/mL. Posteriormente transferiu-se 10 larvas de A. salina. para cada copo. Depois de 24 horas, fez-se a contagem do número de larvas sobreviventes. O teste foi realizado em triplicata, sendo o P2 diluído em Tween. Os produtos sintetizados foram solubilizados em meio Ágar Sabouraud Dextrose, em placas de Petri de 9,0 cm que posteriormente foram inoculadas com um disco de micélio do fungo. O ensaio foi feito em triplicata de produto/fungo. Para a avaliação da inibição do crescimento micelial normal, utilizou-se uma placa padrão inoculada com o fungo contendo apenas o meio de cultura. Mediu-se o diâmetro das colônias três dias sob a incubação a 25ºC. Utilizou-se a formula de porcentagem de inibição do crescimento micelial (PIC) proposta por Menten (1976), onde PIC=CRTE- CRT/CRTE, sendo CRTE é o crescimento radial da testemunha e CRT é o crescimento radial de tratamento.
Resultado e discussão
No ensaio da atividade fungicida, os resultados obtidos foram comparados com
um padrão composto pela testemunha que apresenta o PIC de 100%. Produto 2 -
Concentração/tempo. Na concentração de 1400 ppm, PIC de 28,32% em 24hs,
21,32% em 48hs, 28,43% em 72hs. Na de 1100 ppm, 42,77% em 24hs, 40,07% em
48hs, 33,75% em 72hs. Na de 800 ppm, 31,44% em 24hs, 25,64% em 48hs, 30% em
72hs. Na de 500 ppm, 37,03% em 24hs, 26,65% em 48hs, 23,60% em 72hs. Na de
200 ppm, 30,85% em 24hs, 14,57% em 48hs, 26,71% em 72hs.
Ao analisarmos os resultados, observamos que o P2 apresentava melhor
percentual de inibição na concentração de 1100 ppm, apresentando um PIC de
42,77% em 24 horas e 40,07% em 48 horas de incubação. No teste de toxicidade
observou-se a mortalidade de 88,33% das larvas. A eficiência da síntese foi
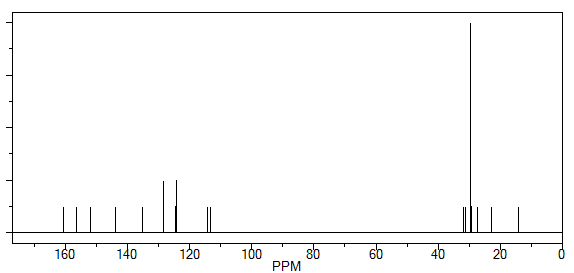
comprovada por RMN de 1H e 13C. A figura 1 revelou na região de aromáticos 3
singletos de δ = 160.5, 135.1 e 143.8 ppm referentes ao cardanol
hidrogenado. E também na região do aromático revelou outros 2 singletos de δ
= 156.5 e 152.0 ppm os carbonos ligados ao grupo amino e ao sal de diazonio.
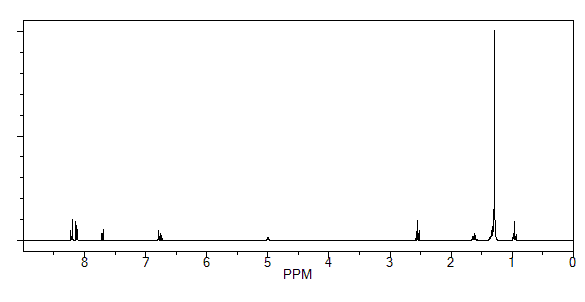
A figura 2 revelou uma junção de tripletos formando um sinal bem pronunciado
de δ = 1,33 a 1,29 ppm indicado uma cadeia de carbonos hidrogenados do
cardanol. Na região do aromático nota-se 3 dubletos de δ = 8,13, 8,13 e 8,21
pppm indicando o anel onde ligou-se um grupo amino e o sal de diazônio.
Conclusões
Com este trabalho, verificou-se a eficiência positiva do P1. As técnicas experimentais empregadas (RMN 13C, 1H) foram adequadas para a caracterização do produto, não restando receio quanto a sua obtenção. A atividade fungicida nas concentrações testadas sobre o fungo L. theobromae, apresentou o percentual de inibição com uma maior disposição para produção de uma biocida, inibindo em até 42,77% do crescimento micelial. A DL50 foi < 10 µ/mL, o composto apresentou-se altamente tóxico para a Artemia salina indicando o potencial fungicida.
Agradecimentos
A UECE, ao SISNABIO, a PRAE e ao NUGEM.
Referências
Abreu, K. V. Síntese e Caracterização de um Antioxidante Organofosforado Derivado do Líquido da Casca da Castanha de Caju (LCC), p 16, 21 e 22, 2007.
Allinger, N. L.; Cava, M. P.; Johnson, C. R.; Lebel, N. A.; Stevens, C. L. Química Orgânica, 2ª ed, p 529-533, 1976.
Degani, A. L. G.; Cass, Q. B.; Vieira, P. C.; Química Nova, 1995, 7, 21.
FREIRE, F.C.O., VIANA, F.M.P., CARDOSO, J.E. & SANTOS, A.A. Novos hospedeiros
do fungo Lasiodiplodia theobromae no estado do Ceará. Comunicado Técnico 3º 91.
Fortaleza. Embrapa Agroindústria Tropical, 2004
MACRAE, W. D.; Hudson, J. B.; Towers, G. H. N.; J. of Ethnopharm. 22,p 143, 1988.
MENTEN, J. O. M.; MACHADO, C. C.; MINUSSI, E.; CASTRO, C.; KIMATI, H. Efeito de Alguns fungicidas no crescimento micelial de Macro-phomina phaseolina (TASS.) GOID. “In vitro”, Fitopatologia Brasileira, v.1, n.2, p. 57-66, 1976.
Oliveira, L. D. M. SÍNTESE, CARACTERIZAÇÃO E FUNCIONALIDADE DE
ADITIVOS DE LUBRICIDADE, DERIVADOS DO LCC, p 49-50, 2007.
Oliveira, M. R. F. ATIVIDADE INSETICIDA DE DERIVADOS DO CARDANOL SOBRE LIRIOMYZA SP. (DIPTERA: AGROMYZIDAE) E BEMISIA TABACI BIÓTIPO B (HEMIPTERA: ALEYRODIDAE), pg 14-15, 2015.











