ISBN 978-85-85905-19-4
Área
Alimentos
Autores
Becker, M.M. (BIONORTE-UFMA) ; Silva, F.E.P.S. (UFMA) ; Mandaji, C.M. (UFMA) ; Medeiros, I.J.S. (UERR) ; Malta, T.A. (ESTÁCIO DE SÁ) ; Souto, L.A.S. (UFMA) ; Moraes, J.F. (UFMA) ; Mendes, T.M.F.F. (UFRR) ; Nunes, G.S. (UFMA)
Resumo
Cobre e manganês são microminerais essenciais ao organismo humano, sendo as frutas suas fontes naturais. Considerando a importância na nutrição humana, os teores de Cu e Mn foram quantificados simultaneamente por ICP-OES em nove frutos da Amazônia brasileira, e seus potenciais nutricionais avaliados. Os teores encontrados nos elementos sugerem que os frutos abiu, buriti e pajurá são fontes em Cu e monguba e uxi possuem alto teor; açaí e buriti possuem alto teor em Mn, e uxi é fonte natural nesse elemento. Os resultados representam novas informações sobre frutos da Amazônia brasileira, alguns ainda inexplorados, e sugerem sua inserção na dieta alimentar, por contribuírem com microminerais essenciais.
Palavras chaves
frutas amazônicas; microminerais; essencialidade
Introdução
Os minerais, originários sobretudo do solo e da água, são absorvidos pelas plantas e chegam ao homem através do consumo destes. No organismo humano formam os tecidos corpóreos, atuam na ativação e regulação enzimática, no controle de impulsos nervosos e em outras funções vitais (SMOLIN; GROSVENOR, 2007). Classificados como microminerais essenciais, as espécies químicas cobre e manganês são requeridas diariamente em pequenas quantidades, baseadas no consumo mínimo/máximo admitidos, a fim de prevenir deficiências que possam impedir o bom funcionamento do organismo, e evitando também a toxicidade, uma vez que o excesso e/ou deficiência desses minerais podem levar a desordens no sistema fisiológico e enfermidades (SHILS; OLSON; SHIKE, 1994). Estudos nutricionais demonstram que os níveis de ingestão diária recomendada (IDR) de cobre e manganês, para um homem adulto sadio, são de 0,9 mg e 2,3 mg, respectivamente (INSTITUTE OF MEDICINE, 2006). Os benefícios do cobre na nutrição humana incluem a manutenção da estrutura óssea, do sistema nervoso central e a absorção do ferro (VAITSMAN; DUTRA; AFONSO, 2001). A ingestão em quantidades insuficientes contribuem para o desenvolvimento de doenças cardiovasculares, infecções microbianas e anemias, enquanto seu excesso está relacionado à esclerose, asma, hipertensão, depressão, convulsões, necrose do fígado e problemas cardiorrespiratórios (PEDROZO, 2003; GOLDHABER, 2003). O manganês, por sua vez, atua no controle dos níveis de glicose, na proteção das células contra os radicais livres e nas atividades neuro-hormonais. Além disso, participa da formação e crescimento do feto e, provavelmente, combate o diabetes e a esquizofrenia (PEDROZO, 2003). O excesso deste elemento está relacionado às anormalidades nos pulmões e no cérebro (GOLDHABER, 2003). Diante desse contexto, e considerando que as frutas são fontes naturais em minerais, este trabalho visa avaliar o potencial nutricional de nove frutos nativos da Amazônia brasileira quanto à essencialidade e/ou toxicidade em cobre e manganês nos limites de tolerância fisiológicos.
Material e métodos
Os reagentes utilizados foram de grau de pureza analítica e a água utilizada foi deionizada. Os materiais utilizados foram previamente descontaminados em HNO3 a 10% (v/v) por no mínimo 24 h. Nove frutos nativos da Amazônia brasileira foram adquiridos em seus ambientes de produção nos Estados de Roraima, Amazonas e Maranhão: abiu (Pouteria caimito), açaí (Euterpe oleracea), biribá (Rhollinea orthopetala), buriti (Mauritia vinífera), cupuaçu (Theobroma grandiflorum), inajá (Maximiliana maripa), monguba (Pachira aquatica), pajurá (Couepia bracteosa) e uxi (Saccoglotis uchi). Os frutos foram devidamente acondicionados, identificados e transportados ao laboratório. As amostras foram então lavadas em água corrente e em água deionizada, despolpadas, maceradas em gral de porcelana, homogeneizadas e refrigeradas a -20 °C. Foram tomadas porções de 0,2-0,5 g das amostras homogeneizadas, e adicionados sequencialmente 5,0 mL de HNO3 concentrado, 2,0 mL de H2O2 a 30% (v/v) e 0,5 mL de ítrio (Y) a 100 mg L-1, o qual foi usado como padrão interno. A mistura obtida foi homogeneizada e submetida a digestão em forno microondas (MARSX press 6.0), de acordo com o método estabelecido pela AOAC (2002). O digerido foi diluído com água deionizada para 25,0 mL e filtrado em papel de filtro quantitativo (28 μm) antes das análises dos teores dos minerais. As determinações dos elementos foram feitas por Espectrometria Ótica com Plasma Indutivamente Acoplado (ICP-OES) (Shimadzu, modelo 9820, com nebulizador concêntrico), sob 1,2 kW de potência, 10 L min-1 de argônio e comprimentos de onda de 327,396 nm e 383,826 nm, para o Cu e o Mn, respectivamente. As curvas analíticas foram definidas para 7 valores de concentração, obtidos a partir da diluição de soluções padrão a 1000 mg L-1 em 2 % (v/v) de HNO3. Os critérios para avaliação da eficiência do método analítico foram baseados nas seguintes figuras de mérito: melhores respostas analíticas da razão sinal/ruído; precisão, baseada no desvio padrão relativo (RSD) para três determinações; sensibilidade, com base nos limites de detecção (LOD) e quantificação (LOQ) para dez determinações dos brancos (SKOOG, 2008), e exatidão, mediante ensaios de recuperação em dois níveis de concentrações.
Resultado e discussão
O método analítico mostrou-se preciso, com valores de RSD variando de
2,15 a
9,63 %, e de 2,42 a 8,45 %, para as determinações do Cu e Mn,
respectivamente. As faixas lineares instrumentais foram de 0,03125 a 2,0
mg
L-1 para o Cu e de 0,01875 a 1,2 mg L-1 para o Mn.
Os
valores de LOD e LOQ para o Cu foram de 4,0 10-4 e 17,0
10-4 mg L-1, e para o Mn, de 7,12 10-6
e
1,2 10-5 mg L-1, respectivamente. Índices de
recuperação médios de 106,25 e 99,35 % foram obtidos para Cu e Mn,
respectivamente.
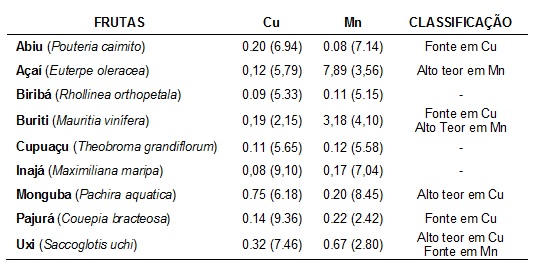
As concentrações médias de Cu e Mn (mg/100g de amostra) e seus
respectivos
RSD, bem como a classificação dos frutos como fonte nutritiva são
apresentados na Tabela 1.
A avaliação nutricional das amostras estudadas foi feita tendo como base
o
Relatório Técnico do Ministério da Saúde (BRASIL, 1998), o qual
classifica
um alimento como fonte em determinado mineral, quando 100 g deste
apresentar
de 15 a 29 % de sua IDR, e um alimento de alto teor mineral, quando este
apresentar mais que 30 % da sua IDR.
Avaliando a classificação mineral em relação a ingestão de cobre,
observa-se
que as polpas do abiu, buriti e pajurá podem ser
classificadas como fontes, por atenderem 22,3 %, 17,7 %, 21,3 % e 15,6 %
da
IDR, respectivamente. As sementes de monguba e a polpa de
uxi
mostraram-se com alto teor em cobre, contribuindo com 83,0 e 35,7 % da
IDR,
respectivamente. Neste sentido, a inserção desses frutos na dieta seria
bastante interessante, já que atenderia recomendações diárias e ao mesmo
tempo evitaria danos à saúde causados por deficiência em cobre.
Em relação ao manganês, a polpa de uxi pode ser classificada como
fonte natural (29 % da IDR) e as polpas de açaí e buriti
revelaram-se com alto teor nesse micromineral, excedendo 100 % da IDR.
Apesar da grande quantidade de manganês fornecida através do consumo de
100
g das polpas de açaí e buriti estudadas, observa-se que os
resultados das concentrações são inferiores ao nível máximo de ingestão
tolerável (11 mg/dia). Além disso, deve-se considerar que apenas 3 a 5 %
do
manganês ingerido é efetivamente absorvido pelo organismo e
disponibilizado
para as funções metabólicas normais, uma vez que uma grande parcela é
excretada pelas fezes via bile (INSTITUTE OF MEDICINE, 2006; MARTINS;
LIMA,
2001). Logo, a efetiva inclusão dessas frutas na dieta alimentar traria
diversos benefícios, como nos processos de formação dos ossos, na função
reprodutiva e no metabolismo de carboidratos e lipídeos (INSTITUTE OF
MEDICINE, 2006).
As concentrações obtidas para as polpas de biribá, cupuaçu
e
inajá podem contribuir para atingir a IDR em cobre e manganês
através
de complementações minerais de outros alimentos.
Ainda que uma comparação entre resultados seja complexa, em virtude das
concentrações dependerem de fatores inter-relacionadas como genética,
solo,
clima, estágio de maturidade da planta e biodisponibilidade (PEDROZO,
2003),
comparando os valores obtidos com algumas referências da literatura,
pode-se
verificar que as concentrações de Cu para o açaí e Mn para o
abiu mostraram certa concordância com os dados apresentados na
TACO
(2006), enquanto que os teores de Mn para o açaí, de Cu para o
abiu, e de Cu e Mn para o cupuaçu e o buriti estão
acima dos valores listados na TACO (2006) e também reportados por
Manhães e
Sabaa-Srur (2011). Por outro lado, os teores de Cu e Mn para o
biribá, pajurá e uxi estão abaixo dos valores
relatados
em outros estudos (SMITH et al., 2013; BERTO et al., 2015). Não foram
encontradas referências na literatura relacionadas aos teores desses
minerais em polpas de inajáe sementes de monguba.
Teores de Cu e Mn nos frutos da Amazônia brasileira e sua classificação em relação à essencialidade mineral.
Conclusões
Os resultados aqui apresentados fornecem novas informações sobre microminerais em frutas nativas da região Amazônica, algumas inexploradas, sendo que tais informações serão úteis não só para a construção de uma base de dados de composição mineral desses alimentos, como também na sua popularização em outras regiões do Brasil e do mundo. A avaliação do potencial nutricional dos frutos selecionados permitiu classificá-los como sendo de elevado teor ou mesmo fonte em cobre e/ou manganês, destacando-se os frutos abiu, açaí, buriti, monguba, pajurá e uxi. De um modo geral, a inclusão dessas frutas na dieta alimentar brasileira é recomendada, uma vez que estas apresentaram concentrações de cobre e manganês em quantidades que podem contribuir para correções nutricionais e prevenir enfermidades. O conhecimento desta composição certamente auxiliará os consumidores na escolha dos alimentos, bem como contribuirá para a orientação nutricional por especialistas com princípios de desenvolvimento local e diversificação na alimentação.
Agradecimentos
Referências
AOAC. ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTS. Determination of Lead, Cadmium, Zinc, Copper and Iron in Foods. Atomic Absorption Spectrophotometry after Microwave Digestion. AOAC, Official Methods. 999.10. AOAC, Rockville, MD, 2002.
BERTO, A., SILVA, A. F. DA S., VISENTAINER, J. V., MATSUSHITA, M., DE SOUZA, N. E. Proximate compositions, mineral contents and fatty acid compositions of native Amazonian fruits. Food Research International. 77, 441–449, 2015.
BRASIL. Ministério da Saúde. Secretaria de Vigilância Sanitária. Regulamento técnico referente à informação nutricional complementar. Portaria N° 27 de 13 de jan. 1998.
GOLDHABER, S. B. Trace element risk assessment: essentiality vs. toxicity. Regulatory Toxicolology and Pharmacology, v.38, p. 232-242, 2003.
INSTITUTE OF MEDICINE. Dietary reference intakes: The essential guide to nutrient requirements. Washington, D.C.: The National Academy Press, 2006.
MANHÃES, L. R. T.; SABAA-SRUR, A. U. O. Centesimal composition and bioactive compounds in fruits of buriti collected in Pará. Ciência e Tecnologia de Alimentos, v. 31, n. 4, p. 856-863, 2011.
MARTINS, I.; LIMA, I. V. Ecotoxicologia do manganês e seus compostos. Cadernos de referência ambiental. v 7, 2001.
PEDROZO, M. F. M. In: AZEVEDO, F. A.; CHASIN, A. A. M. Metais: gerenciamento da toxidade. Ed. Atheneu, São Paulo, 2003.
TACO. Tabela Brasileira de Composição de Alimentos-TACO/NEPA-UNICAMP.- Versão II., 2ª ed. São Paulo: Campinas, 2006.
SHILS, M. E.; OLSON, J. A.; SHIKE, M. Modern nutrition in health and disease. 8 ed. Philadelphia: Lea & Fibiger, v.2, 1994.
SMITH, R. E.; TRAN, K.; RICHARDS, K. M.; LUO, R. Bioactive Acetogenins in Brazilian Fruits. Revista Magistra, 26, 626, 2014.
SKOOG, D. A., WEST, D. M., HOLLER, F. J., CROUCH, S.R. Fundamentos de Química Analítica, 8ª edição, Thomson Learning, São Paulo, 2008.
SMOLIN, L. A.; GROSVENOR, M. B. Nutrition: science and applications with bloklet package. John Wiley & Sons Inc, 2007.
VAITSMAN, D. S.; DUTRA, P. B.; AFONSO, J. C. Para que servem os elementos químicos. Editora Interciência. Rio de Janeiro, 2001.











