ISBN 978-85-85905-19-4
Área
Alimentos
Autores
Braga, E.M. (INSTITUTO FEDERAL DO AMAPÁ) ; Alves, A.S. (INSTITUTO FEDERAL DO AMAPÁ) ; Santos, K.L.B. (UNIVERSIDADE FEDERAL DO AMAPÁ) ; Sá, P.R.C. (INSTITUTO FEDERAL DO AMAPÁ)
Resumo
A vitamina C é um nutriente muito importante para o ser humano, sendo de extrema importância o seu consumo diário. Assim, este trabalho tem por objetivo identificar e comparar a quantidade de ácido ascórbico em comprimido vitamínico, suco de laranja natural e industrializado a fim de comparar a quantidade contida em cada um deles. O experimento foi realizado no laboratório do Instituto Federal do Amapá e desenvolvido através da iodometria. Entre as soluções analisadas, a vitamina líquida foi a que mais consumiu solução de iodo (74 gotas) e a que menos consumiu foi a do suco industrializado (09 gotas). Observou-se que o suco de laranja industrial contém uma menor quantidade de vitamina C, tendo que ser consumida em maior volume para suprir o valor mínimo de consumo diário.
Palavras chaves
ácido ascórbico; titulação iodométrica; experimento
Introdução
As vitaminas são grupos de substâncias heterogêneas constituintes dos alimentos, eficientes em quantidades mínimas e essenciais à vida. (ROSA et al, 2007). A vitamina C é um nutriente muito importante para o ser humano, sendo de extrema importância o seu consumo diário. De acordo com (COUTO & CANNIATTI-BRAZACA, 2010), ela participa da síntese de colágeno, atua como antioxidante, facilita a absorção de ferro no trato intestinal e promove a prevenção e cura de resfriados. Quando a alimentação humana é deficiente em vitamina C, pode ocorrer a síntese defeituosa do tecido colagenoso e o desenvolvimento da doença conhecida como escorbuto, tendo como sintomas gengivas inchadas e com sangramento, dentes abalados e suscetíveis a quedas e sangramentos subcutâneos. (SNYDER apud FIORUCCI; SOARES; CAVALHEIRO, 2002). Existem alguns métodos para a determinação de vitamina C baseados em sua facilidade de oxidação e consequentemente a perda de suas funções, tornando ao grupo fortemente redutor, conforme Skoog et al (2006), as titulações redox com iodo são largamente utilizadas para determinar o ácido ascórbico. Tendo em vista a grande importância do consumo da vitamina C no dia a dia do ser humano, vê-se essencial o seu estudo e identificação nos produtos naturais e industrializados a fim de demonstrar e comprovar qualitativamente e quantitativamente a sua presença. Segundo Skoog et al (2006), é importante determinar as concentrações de ácido ascórbico em todos os níveis em frutas, vegetais e preparações comerciais de vitaminas. Assim, este tem por objetivo identificar e comparar a quantidade de ácido ascórbico em comprimidos vitamínicos (efervescentes e em gotas), suco de laranja natural e industrializado a fim de demonstrar a quantidade de Vitamina C.
Material e métodos
O experimento foi realizado no laboratório de orgânica e bioquímica do Instituto Federal do Amapá. Os materiais e equipamentos utilizados foram os descritos a seguir: Ácido L- ascórbico P.A.; 1 comprimido efervescente de 1 g de vitamina C; Suco de laranja natural; Suco de laranja industrializado; Vitamina C líquida; Amido Solúvel P. A;. Tintura de iodo a 2% (Comercial); Água destilada; 15 Beckers 50ml; 3 beckers 100ml; 1 becker 500 ml; 1 proveta 1000ml; 1 termômetro; 3 pipetas;1 chapa aquecedora; 1 vidro de relógio; 1 espátula; 1 balança analítica; 1 suporte. Inicialmente fez-se o preparo da solução de amido em um Becker de 500 ml com 400 ml de água destilada aquecida a 50 ºC e 40g de amido solúvel. Para que as soluções a serem analisadas ficassem com concentrações iguais a 1g/L cada, dissolveu-se 0,5g de ácido L-ascórbico P.A. em um Becker com água destilada até o volume de 500mL, dissolveu-se 1 comprimido efervescente em uma proveta com água destilada até o volume de 1000mL e dissolveu-se também 5ml de vitamina C líquida (segundo o fabricante com concentração de 0,05g/mL) em um Becker com água destilada até o volume de 250mL. Adicionou-se 50 ml de suco de laranja natural e 50ml de suco de laranja industrializado em beckers de 100ml. Pegou-se 5 Beckers de 50ml adicionou-se em cada 20ml da solução de amido (concentração de 100g/L) e uma alíquota de 5ml das diferente soluções (ácido L-ascórbico, sucos, solução do comprimido e vitamina liquida). Utilizando a titulação iodométrica, colocou-se em uma bureta de 50ml o iodo 2% e pingou-se gota a gota em cada um dos beckers até que toda a vitamina C fosse consumida e aparecesse uma coloração azul. Anotou-se a quantidade de gotas. Cada titulação foi feita em triplicata.
Resultado e discussão
No primeiro experimento, quando se tirou 5 ml da solução de ácido l-ascórbico, fez-
se um cálculo simples de equivalência e viu-se que havia 5 mg de ácido ascórbico na
solução. Notou-se a mudança de coloração ocorreu após a inserção de 17 gotas de iodo
(I2), ou seja, 5 mg de vitamina C necessita de 17 gotas de iodo para ser totalmente
consumida. Essa equivalência obtida foi utilizada como base para o restante dos
cálculos.
Quando a vitamina C acaba ocorre a reação do iodo com a solução amilácea,
acarretando na formação de um complexo de iodo, havendo assim, a mudança de
coloração permitindo a visualização do consumo total do ácido com o iodo (HARRIS,
2001).
Os resultados obtidos nos experimentos e após os cálculos de proporcionalidade, a
quantidade de vitamina C (mg) estão expressos na Tabela 1.
Entre as soluções analisadas e comparadas ao consumo de I2 no ácido ascórbico, a
vitamina líquida foi a que mais consumiu solução de iodo (74 gotas) e a que menos
consumiu foi a do suco industrializado (09 gotas). Quanto mais ácido ascórbico um
alimento contiver, mais rapidamente a coloração azul inicial da mistura amilácea
desaparecerá e maior será a quantidade de gotas da solução de iodo necessária para
restabelecer a coloração azul (SBQ, 2010). Então, para o aparecimento da cor azul na
vitamina liquida necessitou-se de mais gotas do que nas outras soluções devido a
maior presença de ácido ascórbico.
O indivíduo precisa manter uma reserva de 1500 mg de vitamina C, assim é necessária
a absorção de cerca de 60 mg ao dia. (FIORUCCI; SOARES; CAVALHEIRO, 2002). Pelas
médias de vitamina C calculadas (Tabela 1), nota-se que para se consumir a
quantidade mínima necessária em um suco industrializado o volume é consideravelmente
maior em relação aos outros produtos (Figura 1).
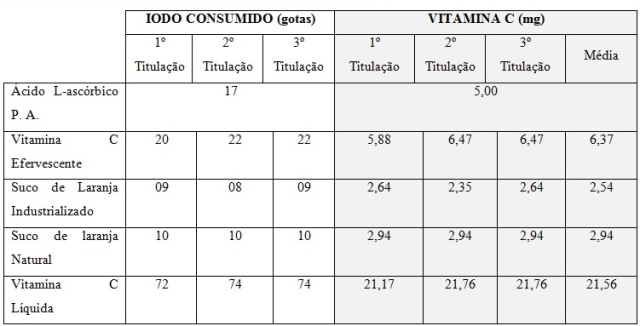
Quantidade de Iodo consumido e vitamina C encontrada.
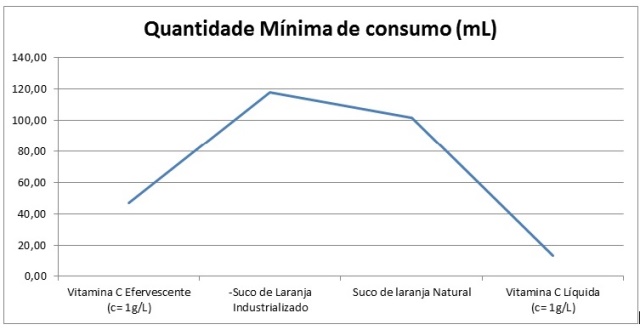
Volume necessário para consumo da quantidade mínima de Vitamina C (Soluções com c= 1g/L para o comprimido efervescente e vitamina líquida)
Conclusões
Dentro do objetivo proposto, o experimento possibilitou a determinação da quantidade de vitamina C contida nos produtos utilizados, mostrando que a titulação iodométrica é prática e eficaz. No processo de experimentação e cálculo, observou-se que o suco de laranja industrial contém uma pequena quantidade de vitamina C tendo que ser consumida em maior volume para ingerir o valor mínimo necessário para o bom funcionamento do corpo humano. Diante dos resultados, vê-se que a utilização da vitamina C líquida e comprimido efervescente podem ser consumidos em menor volume.
Agradecimentos
Referências
COUTO, M.A.L.; CANNIATTI-BRAZACA, S.G. Quantificação de vitamina C e capacidade antioxidante de variedades cítricas. Ciênc. Tecnol. Aliment., Campinas, 30(Supl.1): 15-19, maio 2010.
FIORUCCI, A. R.; SOARES, M. H. F. B.; CAVALHEIRO, E. T. G. A importância da Vitamina C na sociedade através dos tempos. Química nova na Escola. n° 17, Maio 2003.
MAHAN, L.K; ESCOTT, S. Alimentos, nutrição e dietoterapia (tradução de Krause’s food, nutrition e diet therapy, 12th ed.) São Paulo: Roca, 2010.
HARRIS, D. C. Análise Química Quantitativa. 5ª edição. Rio de Janeiro: LTC – Livros Técnicos e Científicos S.A., 2001, p. 362-371.
ROSA, J. S.; GODOY, R. L. O.; OIANO NETO, J.; CAMPOS, R. S.; MATTA, V. M, FREIRE, C. A.; SILVA,A. S.; SOUZA, R. S. Desenvolvimento de um método de análise de vitamina C em alimentos por cromatografia líquida de alta eficiência e exclusão iônica. Ciência, Tecnologia e Alimentos, Campinas, 27(4): 837-846, out.-dez. 2007.
SBQ. A química perto de você: experimentos de baixo custo para a sala de aula do ensino fundamental e médio. Sociedade Brasileira de Química, 1º ed.. São Paulo: Sociedade Brasileira de Química, 2010.
SILVA, J. L.; SANTOS, J. R. Determinação dos Teores de Vitamina C em diferentes sucos naturais e industrializados. 14º Congresso Nacional de Iniciação Científica. SEMESP, 2014. Acesso em 20 de julho de 2016. Disponível em <http://conic-semesp.org.br/anais/files/2014/trabalho-1000018130.pdf>
SKOOG, D. A, WEST, D. M., HOLLER, F. J., CROUCH, S. R. Fundamentos de Química Analítica. São Paulo: Thomson, tradução da 8ª edição, 2006.











