ISBN 978-85-85905-19-4
Área
Alimentos
Autores
Justo, T.F. (UNIVERSIDADE FEDERAL DO RIO DE JANEIRO) ; Pereira, K.S. (UNIVERSIDADE FEDERAL DO RIO DE JANEIRO) ; Moreira, D.P. (UNIVERSIDADE FEDERAL DO RIO DE JANEIRO) ; Lacerda, E.C.Q. (UNIVERSIDADE FEDERAL DO RIO DE JANEIRO)
Resumo
Cada vez mais tem se tornado crescente a procura por alimentos saudáveis e práticos. Com isso, há um estímulo pela associação de técnicas inovadoras ao processamento de frutas, como a juçara, nativa da Mata Atlântica e rica em antocianinas. Objetivou-se avaliar a cor e estabilidade química de um preparado em pó de juçara. A polpa de juçara adicionada ou não de inulina foi submetida ao processo de liofilização por 72 h e os pós obtidos armazenados à temperatura ambiente. Durante 30 dias, foram analisados os teores de antocianinas por CLAE, atividade antioxidante por FRAP e cor instrumental. Os pós mostraram-se estáveis ao longo dos 30 dias para todos os parâmetros. Dessa forma, o preparado em pó de juçara pode ser uma boa alternativa para aliar praticidade ao consumo de bebidas.
Palavras chaves
antocianinas; encapsulação; liofilização
Introdução
A busca por uma alimentação saudável aliada a praticidade é uma das principais tendências do setor alimentício atual. Frutas ricas em compostos antioxidantes são muitas das alternativas presentes no mercado, estas são consideradas alimentos funcionais, ou seja, apresentam efeitos metabólicos e fisiológicos positivos para o organismo. O Brasil possui uma grande diversidade de frutas nativas que se destacam pelo seu valor nutricional e elevado teor de compostos bioativos, como o fruto da palmeira juçara (Euterpe edulis M.). A palmeira Euterpe edulis Mart. (Arecaceae) é nativa da Mata Atlântica brasileira e é conhecida por produzir um tipo nobre de palmito. Por não produzir perfilho, a retirada do palmito dessa espécie ocasiona a morte da planta, o que devido a exploração excessiva e clandestina colocou a Euterpe na Lista Oficial das Espécies da Flora Brasileira Ameaçadas de Extinção (BRASIL, 2014). Uma alternativa de potencial econômico e ambiental para este problema é estimular o consumo da polpa do fruto da palmeira juçara, como já acontece com o açaí (E. oleraceae Mart.). O mercado para esta última já é assegurado e tem diversas aplicações, como produção de sucos, bombons, cremes, corantes, entre outras (FIGUEREDO et al., 2008). Além da polpa para consumo, ainda há a possibilidade de usar as sementes em novas plantações. De acordo com a Companhia Nacional de Abastecimento (CONAB), São Paulo, Espírito Santo, Rio de Janeiro, Santa Catarina e Rio Grande do Sul são os principais produtores do fruto da palmeira juçara, e seus preços variam entre R$1,15/Kg e R$2,50/Kg nos estados que possuem essa cultura. O gênero Euterpe tem sido alvo de estudos pelo seu elevado teor de antocianinas (um tipo de flavonoide) e potencial capacidade antioxidante (INADA et al., 2015; de BRITO et al., 2007). As antocianinas são compostos sensíveis ao calor e solúveis em água, responsáveis pelas cores rosa, vermelho, lilás, violeta e azul das flores, frutas e alguns vegetais e estão se tornando cada vez mais populares como aditivos alimentares, substituindo os corantes sintéticos (COULTATE, 2009). Apresentam propriedades associadas à alimentação saudável, por serem antioxidantes com benefícios que incluem a redução do risco de doença coronária cardíaca, proteção contra a obesidade e melhoria da memória (de BRITO et al., 2007). As principais antocianinas presentes na polpa de juçara são a cianidina-3-O-glicosídeo e a cianidina-3-O-rutinosídeo (Inada et al., 2015). Uma forma de preservar os alimentos e aumentar a sua vida útil é o método de secagem. As frutas, em geral, apresentam elevada perecibilidade, o que pode ser minimizado pela redução da atividade de água desses alimentos. A liofilização é um método de secagem que consiste em, sob vácuo, remover a água congelada do alimento por sublimação, ou seja, do estado físico sólido da água para gasoso. Como o produto é congelado, não ocorrem danos causados pelo calor, tendo menos perdas das propriedades nutricionais e sensoriais (MATA et al., 2005; JIANG et al., 2014). Além disso, a liofilização é um método utilizado para encapsulação de ingredientes alimentares que propicia a preservação do núcleo por ser feita em temperaturas reduzidas (AZEREDO, 2005). A técnica de encapsulação permite recobrir partículas de material líquido ou gasoso, formando pequenas cápsulas que liberam o conteúdo em condições específicas, de acordo com o agente encapsulante utilizado, (MENEZES et al., 2013), além de ter efeitos sobre a estabilidade de antocianinas da juçara (LACERDA et al., 2016). A inulina é um polissacarídeo solúvel da classe das frutanas, constituída por monômeros de frutose com uma unidade de glicose terminal que vem sendo utilizado como agente encapsulante (LACERDA et al., 2016). A adição desse carboidrato em alimentos também está relacionada ao realce de textura e sabor e à estabilidade, por ter capacidade de diminuir a atividade de água (CALÇARÃO, 2012). Além disso, a inulina é considerada um prebiótico, definido por Saad (2006) como “componentes alimentares não digeríveis que afetam beneficamente o hospedeiro, por estimularem seletivamente a proliferação ou atividade de populações de bactérias desejáveis no cólon”. Esses compostos possuem funções fisiológicas importantes, como a redução do risco de câncer do cólon, aumento da quantidade de folato e vitaminas do complexo B, além do controle da composição da microbiota intestinal (SAAD, 2006; ROLIM, 2015). Neste contexto, o objetivo do trabalho foi elaborar um preparado em pó de juçara pelo método de liofilização, analisar a influência da adição de inulina como agente encapsulante e avaliar sua estabilidade química.
Material e métodos
Preparo das amostras: A polpa do fruto da palmeira juçara foi adquirida comercialmente da empresa Juçaí® (Rio de Janeiro-RJ) e a inulina fornecida pela Siba Ingredientes (São Paulo-SP). Duas formulações foram preparadas: uma com adição de inulina e outra sem. De acordo com o teor de sólidos totais da polpa de juçara foi adicionada a quantidade de inulina, sendo a proporção de sólidos de polpa e inulina utilizada de 2:1 (p/p). A inulina foi adicionada a polpa de juçara sob agitação até sua completa diluição. As duas formulações foram submetidas imediatamente ao congelamento em nitrogênio líquido. As amostras congeladas foram distribuídas no Liofilizador modelo Freezone 2.5, onde permaneceram por 72h. O pó obtido foi armazenado em embalagens nylon/poli sob vácuo e acondicionadas à temperatura ambiente (22,5±2,5 ºC). Preparo dos extratos: As amostras em pó foram completamente diluídas em água Milli-Q e o líquido resultante foi filtrado em membrana de éster de celulose 0,22 μm (Millipore®, Barueri, Brasil). Análise de antocianinas por CLAE: Para análise do teor de antocianinas, os extratos obtidos foram diluídos em ácido fórmico aquoso 1%. As análises foram realizadas conforme Inada et al. (2015) em um sistema de cromatografia líquida (Shimadzu®, Tokyo, Japão), incluindo uma bomba quaternária LC-20AT, injetor automático SIL-20AHT, detector de arranjo de diodo (DAD) SPD-M20A, controlador de sistema CBM-20ª e desgaseificador DGU-20A5. Análise da capacidade antioxidante: O ensaio de FRAP foi realizado de acordo Benzie e Strain (1996) utilizando curva de calibração preparada FeSO4 como padrão. Os resultados foram expressos como μmol de Fe+2 equivalentes por grama. Cada amostra foi analisada em triplicata. Análise de cor instrumental: A cor instrumental dos preparados em pó foi determinada utilizando um colorímetro Minolta CR-400 (Konica Minolta, Osaka, Japão), com iluminante D65 e ângulo de observação de 2º. A calibração foi efetuada na cor branca antes da análise das amostras. O espaço de cor CIELab foi utilizado para determinar os componentes de cor: L* [preto (0) a branco (100)], a* [verde (−) a vermelho (+)] e b* [azul (−) a amarelo (+)]. As coordenadas L*, a* e b* foram medidas diretamente no pó, sendo realizadas duas leituras para cada amostra. Foi utilizado um valor ΔE* que demonstra o quão perceptível ao olho humano é a diferença entre as amostras. Esse valor foi calculado utilizando a equação: ΔE*= [(Lt0-Lti)2 + (at0-ati)2 + (bt0- bti)2]1/2, onde L*, a* e b* são as coordenadas de cor no tempo inicial (t0) e no enésimo dia de armazenamento (ti).
Resultado e discussão
As antocianinas identificadas por CLAE foram a cianidina-3-O-
glicosídeo e a cianidina-3-O-rutinosídeo, como pode ser observado na
Figura 1. Para as amostras sem adição de inulina, foram encontradas em média
2,24 mg de cianidina-3-O-glicosídeo/g de pó e 7,47 mg de cianidina-
3-O-rutinosídeo/g de pó. E para as amostras com adição de inulina,
foram encontradas, em média, 1,61mg de cianidina-3-O-glicosídeo/g de
pó e 5,33 mg de cianidina-3-O-rutinosídeo/g de pó. De Brito et al.
(2007) identificaram as mesmas duas antocianinas principais na polpa de
juçara. Borges et al. (2011) analisaram frutos de juçara de diferentes
regiões de Santa Catarina e encontraram teores significativos de cianidina-
3-O-glicosídeo, variando de 0,14 a 40,98 mg cianidina-3-O-
glicosídeo/ g de produto fresco entre as regiões.
Os resultados encontrados para antocianinas totais, capacidade antioxidante
e cor instrumental encontram-se na Tabela 1. Não houve diferença
significativa (p>0,05) para os teores de antocianinas totais entre os tempos
de armazenamento, demonstrando que estes foram estáveis. Silva et al. (2014)
em seu estudo com pó de jabuticaba e agentes encapsulantes maltodextrina
DE10 e goma arábica por secagem por atomização verificaram que o pó
apresentou boa retenção das antocianinas, que foi relativamente estável.
Souza et al. (2014) estudaram extratos líquidos (etanólico e concentrado) e
desidratados de subprodutos (cascas e sementes) de uvas tintas da variedade
Bordô (Vitis labrusca) verificando que a degradação de antocianinas
foi significativamente menor em amostras que sofreram o processo de secagem.
Além disso, Murali et al. (2014) demonstraram em seus estudos com suco de
cenoura preta que, com o aumento da temperatura de secagem (para o caso de
secagem por atomização), há um aumento da degradação das antocianinas.
Quando compararam o processo de atomização com temperatura de entrada de
150ºC e o de liofilização, obteve teores significativamente maiores de
antocianinas para o último processo.
A amostra sem adição de inulina apresentou, desde o tempo zero, maiores
teores de antocianinas (p<0,05). Esse resultado confere com o estudo feito
por Tonon et al. (2009), que analisaram o teor de antocianinas em
micropartículas de açaí com diferentes concentrações de agentes
encapsulantes. A adição e/ou aumento da concentração desses materiais
resultam em uma “diluição” dos pigmentos, resultando em menores teores de
antocianinas.
A atividade antioxidante avaliada pelo ensaio FRAP também não mostrou
diferença estatística significativa (p>0,05) com relação ao tempo de
estocagem. A amostra sem adição de inulina apresentou maior atividade
antioxidante em relação à amostra adicionada de inulina. Esse resultado pode
ser atribuído pelos maiores teores de antocianinas encontrados na formulação
sem adição de inulina. Lichtenthäler et al. (2005), mostraram que, para o
açaí (Euterpe oleracea), os valores da capacidade antioxidante são em
torno de 11 vezes maior do que aquelas esperadas para capacidade
antioxidante da mesma concentração de cianidina-3-O-glicosídeo e
cianidina-3-O-rutinosídeo utilizadas como padrão. Assim, a capacidade
antioxidante pode ser elevada devido a outros compostos não identificados.
Quanto à cor instrumental, as amostras apresentaram uma coloração próxima da
cor roxa. Não houve diferença estatística significativa entre as coordenadas
de cor (L*, a* e b*) ao longo do tempo
analisado para ambas as amostras (com e sem inulina). Ou seja, a cor
manteve-se estável ao longo dos 30 dias de armazenamento. Em seus estudos
sobre a estabilidade de corantes de antocianinas extraídas das cascas de
jabuticaba (Myrciaria spp.), Silva et al. (2010) observaram que o
pigmento de antocianinas é mais suscetível a degradação quando encontra-se
em meio líquido, tendo maior estabilidade quando os corantes estão na forma
de pó.
Óbon et al. (2009) citaram que se 0<ΔE*<1,5, a diferença entre as
cores não é perceptível a olho humano. Se 1,5<ΔE*<5,0, a
diferença pode ser percebida. E se ΔE*>5,0, a diferença entre as
cores é evidente. Assim, para os valores encontrados para cada tempo de
armazenamento de cada amostra, não houve diferença que pudesse ser percebida
aos olhos. Já quando comparados os tipos de amostra, o valor obtido para
ΔE* no tempo zero foi de 3,24; em 7 dias foi de 2,52; em 15 dias
foi de 2,83; e em 30 dias foi de 1,87. Esses valores se encontram entre 1,5
e 5,0; mostrando que poderia ser percebida uma pequena diferença entre as
cores da amostra com e sem inulina, que pode ser dada também pela adição da
cor branca da inulina à polpa.
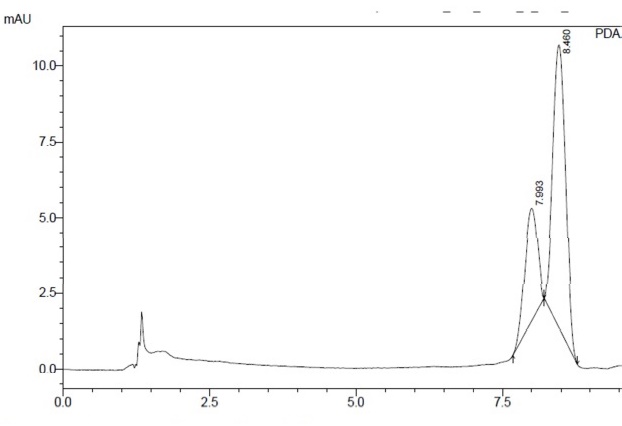
Cromatograma típico da análise por CLAE das antocianinas identificadas no preparado em pó de juçara.
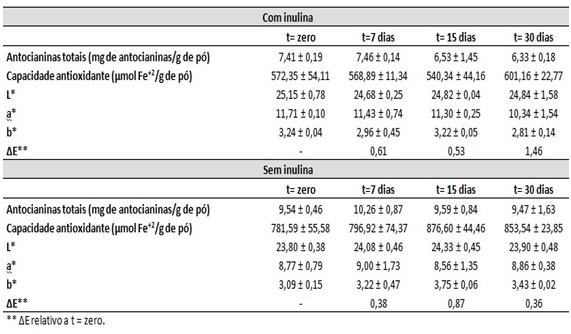
Teor de antocianinas totais, capacidade antioxidante e coordenadas de cor ao longo do tempo de 30 dias para as amostras com e sem adição de inulina.
Conclusões
De acordo com os resultados obtidos, em um período de 30 dias, ambos os tipos de amostras mantiveram-se estáveis quanto ao teor de antocianinas totais, atividade antioxidante e cor instrumental. Dessa forma, o preparado em pó de juçara é uma boa alternativa para elaboração de misturas que resultem em alimentos e/ou bebidas com alegações de saúde, contendo as antocianinas como antioxidantes e a inulina como prebiótico, possibilitando a adição de probióticos para formulação de um alimento simbiótico.
Agradecimentos
À empresa Juçaí e à Universidade Federal do Rio de Janeiro (UFRJ).
Referências
AZEREDO, H.M.C. Encapsulação: Aplicação à tecnologia de alimentos. Alimentos e Nutrição, v. 16, n. 1, p. 89-97, 2005.
BENZIE, I.F.F.; STRAIN, J.J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant Power”: The FRAP assay. Analytical Biochemistry, v. 239, n. 1, p. 70-76,1996.
BORGES, G.S.C.; VIEIRA, F.G.K.; COPETTI, C.; GONZAGA, L.V.; ZAMBIAZI, R.C.; FILHO, J.M.; FETT, R. Chemical characterization, bioactive compounds, and antioxidant capacity of jussara (Euterpe edulis) fruit from the Atlantic Forest in southern Brazil. FoodResearchInternational, n. 44, p. 2128-2133, 2011.
BRASIL. Ministério do Meio Ambiente. Portaria nº 443, de 17 de dezembro de 2014. Lista Oficial das Espécies da Flora Brasileira Ameaçadas de Extinção. Brasília: Diário Oficial da União, edição 245, seção 1, p. 111, 18 de dezembro de 2014.
CALÇARÃO, L.M.T. Enriquecimento de polpas de frutos em inulina: polpas prebióticas. 2012. 78 f. Dissertação (Mestre em Engenharia Alimentar) – Instituto Superior de Agronomia, Universidade Técnica de Lisboa, Lisboa.
CONAB. Companhia Nacional de Abastecimento. Proposta de preços mínimos: safra
2015/2016 – produtos da sociobiodiversidade. 2015. 162 f. Disponível em:
http://www.conab.gov.br/OlalaCMS/uploads/arquivos/15_08_19_09_15_16_proposta_preco_ minimo_-_sociobiodiversidade.pdf .Acessoem 18 mar 2016.
COULTATE, T.P. Food – The chemistry of its components.5th edition. London. Ed. RSCR. Soc. Chem. Cambridge, 2009, cap. 6, p. 227-233.
DE BRITO, E. S.; DE ARAUJO, M. C. P.; ALVES, R. E.; CARKEET, C. C.;
CLEVIDENCE, B.; NOVOTNY, J. Anthocyanins present in selected tropical fruits: Acerola, jambolão, jussara e guarabiju. Journal Agricultural and Food Chemistry, v. 55, p. 9389-9394, 2007.
FIGUEREDO, M.J.M.; FERREIRA, T.A.; SILVA, A.R.Z.; HELM, C.V.; HANSEL, F.A. Metodologia para obtenção de antocianinas de frutos de juçara (Euterpe edulis). Comunicado Técnico 209 - Embrapa. Paraná. 2008.
INADA, K.O.P ; OLIVEIRA, A. A. ; SILVA, T. B. R. ; MARTINS, A. B. N. ; LACERDA, E. C. Q. ; FREIRE, A. S. ; BRAZ, B. F. ; SANTELLI, R. E. ; TORRES, A. G. ; PERRONE, D. ; MONTEIRO, M. C. . Screening of the chemical composition and occurring antioxidants in jabuticaba (Myrciariajaboticaba) and jussara (Euterpe edulis) fruits and their fractions. Journal of Functional Food, v. 17, p. 422-433, 2015.
JIANG, H.; ZHANG, M.; MUJUMDAR, A.S.; LIM, R.X. Comparison of drying chacarteristic and uniformity of banana cubes dried by pulse-spouted microwave vacuum drying, freeze drying and microwave freeze drying. Journal of the Science of Food and Agriculture, v.94, p. 1827-1834, 2014.
LACERDA, E.C.Q.; CALADO, V.M.A.; MONTEIRO, M.; FINOTELLI, P.V.; TORRES, A.G.; PERRONE, D. Starch, inulin and maltodextrin as encapsulating agents affect the quality and stability of Jussara pulp microparticles. Carbohydrate Polymers, v.151, p. 500-510, 2016.
LICHTENTHALER, R.; RODRIGUES, R.B.; MAIA, J.G.S.; PAPAGIANNOPOULOS, M.; FABRICIUS, H.; MARX, F. Total oxidant scavenging capacities of Euterpe oleracea Mart. (açaí) fruits. International Journal of Food Sciences and Nutririon, v. 56, n.1, p.53-64, 2005.
MATA, M.E.C.; DUARTE, M.E.M.; ALSEMO, G.C.S.; RODRIGUES, E.; GUEDES, M.A.; CAVALCANTI, A.S.; OLIVEIRA, C.C.A. Obtenção de graviola em pó pelo processo de liofilização. Revista Brasileira de Produtos Agroindustriais, v. 7, n. 2, p. 165-172, 2005.
MENEZES, C. R., BARIN, J. S., CHICOSKI, A. J., Zepka, L. Q., Jacob-Lopes, E., Fries, L. L. M., &TerraI, N. N. Microencapsulação de probióticos: avanços e perspectivas. CiênciaRural, v. 43, n. 7, p. 1309-1316, 2013.
MURALI, S.; KAR, A.; MOHAPATRA, D.; KALIA, P. Encapsulation of Black carrot juice using spray and freeze drying. Food science and technology international, v. 21, n.8, p.604-612, 2014.
OBÓN, J. M., CASTELLAR, M. R., ALACID, M., FERNANDEZ-LOPEZ, J. A. Production of a red–purple food colorant from Opuntiastricta fruits by spray drying and its application in food model systems. Journal of Food Engineering, 90, 471-479, 2009.
ROLIM, P.M. Development of prebiotic food products and health benefits. Food Science andTecnology, Campinas, v. 35, n.1, 2015.
SAAD, S.M.I. Probióticos e prebióticos: o estado da arte. Revista Brasileira de Ciências Farmacêuticas, v.42, n.1, 2006.
SILVA, G.J.F.; CONSTANT, P.B.L.; FIGUEIREDO, R.W.; MOURA, S.M. Formulação e estabilidade de corantes de antocianinas extraídas das cascas de jabuticaba (Myrciariassp.). Alimentos e Nutrição,v.21, n.3, p. 429-436, 2010.
SILVA, M.C., SOUZA, V.B.; THOMAZINI, M.; SILVA, E.R.; SMANIOTTO,T.; CARVALHO, R.A.; GENOVESE, M.I.; FAVARO-TRINDADE, C.S. Use ofthe jabuticaba (Myrciaria cauliflora) depulpingresiduetoproduce a natural pigmentpowderwithfunctionalproperties. LWT – Food Science and Technology, v. 55, p. 203-209, 2014.
SOUZA, V.B.; FUJITA, A.; THOMAZINI, M.; SILVA, E.R.; LUCON, J.F.; GENOVESE, M.I.; FAVARO-TRINDADE, C.S. Functional properties and stability of spray-dried pigments from Bordo grape (Vitislabrusca) winemaking pomace. Food Chemistry,v. 164, p.380-386, 2014.
TONON, R.V.; BRABET, C.; PALLET, D.; BRAT, P.; HUBINGER, M.D. Physicochemical and morphological characterisation of açai( Euterpeoleraceae Mart.) powder produced with different carrier agents.International Journal of Food Science & Technology, v. 44, p. 1950-1958, 2009.











