ISBN 978-85-85905-19-4
Área
Alimentos
Autores
Liberato, M.C.T.C. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Lima, S.M. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE) ; Lima, K.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Pereira, S.A. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Aguiar, G.M. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Frota, E.B. (UNIVERSIDADE ESTADUAL DO CEARÁ) ; Lima, P.R.S. (UNIVERSIDADE ESTADUAL DO CEARÁ - UECE)
Resumo
Foram analisados méis de abelha do Nordeste, Sudeste e Sul do Brasil quanto teor de fenóis (método de Folin-Ciocalteau), Atividade Antioxidante (pelo DPPH) e Inibição da Acetilcolinesterase (teste de Ellman adaptado por Rhee, com fisostigmina como padrão). As amostras vieram de Itapiúna; Simplício Mendes; Picos; Antas; São Felipe; Feira de Santana; Barra do Choça; Embu-Guaçu; Bebedouro; Teresópolis; Taquara; Içara ; Gramado; Bagé. Os méis de São Felipe e Bagé apresentaram melhores resultados para teor de fenóis respectivamente 228,6 ± 1,10 e 163,28 ± 3,47 mg EAG/100g. Um mel de Teresópolis apresentou atividade antioxidante de 3,93 ± 0,49 mg..ml-1 e os de Itapiúna, Feira de Santana, Teresópolis e Gramado apresentaram inibição da Acetilcolinesterase semelhante ao padrão fisostigmina: 9 mm.
Palavras chaves
MEL DE ABELHA; ANÁLISE DE PROPRIEDADES; REGIÕES BRASILEIRAS
Introdução
O Brasil possui grande potencial apícola, flora, clima diversificado e grande extensão territorial (OLIVEIRA et al, 2013). A legislação brasileira define mel como produto das abelhas melíferas, a partir da coleta e transformação do néctar das flores ou secreções de partes vivas das plantas (BRASIL, 2000). A composição é variável, pois flora, espécie de abelha produtora, condições ambientais, coleta e processamento influenciam. A flora é importante na determinação de propriedades biológicas, pela influência do teor de fenóis. Em regiões tropicais, as características do mel são pouco conhecidas, pois a flora é diversificada, com alta umidade e temperatura. Assim, a caracterização é fundamental para o conhecimento de suas propriedades levando-se em conta fatores edafoclimáticos e estabelecendo critérios comparativos de análise entre diversas regiões (FINCO; MOURA; SILVA, 2010). Atualmente a pesquisa sobre antioxidantes nos alimentos ganhou destaque, porque eles atuam na inibição dos radicais livres do metabolismo celular. Estudos mostram que eles contribuem para prevenção de doenças associadas ao envelhecimento. A Doença de Alzheimer (DA) apresenta-se como um estado de demência, comprometendo inicialmente a memória recente. Entre as terapias em uso, destaca-se a que melhora a transmissão colinérgica, pois portadores da DA possuem baixo nível de acetilcolina, neurotransmissor responsável pelo desempenho cognitivo, por baixa produção ou destruição pela Acetilcolinesterase. Os sintomas podem melhorar com uso de inibidores da enzima (SOUZA, ROSA E ELIAS, 2006). Foram analisados méis do Nordeste, Sudeste e Sul do Brasil, com o objetivo de determinar teor de fenóis, atividade antioxidante e capacidade de inibição da Acetilcolinesterase, relacionando com a região de coleta.
Material e métodos
AMOSTRAS: Analisaram-se méis de: Itapiúna – CE; Simplício Mendes–PI; Picos–PI; Antas–BA; São Felipe –BA; Feira de Santana–BA; Barra do Choça–BA; Embu-Guaçu–SP; Bebedouro–SP; Teresópolis–RJ; Taquara–RS; Içara-SC; Gramado-RS; Bagé–RS (Tabela 1). As análises foram feitas em triplicata (Tabela 2). TEOR DE FENÓIS: Usou-se o método de Folin-Ciocalteau (SINGLETON et al., 2002). Diluiu-se 5 g de cada amostra em 50mL de água destilada. Após filtração, a 0,5 mL adicionou-se 2,5mL do reagente Folin–Ciocalteau 0,2 N. Após 5 min, adicionou-se 2 mL de solução de Carbonato de Sódio (75 g/L) e após 2 horas, determinou-se a absorbância a 760 nm, contra branco de água destilada. A média foi expressa em Equivalentes de Ácido Gálico (EAG)/100g de mel. ATIVIDADE ANTIOXIDANTE: Determinada pelo método do DPPH (BRAND WILLIAMS et al., 1995). Uma alíquota de 0,75 mL de uma solução de mel (0,5 g de mel para 5 mL de metanol) foi adicionada a 1,5 mL da uma solução de DPPH (90mg/L). Após 30 min de incubação, a absorbância foi lida a 517 nm contra branco de água/metanol (1:1). % Inibição = [(absorbância do DPPH – absorbância da amostra) /absorbância do DPPH] x100. A média de 3 leituras de IC50 (concentração que causa 50% de inibição) para cada amostra foi determinada graficamente. INIBIÇÃO DA ENZIMA ACETILCOLINESTERASE (AChE): De acordo com o ensaio de Ellman et al (1961) adaptado para CCD por Rhee et al. (2001). As amostras foram solubilizadas a 2 mg/mL e aplicadas na cromatoplaca (gel de sílica, Merck). Evaporado o solvente, pulverizou-se uma mistura (1:1) das soluções DTNB e ATCI, aguardou-se a secagem; borrifou-se a enzima na concentração de 5 U/mL. Após 10 min a cromatoplaca desenvolveu cor amarela e surgiram halos brancos em torno dos spots das amostras indicando a inibição da enzima AChE
Resultado e discussão
Na determinação do teor de fenóis usou-se o Reagente de Folin-Ciocalteau, onde há uma reação de oxido-redução entre polifenóis e o reagente dando um complexo de cor azul que ao absorver radiação a 760 nm permite a quantificação dos compostos fenólicos (LIANDA, 2009). Os resultados obtidos utilizando o ácido gálico como referência estão apresentados na tabela 2 e estão de acordo com os encontrados na literatura. Bezerra (2015) obteve resultados entre 58 e 135 EAG/100g, e Costa (2014) valores entre 66,43 e 143 EAG/100g. A atividade sequestrante do radical livre DPPH foi expressa em termos de IC50 (concentração mínima necessária para o antioxidante reduzir em 50% da concentração inicial do DPPH), através da média obtida nos gráficos que relacionam o percentual de atividade contra a concentração da substância ensaiada. Desta forma, quanto menor o seu valor, maior é a capacidade antioxidante das substâncias presentes. Nos méis avaliados o melhor resultado encontrado foi no mel de Teresópolis–RJ: 3,93 mg/mL, e o valor mais elevado, correspondendo a uma menor atividade antioxidante, foi apresentado pelo mel de Antas –BA: 28,31 ± 0,36 mg/ mg/mL. Esses resultados conferem com os dados encontrados na literatura, onde Liberato et al., (2011) analisando 23 amostras de méis de Apis mellifera cearenses encontraram valores entre 4,20 a 106,72 mg/mL. Com relação à atividade antiacetilcolinesterase (tabela 2) os méis analisados apresentaram valores de inibição próximos do padrão, o alcaloide fisostigmina (9 mm). No entanto, as mais altas taxas foram obtidas pelo mel de Feira de Santana, florada Unha de Gato, o de Itapiúna, florada Silvestre e o de Gramado, florada Eucalipto. Esses méis apresentaram valor de inibição da Acetilcolinesterase igual ao padrão.

A TABELA 1 APRESENTA DADOS RELACIONADOS COM OS MÉIS ANALISADOS COMO LOCAL DE COLETA, ABELHA PRODUTORA E FLORADA.
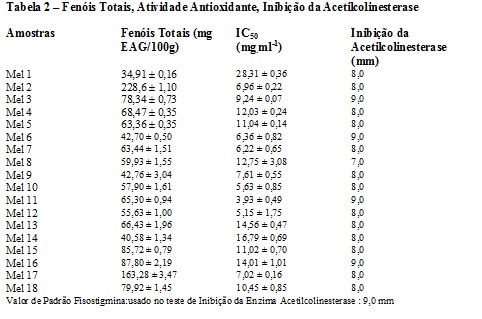
A TABELA 2 APRESENTA OS RESULTADOS DAS ANÁLISES REALIZADAS EM TRIPLICATAS: TEOR DE FENÓIS, ATIVIDADE ANTIOXIDADE E INIBIÇÃO DA ACETILCOLINESTERASE
Conclusões
O Brasil possui condições climáticas bastante diferenciadas entre as regiões em que seu território é dividido, e uma imensa e rica flora apícola quase completamente desconhecida. Condições climáticas diferenciadas influenciam na flora apresentando plantas que transferem compostos fenólicos importantes e diferenciados ao mel produzido por abelhas que habitam cada região Nesse trabalho observou-se que regiões de condições edafoclimáticas diferentes apresentam taxas expressivas de compostos fenólicos que se traduzem no potencial antioxidante e na inibição da atividade acetilcolinesterase.
Agradecimentos
AGRADECIMENTOS A FUNCAP, IC/UECE E CNPQ PELAS BOLSAS DE INICIAÇÃO CIENTÍFICA CONCEDIDAS.
Referências
BEZERRA, P. F. Caracterização de Méis das Abelhas Apis mellifera e Melipona subnitida do Semiárido Cearense. 2015. 64 f. Trabalho de Conclusão de Curso (Graduação em Química) – Centro de Ciências e Tecnologia, Universidade Estadual do Ceará, Fortaleza, 2015.
BRAND-WILLIAMS, W.; CUVELIER, M. E.; BERST, C. Use of a free radical method to evaluate antioxidant activity.LebensmittelWissenschaftUndTechnologie, v. 28, p. 25-30, 1995.
BRASIL. Ministério da Agricultura Pecuária e Abastecimento. Instrução Normativa 11, de 20 de outubro de 2000, Regulamento técnico de identidade e qualidade do mel. Diário Oficial, Brasília, 20 de outubro de 2000, Seção 001, p.16-17.
COSTA, J. W. S. Análise das Propriedades de Méis de Regiões Cearenses Com Diferentes Climas. 2014. 70 f. Trabalho de Conclusão de Curso (Graduação em Química) – Centro de Ciências e Tecnologia, Universidade Estadual do Ceará, Fortaleza, 2014.
ELLMAN, G. L.; COURTNEY, K. D.; ANDRES JR., V; FEATHERSTONE, R. M. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochemical Pharmacology, v. 7, n. 2, p. 88-90, 1961.
FINCO, F. D. B. A.; MOURA, L. L.; SILVA, I. G. Propriedades físicas e químicas do mel de Apis mellifera L. Ciência e Tecnologia de Alimentos, Campinas, p.706-712, 2010.
LIANDA, R. L. P. Perfil de Substâncias Fenólicas de Méis Brasileiros por Cromatografia Líquida de Alta Eficiência e Avaliação do Potencial Antioxidante. 2009. 185 f. Tese (Doutorado) - Curso de Programa de Pós-graduação em Química, Instituto de Ciências Exatas Departamento de Química, Universidade Federal Rural do Rio de Janeiro, Rio de Janeiro, 2009.
LIBERATO, M. C. T. C.; MORAIS, S. M.; SIQUEIRA, S. M. C.; MENEZES, J. E. A.; RAMOS, D. N.; MACHADO, L. K. A.; MAGALHÃES, I. L. Phenolic Content and Antioxidant and Antiacetylcholinesterase Properties of Honeys from Different Floral Origins.Journal of Medicinal Food, v. 14, n. 6; p. 658-663. 2011.
OLIVEIRA, E. S.; ANDRADE, C. K. O.; PINTO, M. S. C.; GALDINO, P.O.; TARGINI, L. C.; SILVA, R. A.; MARACAJÁ, P. B. Qualidade de méis de Apis mellifera produzidos no sertão paraibano. Informativo TÉcnico do Semi-Árido: GRUPO VERDE DE AGROECOLOGIA E ABELHAS, Pombal, v. 7, n. 1, p.203-208, 2013.
RHEE, I. K.; MEEN, M.; INGKANINAN, K.; VERPOORTE, R. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. Journal of Chromatography, v. 915, p. 217-223, 2001.
SINGLETON, V. L.; ORTHOFER, R.; LAMUELA-RAVENTOS, R. M. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteur Reagent. Methods in Enzymology, v. 299, p. 152-178, 2002.
SOUZA, A. C. A. R., ROSA, C. F. B. D., ELIAS, R. Doença de Alzheimer: Protocolo de Atendimento Odontológico. Centro Integrado De Saúde Profº Roberto Elias – CISPRE, 2006.











