ISBN 978-85-85905-19-4
Área
Materiais
Autores
Pinheiro, D. (UFPA) ; Pinheiro, A. (UFPA) ; Piquet, A.B. (UFPA) ; Martelli, M.C. (UFPA)
Resumo
Desenvolveu-se um método de produção de alumina de transição a partir da mistura de gibbsita, proveniente do processo Bayer, e hidróxido de alumínio gel, proveniente de reação de sulfato de alumínio e hidróxido de amônio visando a aplicação como material adsorvente para remoção de Cu2+ em solução aquosa. Foram investigadas as condições de adsorção incluindo tempo de contato e pH de solução antes e após a adsorção, além da análise das isotermas de adsorção, modelos de Langmuir e Freundlich. A caracterização das soluções de sulfato de cobre foi realizada em espectrofotometria UV e a caracterização do material produzido foi realizada através de DRX, EDX e BET. Através das isotermas de equilíbrio verificou- se que o material produzido tem boa capacidade de adsorção para o íon Cu2+.
Palavras chaves
Alumina; Adsorção; Cobre
Introdução
Uma grande preocupação ambiental é a contaminação, em ambientes aquáticos, por metais pesados, que são liberados ou transportados, principalmente como solutos ou particulados e podem alcançar elevadas concentrações, especialmente quando próximos ao lançamento. Os metais pesados são considerados como não biodegradáveis e têm grande impactos econômicos, ambientais e na saúde (Tarun et al, 2009). Um destes metais é o cobre que é encontrado na natureza principalmente como óxidos e carbonatos e no estado metálico. O cobre é um dos mais importantes e essenciais elementos, principalmente para as plantas e animais. Além deste, outras substâncias, em pequenas quantidades, geralmente oferecem resistência a métodos de degradação biológica ou não são removidos efetivamente por métodos de tratamento físico-químicos. A adsorção tornou-se, então, um dos métodos mais utilizados para este fim, ganhando importância como um processo de separação e purificação, nas últimas décadas (Crini, 2005; Dabrowski, 2001; Gurgel, 2007). A adsorção é geralmente usada na remoção de compostos orgânicos, presentes em muitos efluentes industriais, e cuja remoção se torna difícil por processos de tratamentos biológicos convencionais, como também a desumidificação de gases, recuperação de vapores de solventes dispendiosos, remoção da umidade da gasolina. É também utilizada para tratamento de efluentes com metais pesados, sendo um processo bastante eficiente na sua remoção (Mosquetta, 2010). O adsorvente é a substância cuja em sua superfície se produz o fenômeno da adsorção e o adsorbato ou adsorvato é a substância que é concentrada na superfície. Existe atualmente uma variedade de adsorventes porosos que são utilizados, tais como: sílica gel, zeólitas, carvão ativado e alumina ativada. A alumina ativada, objeto deste trabalho, tem por característica superfície hidrofílica tendo uma seletividade maior para água do que para compostos orgânicos. Nas últimas décadas houve um aumento do interesse no uso de hidróxidos e oxi-hidróxidos como precursores das aluminas de transição usadas como suportes catalíticos e adsorventes. A alumina é um suporte catalítico bastante utilizado por ser um material de baixo custo e estruturalmente estável, que pode ser preparado com uma grande variedade de tamanhos e distribuição de poros (Carvalho, 2010). A produção principal destes produtos é pela desidroxilação de diferentes hidróxidos de alumínio em uma faixa de temperatura compreendida entre 250 a 800 ºC, onde ocorre a liberação da hidroxila produzindo um material altamente poroso com grande área específica (Misra, 1986). Neste trabalho foi estudada a viabilidade de obtenção de alumina de transição a partir da mistura de gibbsita, proveniente do processo Bayer, e hidróxido de alumínio gel, proveniente de reação de sulfato de alumínio e hidróxido de amônio visando sua aplicação como material adsorvente para remoção de Cu 2+ em solução aquosa.
Material e métodos
Os materiais de partida para a obtenção da alumina de transição foram a gibbsita e hidróxido de alumínio gel. Para a produção do hidróxido de alumínio gel utilizou-se uma solução saturada de sulfato de alumínio comercial. Solução de hidróxido de amônio concentrada (28 a 30%) foi adicionada lentamente, por meio de titulação, para promover a precipitação do gel de hidróxido de alumínio até atingir pH na faixa de 4 a 10. A titulação foi cessada ao atingir o pH de 8,23 e o gel formado foi colocado em repouso durante três dias para promover o crescimento dos cristais. Após este processo foi realizada a filtração a vácuo para separação do material precipitado. Este material foi seco por 24h em estufa e em seguida com auxílio de almofariz e pistilo foi desaglomerado. Efetuou-se a mistura de gibbita (50%) e o gel seco de hidróxido de alumínio (50%) e posteriormente foi realizada a ativação térmica a 700 ºC durante 3 horas. A caracterização da mistura calcinada foi realizada a partir dos seguintes ensaios: DRX; EDX; área superficial BET. Para avaliar o tempo de contato foi utilizado 1 g de adsorvente e volume de solução de 100 mL de solução de sulfato de cobre de 800 ppm. Os tempos de análise foram 5, 10, 15 e 60 minutos. A temperatura do ensaio foi de 30 ºC. Com base neste ensaio preliminar foi estabelecido o tempo de contato de 15 minutos para todos os ensaios posteriores, pois, observou-se que com este tempo alcançava-se o equilíbrio. Para os testes de adsorção foram utilizadas soluções aquosas com concentrações de 100, 200, 400, 800, 1600 e 2000 ppm de solução de sulfato de cobre. Alíquotas de 100 mL de solução foram retiradas e colocadas em beckers de 250 mL, os quais foram inseridos em banho termostático. (30 e 50 ºC). 1 g de material calcinado foi adicionado em cada um dos seis beckers. Ao término do intervalo de tempo pré-estabelecido para os ensaios de adsorção (15 min), as soluções foram filtradas e em seguida levadas para a análise em espectrofotômetro UV. O material calcinado foi avaliado segundo o efeito da temperatura do processo de adsorção (30 e 50 ºC). Os dados obtidos foram utilizados no ajuste dos modelos matemáticos, comparando-se os resultados da capacidade de adsorção em função da temperatura em que foi realizado. Os parâmetros de adsorção foram estimados a partir dos modelos das equações de Langmuir e Freundlich. Foram determinados os valores de pH das soluções de sulfato de cobre antes e após os ensaios de adsorção, a fim de acompanhar a variação desse parâmetro e estabelecer relação com a capacidade de adsorção do material.
Resultado e discussão
A composição química do material foi de 99,917 % e 0,083 % de Fe2O3
percentual de óxido restante é de 0,083. Este resultado demonstra que o
material é constituído basicamente de Al2O3. Na Figura 1 estão apresentados
os resultados gráficos deste trabalho. Observa-se na figura 1-a e 1-b o
difratograma do material proveniente do processo Bayer e o difratograma de
raios-X da mistura calcinada a 700 ºC, respectivamente. Pode-se observar que
as reflexões 18,3 (2), 20,26 (2) e 20,5 (2), além de outras presentes
nos difratogramas confirmam que o hidróxido de partida trata-se do mineral
gibbsita. Observa-se também que para o material produzido o difratograma
apresenta-se na forma de alumina de transição gama, na temperatura de
calcinação de 700 ºC, com picos predominantes em 39,626 (2); 45,797 (2) e
66,310 (2). Da análise para obtenção da área superficial (BET) obteve-se a
densidade do material calcinado que foi 3,032 g/cm3. O valor da área
específica encontrado neste trabalho foi de 105,76 m2/g, este valor obtido
para uma temperatura de calcinação de 700 ºC, pode ser comparado ao valor
encontrado em outro trabalho que utilizou 650 ºC de temperatura de
calcinação obtendo área específica de 114 m2/g (Neves, 2001). Estes valores
estão de acordo, pois o aumento da temperatura diminui a área específica a
partir da temperatura de 600 ºC. Sendo justificado pelo fechamento dos poros
ocorrido durante o aumento gradual da perda de hidroxilas dos arranjos
estruturais das moléculas (Wenfers e Misra, 1987). Nas figuras 1-c e 1-d
estão os dados de pH da solução de CuSO4.5H2O antes da realização dos
ensaios (solução de partida) e após os ensaios a temperatura de 30 ºC e 50
ºC, respectivamente, com a mistura calcinada, nota-se que de acordo com o
aumento da concentração da solução de Cu+2 houve um decréscimo no pH antes e
após da adsorção para ambas as temperaturas trabalhadas (30ºC e 50ºC).
Porém, a comparação entre os valores
de pH obtidos (antes e após do teste de adsorção) com o aumento da
concentração da solução de Cu+2 para 30ºC, houve diminuição no pH, enquanto
que para 50ºC houve aumento nos valores de pH. Este comportamento do pH pode
ser explicado pelo fato das variações das cargas superficiais da alumina
durante o processo de adsorção, pois a superfície da alumina é carregada
positivamente com íons H+, a partir do momento em que a adsorção começa há
uma troca dos íons em solução com os íons H+, onde os íons em solução (Cu2+)
ocupam os sítios desocupados pelo íon H+, consequentemente quanto maior a
concentração de íon H+, em solução menor será o pH da mesma após o teste de
adsorção, quando comparadas ao pH inicial. Com o aumento da temperatura há
um comportamento inverso em relação ao pH inicial (antes da adsorção).
Enquanto que para a temperatura de 30 ºC o pH final (após a adsorção) é
menor que o inicial, para a temperatura de 50 ºC o pH final aumenta, este
comportamento explica-se pelo fato de que com o aumento da temperatura há um
favorecimento da difusão dos íons Cobre para sítios na superfície da alumina
não necessariamente havendo troca iônica com os íons H+, portanto, se não há
uma disposição de íons H+ em solução o pH comporta-se de modo contrário, ou
seja, o pH aumenta em relação ao pH inicial. A alumina produzida foi
submetida a ensaios de adsorção com soluções de CuSO4.5H2O nas temperaturas
de 30 e 50 ºC com o objetivo de avaliar o efeito da temperatura no
comportamento de suas capacidades de adsorção. Na figura 1-e são mostrados
os ajustes dos modelos de Langmuir e Freundlich, respectivamente, para
temperatura de 30ºC, de acordo com os dados experimentais no equilíbrio da
alumina obtida. Pode-se observar que as isotermas de Langmuir e Freundlich
ajustaram-se aos dados experimentais obtidos. Na figura 1-f são mostrados os
ajustes dos modelos de Langmuir e Freundlich, respectivamente, para
temperatura de 50ºC, de acordo com os dados experimentais no equilíbrio da
alumina obtida. Observa-se o ajuste dos modelos aos dados experimentais. O
formato das curvas das isotermas de adsorção evidencia que o material
apresentou comportamento favorável ao processo de adsorção para o íon cobre.
Observa-se um aumento na capacidade de adsorção do Cu2+, com o aumento da
temperatura do processo de adsorção tanto analisando para o modelo de
Langmuir quanto para o modelo Freundlich (Neves, 2001). Estes desempenhos
estão melhores avaliados na tabela I. Na Tabela I-a são apresentados os
valores dos coeficientes de regressão (R) das constantes da isoterma de
Langmuir (Q,K), onde Q é massa de adsorbato para cobrir uma monocamada e KL
é uma constante. Observando os valores dos coeficientes de regressão
apresentados pelo ajuste do modelo de Langmuir, nota-se que para a
temperatura de 50 ºC se encontra acima do valor de 0,9 enquanto que para a
temperatura de 30 ºC o valor do coeficiente de regressão está abaixo de 0,9,
mostrando uma menor concordância entre os dados experimentais e o modelo
para a temperatura de 50 ºC. Avaliando as constantes de Langmuir, pode-se
observar que Q exibe maior valor que KL indicando adsorção favorável. Este
resultado para a constante de equilíbrio de Langmuir indica adsorção
favorável, pois encontra-se no intervalo ente 0 a 1. A Tabela II-b mostra as
constantes de Freundlich, obtidos à temperatura de adsorção de 30 e 50 ºC.
Os valores de n encontram-se no intervalo de 5 a 7, dentro da faixa de 2 –
10 que indica adsorção favorável.
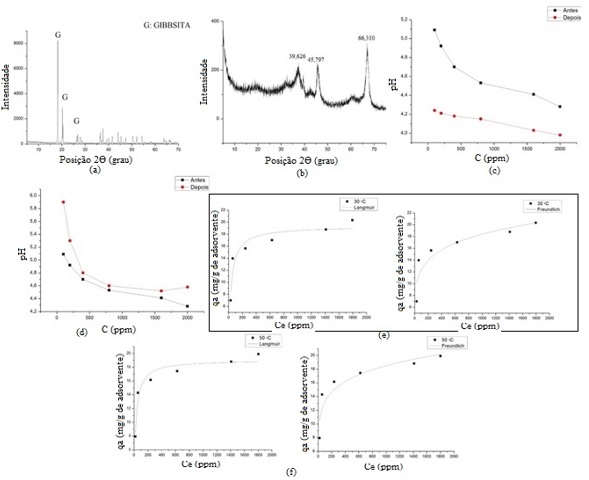
(a)DRX gibbsita, (b)DRX mistura calcinada, (c)pH 30 ºC, (d)pH 50 ºC, (e)Isotermas para temperatura de 30 ºC, (f)Isotermas para temperatura de 50 ºC
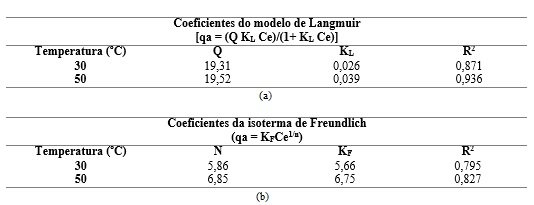
(a)Valores das constantes da isoterma de Langmuir (Q, K), (b)Dados do ajuste do modelo de Freundlich aos dados de adsorção a 30 e 50 ºC
Conclusões
A metodologia empregada para obtenção da alumina de transição a partir da mistura de gibbsita com hidróxido de alumínio gel foi satisfatória sendo comprovada pelas análises de caracterização do material e de adsorção. A mistura calcinada foi caracterizada como sendo alumina de transição gama de acordo com o difratograma obtido por DRX. A alumina produzida neste estudo apresentou boa capacidade de adsorção em relação ao cátion Cu2+. A partir dos dados obtidos na adsorção conclui-se que a alumina produzida pode ser utilizada em processos que necessitem reduzir a concentração de Cu2+ através da adsorção deste cátion em solução.
Agradecimentos
Referências
CARVALHO, T. E. M. Adsorção de corantes aniônicos de solução aquosa em cinza leve de carvão e zeólita de cinza leve de carvão. Dissertação de mestrado. Instituto de pesquisas energéticas e nucleares. 2010
CRINI, G. Recent developments in polysaccharide-based materials used as adsorbents in wastewater treatment. Progress in Polymer Science, v. 30, p. 38-70, jan. 2005.
DABROWSKI. A. Adsorption - from theory to practice. Advances in Colloid and Interface Science, v. 93, p. 135-224, out. 2001.
GURGEL, L. V. A. Mercerização e modificação química de celulose ebagaço de cana-de-açúcar com anidrido succínico e trietanolamina:Preparação de novos materiais quelantes para a adsorção de Pb (II), Cd (II), Cr (VI) e Cu (II). 2007. 203 f. Dissertação (Mestrado em Engenharia Ambiental) - Universidade Federal de Ouro Preto,Ouro Preto, 2007.
MISRA, C. Industrial alumina chemicals. Washington, DC: American Chemical Society, 1986. (ACS Monograph, 184).
MOSQUETTA, R. Remoção de cobre em álcool etílico hidratado combustível utilizando amêndoas de baru (Dypterix alata). Dissertação de mestrado. Universidade Federal de Uberlândia. 2010.
NEVES, A. S. S. Estudo da adsorção do cobre (II), utilizando aluminas adsorventes obtidas a partir da gibbsita proveniente do processo Bayer. 108 f. Dissertação. Universidade Federal do Pará. Belém. 2001
Tarun K. N., Ashim K. B., Sudip K. D., Journal of Colloid and Interface Science 333 (2009) 14–26.
WEFERS, K.; MISRA, C. Oxides and hydroxides of aluminum. Alcoa Technical Paper No. 19, Revised. Alcoa Laboratories: Alcoa Centre, 1987.











