ISBN 978-85-85905-19-4
Área
Química Inorgânica
Autores
Brito, Y. (UFPA) ; Meneses, C. (UFPA) ; Nahum, C. (UFPA)
Resumo
O anti-inflamatório não-esteroide ácido acetilsalicílico(AAS) muito eficaz,mas causador de efeitos colaterais, nesta proposta, através do método de co-precipitação foi intercalado em HDL, ([Al3+]/([Al3+]+[Mg2+])=2, a fim de minimizar tais efeitos. As amostras, foram caracterizadas por difração de raios X(DRX), infravermelho(IR) e microscopia eletrônica de varredura(MEV). A expansão do espaçamento basal(d003) da amostra AAS-HDL, 14,99 Å, indicou a presença dos ânions AA– na região interlamelar do HDL. As bandas em torno de 1458-1609 cm-1 no IR confirmam o processo de intercalação. A MEV, mostrou alterações na morfologia do HDL após a substituição dos ânions por fármaco.Desta forma,o processo de intercalação foi sucedido e as amostra AAS-HDL pode ser proposta para testes in vitro e in vivo.
Palavras chaves
HDL; AAS; INTERCALAÇÃO
Introdução
Hidróxidos duplos lamelares (HDLs) também conhecidos como argila iônica ou material do tipo hidrotalcita têm sido utilizados em diversas áreas, tais como, agricultura, meio ambiente, física, química, biologia, bioquímica, medicina entre outras (CUNHA et al., 2010; WANG et al., 2004). Os HDLs apresentam biodisponibilidade, baixa toxicidade, alta biocompatibilidade, alta capacidade de inserção de espécies iônicas entre suas camadas e possibilidade de funcionalização de sua superfície (FARAJI; WIPF, 2009). Desta forma, os HDLs são intensamente utilizados como carreadores de fármacos, promovendo a liberação sustentada e possibilidade de controle do alvo celular através da morfologia e tamanho das partículas inorgânicas (BARAHUIE et al., 2014; CUNHA et al., 2010). O anti-inflamatório não-esteroide ácido acetilsalicílico (AAS), apresenta propriedades analgésicas, anti-inflamatórias e antipiréticas (antitérmicas), também é bastante utilizado no tratamento de dores de cabeça, cólicas menstruais e musculares. No entanto, altas concentrações deste potente anti- inflamatório está associado a um elevado risco de hemorragia digestiva (Couto, et al,2006). Neste contexto, novas formulações contendo este fármaco tornam-se uma interessante e promissora estratégia. Neste estudo, a fim de contornar ou minimizar os efeitos colaterais causados pelo AAS propõem-se o carreamento deste fármaco em HDL. Portanto, foram obtidas a matriz inorgânica pura (HDL) e a amostra híbrida (orgânico- inorgânico) ou intercalada (AAS-HDL), isto através do método de co- precipiatação e na razão molar de cátions ([Al3+]/([Al3+] + [Mg2+]) igual à 2. Além disso, as amostras foram caracterizadas através de difração de raios X (DRX), infravermelho (IR) e microscopia eletrônica de varredura (MEV).
Material e métodos
O fármaco AAS (com 99% de pureza) foi obtido a partir da empresa Sigma- Aldrich Brazil Ltds. Os reagentes usados Mg(NO3)2.6H2O (Sigma-Aldrich, 98%), Al(NO3)3.9H2O (Sigma-Aldrich, 98%), NaOH (Sigma-Aldrich, 98%) e CH3CH2OH (Alfa Aesar, 94-96%) foram de grau analítico. A água utilizada em todas as etapas da síntese foi purificada com um ELGA Purelab Option labwater e descabonizada. A síntese do HDL e a intercalação do fármaco AAS foram conduzidos usando o método convencional de co-precipitação (MENG et al., 2015). No processo de síntese usou-se a razão molar de cátions igual à: ([Al3+]/([Al3+] + [Mg2+]) = 2. A fim de realizar uma comparação entre matriz inorgânica e as amostras intercaladas foram adotadas as mesmas condições experimentais em todos os sistemas. Então, em todos os experimentos foi usado uma mistura das soluções aquosas contendo os sais Mg(NO3)2.6H2O e Al(NO3)3.9H2O (15 ml), a qual foi lentamente adicionada a uma solução contendo o fármaco AAS (30 ml). Durante a mistura das soluções o pH foi mantido constante aproximadamente 10, controlado através da adição da solução de NaOH (2 mol/L). Em seguida, a suspensão resultante foi vigorosamente agitada (1500 rpm) sobre atmosfera de nitrogênio a 80° C por 24 horas. Depois o solido foi isolado por centrifugação (3500 rpm, por 5 min), filtrado e lavado com uma solução alcoólica 1:1 (v/v). E finalmente, os sólidos foram secados a 60° C durante 24 h. A difração de raios X (DRX) foram obtidos em um difratômetro advançado D8 (Bruker, Alemanha) com radiação CuKα, na faixa de valores em (2θ) de 2 a 80°, correspondendo ao um comprimento de onda de 1,5418 Å. Os padrões foram registrados com um passo de 0,014478° e tempo de exposição de 2,55 segundos por passo. Além disso, as amostras foram analisadas com o uso do programa Peakoc (MASSON, 2010) através da função de divisão pseudo-Voigt (THOMPSON, P.; COX, D. E.; HASTINGS, 1987) para ajustar os perfis experimentais. Análise de DRX também foi usada para a determinação do tamanho de partículas através da equação de Scherrer (VIVES; GAFFET; MEUNIER, 2004). Os espectros de infravermelho foram coletados em um espectrofotômetro modelo VERTEX 70v (BRUKER). As análises foram realizadas no modo de absorbância na faixa de 4000-400 cm-1. Todas as medições foram feitas em temperatura ambiente. A MEV foi usada para análise da morfologia das amostras sendo realizada em um microscópio eletrônico de varredura com Corrente do feixe de elétrons de 85- 90 µA (Tescan, VEGA3).
Resultado e discussão
Difração de Raios X (DRX):
Os padrões de DRX obtidos para os dois materiais HDL e HDL-AAS sintetizados
exibem características típicas de materiais do tipo hidrotalcita, mostrando
reflexões simétricas (00l), figura 1 (TRIFIRO; VACCARI, 1996). E a indexação
destas duas estruturas é baseada na simetria romboédrica (polítipo 3R1)
(CAVANI F, TRIFIRÒ F, 1991; TRIFIRO; VACCARI, 1996). Para o HDL as reflexões
basais (003) e (006) são facilmente identificadas como uma série de
equidistantes picos simétricos em ângulos inferiores a 32° em 2θ. As
reflexões assimétricas para os planos não basais (012), (015) e (018) também
são observadas entre 35° e 50° em 2θ (Figura 1A). Assim, usando o plano
(003) foi possível estimar o valor do espaçamento basal (d) para o HDL
sintetizado correspondendo a 8.69 Å, o qual é característico de HDL
intercalado com ânions de nitrato (TRIFIRO; VACCARI, 1996), apresentando uma
camada lamelar com espessura de 4.80 Å, consequentemente, com altura da
galeria interlamelar de 4.3 Å. Em adição, a partir da intensidade e largura
do pico de difração à meia altura (FWHM) para os planos basais (003) e (006)
obtidos do padrão de DRX do HDL (correspondentes a 0.62 e 0.89º,
respectivamente), verificou-se uma estrutura cristalina bastante organizada
e com tamanho de particular (t) de 141.81 Å, o qual foi estimado através da
equação de Scherrer (VIVES; GAFFET; MEUNIER, 2004).
Análises de Infravermelho (IR):
As medidas espectroscópicas desempenham um papel importante no entendimento
das estruturas dos HDLs, neste estudo teremos como principal foco a medida
na região do infravermelho médio de 400 a 4000 cm-1, estando relacionado com
as vibrações dos íons das camadas lamelares e ânions interlamelares (WANG et
al., 1999). Os espectros de IR do AAS pura, HDL-MgAl e AAS intercalados
MgAl-LDH são mostrados na Figura 2.
Os espectros das amostras apresentados na figura 2 mostram bandas em torno
de 447, 557, 675 E 771 cm-1, características de ligações dos grupos O-M-O e
M-O (M = Mg, Al) localizados nas camadas dos HDLs (DEL ARCO et al., 2004;
KANNAN et al., 1995; RIVES; ARCO; MARTÍN, 2014; ROMÁN et al., 2012). Para o
HDL também é observado duas bandas uma a 1359 cm-1 e outra a 1400 cm-1, o
que pode indicar a presença de CO3-2 tanto no espaço interlamelar quanto
adsorvido nas camadas do HDL. Isto devido a uma possível contaminação
durante o processo de síntese (Fig. 2A). A cerca de 3500 cm-1 observa-se uma
larga banda, correspondente aos estiramentos da ligação O-H das moléculas de
água existentes nos espaços interlamelares ou adsorvidas na superfície das
camadas lamelares. Além disso, somente no espectro do HDL é observado uma
banda em torno de 1629 cm-1 do modo (ᵹHOH) atribuído às moléculas de água
entre as suas camadas, que também corresponde aos modos de vibrações dos
grupos hidróxidos das camadas lamelares M-OH (M = Mg, Al), mostrado na
figura 2A(ANDRADE et al., 2000; KANNAN et al., 1995; REY; FORNES; ROJO,
1992).
As duas bandas a 1419 cm-1 e 1689 cm-1 no espectro do AAS (Fig. 2C) estão
associados com assimétrica e simétrica estiramento de C=O do grupo
carbóxilo, o qual é deslocar a números de onda menor (1386 cm-1 e 1575 cm-1)
no espectro da amostra intercalada. (Fig. 2B), indicando a formação de
fortes ligações de hidrogênio entre os grupos de COO- dos ânions do AAS
intercalado e as hidroxilas das camadas dos HDLs (KANG ZOU, HUI ZHANG,
2007). No espectro da amostra intercalada (Fig. 2B), as bandas a 1261 cm-1,
1144 cm-1, e 1609 cm-1 derivam dos tipos de estiramentos de C-O, C-O-C, e
C=O no grupo acetil, sendo semelhante ao encontrado no espectro do AAS (Fig.
2C correspondendo as bandas a 1306 cm-1, 1187 cm-1 e 1754 cm-1), mostrando
que estes grupos da estrutura do AAS também estão envolvidos em ligações de
hidrogênio nos espaços interlamelares.
Além disso, a banda a 1458 cm-1 no espectro do AAS puro é devido ao
estiramento C=C do anel aromático contido na estrutura deste fármaco, sendo
também observado no espectro da amostra intercalada (Fig. 2B). Desta forma
os dados obtidos através da análise de IR confirmam que através do processo
de co-precipitação foi possível obter uma estrutura hibrida na qual os
ânions de AAS- realmente foram intercalados na estrutura do MgAl-HDL.
A intercalação de AAS em HDL é confirmada com o aumento do espaçamento
basal, 14.99 Å, e o deslocamento dos planos basais (003 e 006) a menores
ângulos quando comparado com o HDL (10.16° e 20.08°, 2θ), figura 2B,
observando os valores 5.41° e 14.56° em 2θ, Além do surgimento de um
terceiro pico assimétrico referente à difração do plano (009) correspondente
as moléculas AAS na região interlamelar, também observado em outros
trabalhos (MENG et al., 2015). Desta forma, pode-se destacar que através do
processo de intercalação, os ânions de AAS provocaram bruscas alterações na
estrutura do HDL principalmente na região interlamelar, resultando em uma
diminuição significativa no grau de cristalinidade e no tamanho de partícula
44.98 Å do material híbrido.
Microscopia Eletrônica de Varredura (MEV):
Para confirmar a intercalação, as amostras foram ainda analisadas através da
MEV. As imagens do MEV mostram que a morfologia do HDL é uniforme com
partículas que apresentam formato hexagonal com bordas arredondas, além de
ser possível observar as estruturas lamelares da amostra formando camadas
bem definidas em forma de plaquetas arredondadas empilhadas de maneira
aleatórias (Figura 2d). Depois de feita a intercalação, a estrutura do HDL
sofre estremas alterações, com menor uniformidade e maior grau de agregação
das partículas possivelmente devido à inserção do ácido acetilsalicílico
entre as camadas do HDL (Figura 2e). Tais resultados estão claramente,
correlacionados com os resultados estruturais obtidos no DRX e IR.
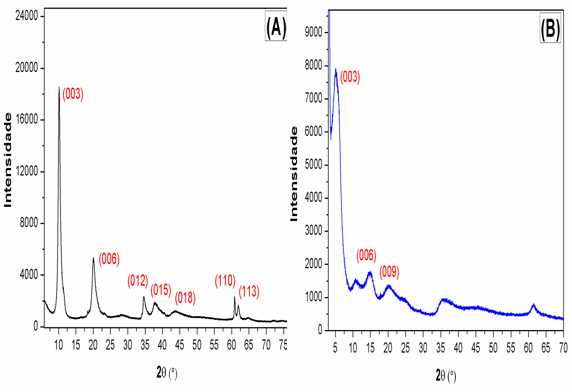
Padrões de DRX: (a) HDL e (B) HDL-MgAl.
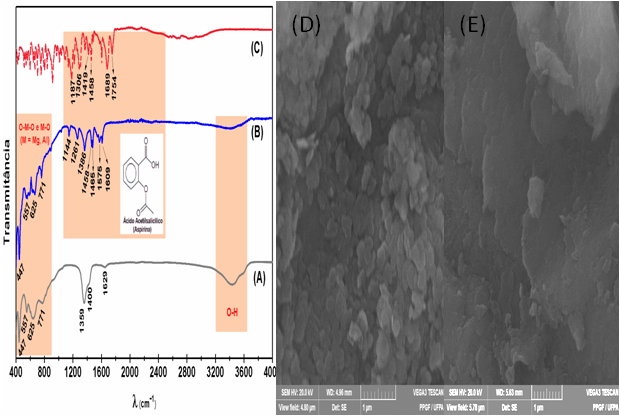
espectros de IR: (a) MgAl-HDL, (b) AAS-HDL e (c) ASS pura. Mev do HDL-MgAl (d) e da amostra intercalada AAS-HDL (e)
Conclusões
Tendo como referência os resultados aqui discutidos, podemos concluir que através do método de co-precipitação foi possível realizar a síntese de hidróxido duplo lamelar (HDL-Mg2Al) e a intercalação do fármaco AAS. Através do padrão de DRX da amostra intercalada é observado três difrações basais a baixo ângulo, correspondentes aos planos (003), (006) e (009), além de um aumento no espaçamento basal, 14,99 Å, indicando a substituição dos ânions nitratos pelos ânions do fármaco AAS. Além disso, por meio da análise espectroscópica de IR foi possível observar as bandas na faixa de 1458-1609 cm-1, referente ao grupo acetil do AAS confirmando sua presença entre as camadas lamelares. Já análise de MEV mostrou o quanto o processo de intercalação modificou a morfologia do HDL consequentemente sua estrutura, tal como mostrado pelos padrões de DRX.
Agradecimentos
À UFPA pela estrutura fornecida e a agência CNPQ pelo auxilio financeiro, ao Laboratório de Nanociência e Nanotecnologia da Amazônia e ao Laboratório de Planejamento
Referências
ANDIARA DE CARVALHO VIEIRA. Síntese, Caracterização e Aplicação de Hidróxidos Duplos Lamelares. [s.l.] Universidade federal de ouro preto, 2009.
ANDRADE, A et al. Synthesis and characterization of a diruthenium-ibuprofenato complex comparing its anti-inflammatory activity with that of a copper(II)-ibuprofenato complex. Journal of inorganic biochemistry, v. 81, n. 1-2, p. 23–7, jul. 2000.
BARAHUIE, F. et al. Development of drug delivery systems based on layered hydroxides for nanomedicine. International Journal of Molecular Sciences, v. 15, p. 7750-7786, 2014.
BARAHUIE, F. et al. Synthesis of protocatechuic acid–zinc/aluminium–layered double hydroxide nanocomposite as an anticancer nanodelivery system. Journal of Solid State Chemistry, v. 221, p. 21–31, 2015.
CAVANI F, TRIFIRÒ F, V. A. coldysis T&y, v. 11, p. 173–301, 1991.
CONCEIÇÃO, L. DA et al. Compósitos magnéticos baseados em hidrotalcitas para a remoção de contaminantes aniônicos em água. Química Nova, v. 30, n. 5, p. 1077–1081, out. 2007.
CREPALDI, E. L.; VALIM, J. B. Hidróxidos duplos lamelares: Síntese, estrutura, propriedades e aplicações. Química Nova, v. 21, p. 300-311, 1998.
CUNHA, V. R. R. et al. Hidróxidos duplos lamelares: Nanopartículas inorgânicas para armazenamento e liberação de espécies de interesse biológico e terapêutico. Química Nova, 2010.
FARAJI, A. H.; WIPF, P. Nanoparticles in cellular drug delivery. Bioorganic and Medicinal Chemistry, v. 17, p. 2950-2962, 2009.
KANNAN, S. et al. Synthesis and physicochemical properties of cobalt aluminium hydrotalcites. Journal of Materials Science, v. 30, p. 1462–1468, 1995.
MANJU, G. N.; GIGI, M. C.; ANIRUDHAN, T. S. Hydrotalcite as adsorbent for the removal of chromium (VI) from aqueous media: Equilibrium studies. Indian Journal of Chemical Technology, v. 6, n. May, p. 134–141, 1999.
MASSON. Peakoc Program. 2010.
MENG, Z. et al. Structure, molecular simulation, and release of a spirin from intercalated Zn-Al-layered double hydroxides. Colloids and Surfaces B: Biointerfaces, v. 135, p. 339–345, 2015.
REY, F.; FORNES, V.; ROJO, J. M. Thermal decomposition of Mg, Al hydrotalcite material. Journal of Materials Science. v. 28, n. 15, p. 2157-2162, 1993.
RIVES, V.; DEL ARCO, M.; MARTÍN, C. Intercalation of drugs in layered double hydroxides and their controlled release. A review: Applied Clay Science, 2014.
SAN ROMÁN, M. S. et al. Characterisation of Diclofenac, Ketoprofen or Chloramphenicol Succinate encapsulated in layered double hydroxides with the hydrotalcite-type structure. Applied Clay Science, v. 55, p. 158–163, 2012.
SHUMAKER, J. L. et al. Biodiesel synthesis using calcined layered double hydroxide catalysts. Applied Catalysis B: Environmental, v. 82, n. 1-2, p. 120–130, 2008.
TRIFIRO, F.; VACCARI, A. Hydrotalcite-like anionic clays (layered double hydroxides). Comprehensive Supramolecular Chemistry, v. 7, p. 251–291, 1996.
VATIER, J. et al. Antacid Activity of Calcium-Carbonate and Hydrotalcite Tablets - Comparison between in-Vitro Evaluation Using the Artificial Stomach-Duodenum Model and in-Vivo Ph-Metry in Healthy-Volunteers. Journal Drug Research, v. 44-1, n. 4, p. 514–518, 1994.
VIVES, S.; GAFFET, E.; MEUNIER, C. X-ray diffraction line profile analysis of iron ball milled powders. Materials Science and Engineering A, v. 366, p. 229–238, 2004.
WANG, J. et al. Structure and thermal decomposition of sulfated β-cyclodextrin intercalated in a layered double hydroxide. Journal of Solid State Chemistry, v. 177, n. 1, p. 366–371, jan. 2004.
WANG, J. A. et al. Cationic and anionic vacancies in the crystalline phases of sol-gel magnesia-alumina catalysts. Chemistry of Materials, v. 11, p. 308–313, 1999.
WILSON, M. R. Molecular simulation of liquid crystals: progress towards a better understanding of bulk structure and the prediction of material properties. Chemical Society reviews, v. 36, p. 1881–1888, dez. 2007.











