ISBN 978-85-85905-19-4
Área
Físico-Química
Autores
Gomes, G. (UFPA) ; Brito, Y. (UFPA) ; Canavieira, L. (UFPA) ; Brasil, E. (UFPA) ; Macchi, B. (UFPA) ; Silva, E. (UFPA) ; Nascimento, J. (UFPA) ; Lameira, J. (UFPA) ; Silva, J. (UFPA) ; Alves, C. (UFPA)
Resumo
O modo de ligação e os efeitos inibitórios de potencias agentes quimioterápicos foram analisados por simulação computacional através da técnica de docagem (“ancoragem”) molecular. A enzima Tirosinase (TYR), um potencial alvo biológico contra câncer foi selecionada como molécula receptora para os agentes quimioterápicos selecionados. A partir dos resultados obtidos, foram propostos os modos de ligação dos inibidores de TYR no sítio ativo da enzima, bem como suas contribuições termodinâmicas (energia de afinidade) e interações com resíduos importantes para a atividade catalítica da enzima. Estes resultados podem contribuir para o desenho e síntese de novas moléculas com maior potencial anticâncer.
Palavras chaves
Câncer; Tirosinase; Inibição
Introdução
Melanina é o componente celular majoritário em muitas espécies de animais, fungos, plantas e bactérias (Slominski et al., 2004). Em humanos, é responsável pela cor da pele e proteção contra radiação. Entretanto, sua acumulação anormal induz a desordens na pigmentação, dentre as quais se destaca o melanoma – a forma mais mortal de câncer de pele (Chen e Kubo, 2002). O melanoma desenvolve-se em células de pigmentação denominadas melanócitos, devido à superprodução de melanina (Slominski et al., 2004). A produção de melanina inicia-se com a conversão do aminoácido L-tirosina em L-3,4- diidroxifeninalanina (L-DOPA) catalisada pela Tirosinase (Hearing, 2011). Assim, a regulação da atividade desta enzima está diretamente relacionada à biossíntese de melanina. A enzima Tirosinase é classificar como uma proteína “cobre tipo-3”, na qual cada íon cobre (Cu2+) do sítio ativo é coordenado por 3 (três) resíduos de histidina (Slominski et al., 2012). Em geral, o mecanismo de inibição desta enzima consiste tanto em inibidores, quanto em desativadores de Tirosinase (Chang, 2009). Neste contexto, um grande conjunto de inibidores de Tirosinase, tanto de fontes naturais, quanto sintéticas tem sido reportado nos últimos anos (Chang, 2009). Dentre os principais, destaca-se o ácido kójico (AK), um inibidor de Tirosinase, que é muito utilizado em cosméticos que objetivam o clareamento da pele. Entretanto, o AK mostrou baixa eficácia contra melanócitos intactos ou em ensaios clínicos (Hermanns et al., 2000). Neste estudo, análogos de derivados de produtos naturais – diidropirano[3,2-b]menadionas (DHPC) - foram utilizados nas simulações computacionais como inibidores da enzima TYR.
Material e métodos
Neste estudo, a estrutura cristalográfica da Tirosinase de Agaricus bisporus (AbTYR) (código PDB 2Y9X) (Ismaya et al., 2011), comumente, conhecido como cogumelo, foi utilizada como ponto de partida para as simulações computacionais. Esta estrutura contém o inibidor cristalográfico Tropolone (TRO), que foi utilizado como referência para validação dos procedimentos de docagem molecular a partir da re-docagem deste inibidor. Posteriormente, os derivados de produtos naturais foram submetidos aos mesmos procedimentos in silico. Os cálculos de docagem molecular foram realizados no programa DOCK6 (Lang et al., 2009), que aplica um algoritmo de construção incremental denominado “anchor-and-grow” (“ancorar- e-crescer”) para construir os ligantes propostos no sítio ativo do receptor, neste caso, a enzima TYR. As conformações obtidas foram então classificadas pela função de pontuação baseada na energia potencial do sistema, onde as interações de van der Waals são calculadas pelos potencias de Lennard-Jones, e as interações eletrostáticas, por uma função dielétrica dependente do tempo (Deng e Verlinde, 2008). Os detalhes sobre a teoria implementada no programa DOCK6 e suas características são apresentadas em revisões da literatura (Moustakas et al., 2006). Os arquivos necessários para os procedimentos in silico são criados pelo programa gráfico Chimera (Pettersen et al., 2004).
Resultado e discussão
A técnica de docagem molecular tem sido utilizada com sucesso na descrição de sistemas
biológicos envolvendo a enzima TYR (Si et al., 2011; Lima, Silva, De Tassia Carvalho
Cardoso, et al., 2014). Para que a teoria aplicada através do programa DOCK6 fosse validada
para a TYR e os inibidores DHPCs, o procedimento de re-docagem foi aplicado. Este
procedimento consiste em utilizar uma molécula que esteja complexada com a enzima, onde
os dados foram obtidos experimentalmente. Desta forma, sendo considerada um ligante de
referência. Neste estudo, o ligante selecionado foi o inibidor Tropolone (TRO), já complexado
à enzima TYR.
Os resultados obtidos pela re-docagem do inibidor TRO demonstram que o modo ligação
deste, determinado pela técnica empregada pelo programa DOCK6, está em excelente
concordância com seu modo de ligação determinado experimentalmente. Neste sentido, o
mesmo procedimento foi utilizado para os demais inibidores.
Para os resultados teóricos dos inibidores DHPCs, estes apresentaram modo de ligação
semelhante ao inibidor TRO (Figura 5), uma vez que foram complexados no mesmo sítio do
inibidor cristalográfico (sítio catalítico), portanto, apresentando assim um modo de inibição
competitivo.
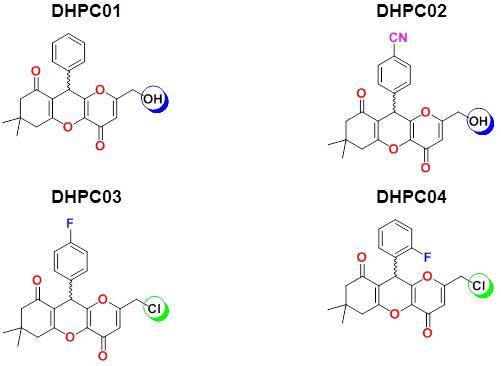
Estrutura 2D dos derivados DHPCs
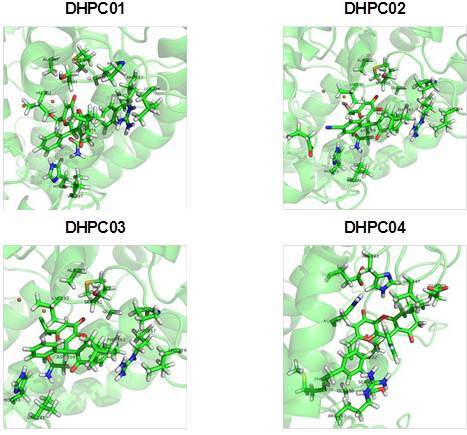
Modo de ligação dos derivados DHPCs obtidos por docagem molecular
Conclusões
Os resultados encontrados neste estudo corroboram com a proposta de competição existente entre os inibidores DHPCs e o substrato L-DOPA no sítio catalítico da enzima, como proposto na literatura (Si et al., 2011; Hu et al., 2012).Como se trata de uma área estratégica para o Brasil, os resultados determinados podem contribuir para o desenvolvimento e planejamento de fármacos, principalmente no desenvolvimento de moléculas com potencial terapêutico contra o câncer de pele.
Agradecimentos
À UFPA pela estrutura fornecida e as agências CNPQ e CAPES pelo auxílio financeiro.
Referências
CHANG, T. S. An updated review of tyrosinase inhibitors. Int J Mol Sci, v. 10, n. 6, p. 2440-75, Jun 2009.
CHEN, Q. X.; KUBO, I. Kinetics of mushroom tyrosinase inhibition by quercetin. J Agric Food Chem, v. 50, n. 14, p. 4108-12, Jul 3 2002.
DENG, W.; VERLINDE, C. L. Evaluation of different virtual screening programs for docking in a charged binding pocket. J Chem Inf Model, v. 48, n. 10, p. 2010-20, Oct 2008.
HEARING, V. J. Determination of melanin synthetic pathways. J Invest Dermatol, v. 131, n. E1, p. E8-E11, 2011.
HERMANNS, J. F.; PIERARD-FRANCHIMONT, C.; PIERARD, G. E. Skin colour assessment in safety testing of cosmetics. An overview. Int J Cosmet Sci, v. 22, n. 1, p. 67-71, Feb 2000. HU, W. J. et al. Kinetic, structural and molecular docking studies on the inhibition of tyrosinase induced by arabinose. Int J Biol Macromol, v. 50, n. 3, p. 694-700, Apr 1 2012.
ISMAYA, W. T. et al. Crystal structure of Agaricus bisporus mushroom tyrosinase: identity of the tetramer subunits and interaction with tropolone. Biochemistry, v. 50, n. 24, p. 5477-86, Jun 21 2011.
KUMAR, D. et al. A facile one-pot green synthesis and antibacterial activity of 2-amino-4H-pyrans and 2-amino-5-oxo-5,6,7,8-tetrahydro-4H-chromenes. Eur J Med Chem, v. 44, n. 9, p. 3805-9, Sep 2009.
LANG, P. T. et al. DOCK 6: combining techniques to model RNA-small molecule complexes. RNA, v. 15, n. 6, p. 1219-30, Jun 2009.
LIMA, C. R. et al. Combined kinetic studies and computational analysis on kojic acid analogous as tyrosinase inhibitors. Molecules, v. 19, n. 7, p. 9591-605, 2014.
MEEPAGALA, K. M. et al. New class of algicidal compounds and fungicidal activities derived from a chromene amide of Amyris texana. J Agric Food Chem, v. 58, n. 17, p. 9476-82, Sep 8 2010.
MOUSTAKAS, D. T. et al. Development and validation of a modular, extensible docking program: DOCK 5. J Comput Aided Mol Des, v. 20, n. 10-11, p. 601-19, Oct-Nov 2006.
PETTERSEN, E. F. et al. UCSF Chimera--a visualization system for exploratory research and analysis. J Comput Chem, v. 25, n. 13, p. 1605-12, Oct 2004.
RAJ, T. et al. Cytotoxic activity of 3-(5-phenyl-3H-[1,2,4]dithiazol-3-yl)chromen-4-ones and 4-oxo-4H-chromene-3-carbothioic acid N-phenylamides. Eur J Med Chem, v. 45, n. 2, p. 790-4, Feb 2010.
SI, Y. X. et al. Tyrosinase inhibition by isophthalic acid: kinetics and computational simulation. Int J Biol Macromol, v. 48, n. 4, p. 700-4, May 1 2011.
SLOMINSKI, A. et al. Melanin pigmentation in mammalian skin and its hormonal regulation. Physiol Rev, v. 84, n. 4, p. 1155-228, Oct 2004.
SLOMINSKI, A.; ZMIJEWSKI, M. A.; PAWELEK, J. L-tyrosine and L-dihydroxyphenylalanine as hormone-like regulators of melanocyte functions. Pigment Cell Melanoma Res, v. 25, n. 1, p. 14-27, Jan 2012.











