ISBN 978-85-85905-19-4
Área
Físico-Química
Autores
Batista, P.F.A. (UFF) ; Martins, R.J. (Universidade Federal Fluminense) ; Lamego, L.S.R. (UFF)
Resumo
A equação UNIQUAC é aplicável a uma ampla variedade de misturas líquidas, por isso foi empregada na modelagem do equilíbrio líquido-vapor e da viscosidade de misturas binárias. Os resultados obtidos mostraram que o modelo é adequado para o ajuste de dados experimentais, tanto de viscosidade quanto de equilíbrio líquido-vapor, com desvios médios inferiores a 7%. Com base nos coeficientes de atividade calculados, foi realizado o estudo da relação entre o coeficiente de atividade termodinâmico segundo a equação UNIQUAC e o coeficiente de atividade viscoso estabelecido pelo modelo de Martins et al. (2000).
Palavras chaves
UNIQUAC; equilíbrio líquido-vapor; viscosidade
Introdução
Grande parte dos processos da indústria química envolvem operações de separações, como a destilação, extração e a absorção, de modo que a termodinâmica com seu formalismo aplicado ao equilíbrio de fases e ao equilíbrio das reações químicas oferece uma visão do comportamento macroscópico de um sistema como o resultado estatístico de efeitos que se manifestam em nível molecular, sendo assim uma ferramenta inestimável na construção e no refinamento dos programas de simulação de processos químicos (GMEHLING et al., 2012). Embora já reconhecida a grande importância da termodinâmica na concepção de operações de separação, uma equação verdadeiramente satisfatória para o cálculo do coeficiente de atividade de misturas não eletrolíticas ainda não foi estabelecida. No entanto, a equação desenvolvida por Abrams e Prausnitz (1975), denominada UNIQUAC (Universal QuasiChemical) é aplicável a uma ampla variedade de misturas líquidas e utiliza apenas dois parâmetros ajustáveis por binário, além de parâmetros de área e volume das espécies puras (ANDERSON E PRAUSNITZ, 1978). Este trabalho tem por objetivo a realização de um estudo comparativo do comportamento termodinâmico e viscoso de misturas binárias por meio da modelagem e da análise da relação entre o coeficiente de atividade termodinâmico segundo a equação UNIQUAC e o coeficiente de atividade viscoso estabelecido pelo modelo de Martins et al. (2000).
Material e métodos
Segundo o princípio de igualdade de fugacidade desenvolvido por G. N. Lewis, a relação fundamental para o equilíbrio líquido-vapor em sistemas multicomponentes pode ser descrita pela equação: φiyiP=γixifi oL. Para a obtenção dos coeficientes de atividade a termodinâmica de soluções apresenta diversos estudos em torno da sua previsão e correlação que estão diretamente relacionados com a energia livre de Gibbs molar em excesso gE. Em se tratando da modelagem da viscosidade, aliando a teoria de Eyring com a termodinâmica clássica, Martins e colaboradores propuseram um modelo para viscosidade de soluções reais, que é composto por um termo ideal e um termo que contabiliza a energia livre molar de ativação do fluxo viscoso em excesso. O termo de excesso para a viscosidade é análogo à energia de Gibbs em excesso do modelo UNIQUAC, o que possibilita o estudo comparativo entre os resultados obtidos.Há dois parâmetros de interação binária a serem determinados através da correlação de dados experimentais de equilíbrio líquido-vapor ou de viscosidade. Para os dados de equilíbrio líquido-vapor a propriedade avaliada foi a pressão de vapor, e para os dados de viscosidade, a propriedade foi a viscosidade dinâmica ou a viscosidade cinemática. Os cálculos envolvidos neste trabalho utilizaram programas confeccionados pelo Grupo de Estudo de Propriedades Físico-Químicas de Líquidos e de Processos Eletroquímicos. Os parâmetros de interação binária, correspondentes ao equilíbrio líquido-vapor, foram obtidos através do Método de Levenberg-Marquardt (BEVINGTON E ROBINSON, 2003). Já para os dados de viscosidade, o método de otimização utilizado foi o método de Powell (BRENT, 2002).
Resultado e discussão
Foram estudados dez sistemas em diferentes faixas de temperatura com dados
experimentais de equilíbrio líquido-vapor e de viscosidade extraídos da
literatura. Os ajustes foram avaliados pelo desvio padrão relativo médio
percentual, MRSD, que para todos os sistemas foi inferior a 7%. A figura 1
ilustra o ajuste obtido para o binário acetona (1) + benzeno (2) a 298,15 K,
que forneceu um MRSD de 0,485% e 0,285% para a modelagem do equilíbrio
líquido-vapor e da viscosidade, respectivamente. Foi realizado um estudo da
relação entre o coeficiente de atividade termodinâmico segundo a equação
UNIQUAC e o coeficiente de atividade viscoso estabelecido pelo modelo de
Martins et al. (2002). A figura 2 ilustra os resultados obtidos para
sistemas binários constituídos por benzeno, tendo como segundo componente
acetona, etanol, hexano ou ciclohexano, a 295,15K. Observa-se que os
coeficientes de atividade tendem à unidade quando a fração molar de benzeno
tende à unidade, no entanto por sentidos opostos.
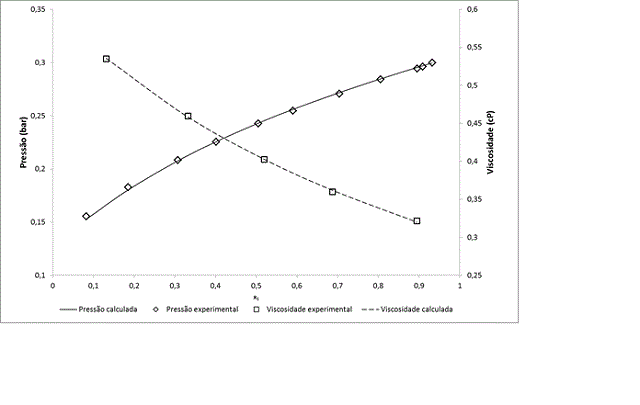
Modelagem do equilíbrio líquido-vapor e da viscosidade do binário acetona(1) + benzeno (2) a 298,15 K. Dados experimenentais refs. 9 e 12.
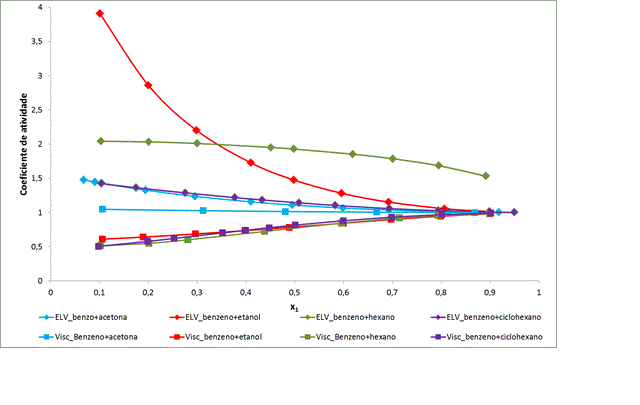
Coeficientes de atividade termodinâmico e viscoso dos binários contendo benzeno a 298,15K. Os dados experimentais referências 6, 8-12.
Conclusões
Apesar dos excelentes resultados da correlação de dados de equilíbrio líquido- vapor e de viscosidade dos sistemas binários investigados, os coeficientes de atividade termodinâmico e viscoso têm perfis distintos. Para cada componente de um sistema binário, um aumento de sua fração molar aumenta o coeficiente de atividade termodinâmico e diminui o coeficiente de atividade viscoso. Na próxima etapa deste trabalho, pretende-se estabelecer uma relação entre os coeficientes de atividade determinados através de dados de viscosidade e de dados de equilíbrio líquido-vapor.
Agradecimentos
Os autores gostariam de agradecer a CAPES e FAPERJ pelo apoio financeiro.
Referências
[1] ABRAMS, D. S.; PRAUSNITZ, J. M. Statistical thermodynamics of liquid mixtures: a new expression for the excess Gibbs energy of partly or completely miscible systems. AIChE Journal, v. 21, n. 1, p. 116-128, 1975.[2] ANDERSON, T. F.; PRAUSNITZ, J. M. Application of the UNIQUAC equation to calculation of multicomponent phase equilibria. 1. Vapor-liquid equilibria. Industrial & Engineering Chemistry Process Design and Development, v. 17, n. 4, p. 552-561, 1978. [3] BEVINGTON, P. R.; ROBINSON, D. K. Data Reduction and Error Analysis for the Physical Sciences, 3rd ed. McGraw-Hill, 2003. [4] BRENT, R. Algorithms for Minimization Without Derivatives. Dover Publications, 2002. [5] GMEHLING, J.; KOLBE, B.; KLEIBER, M.; RAREY, J. Chemical thermodynamics for process simulation. John Wiley & Sons, 2012. [6] KOURIS, S.; PANAYIOTOU, C. Dynamic viscosity of mixtures of benzene, ethanol, and n-heptane at 298.15 K. Journal of Chemical and Engineering Data, v. 34, n. 2, p. 200-203, 1989. [7] MARTINS, R. J.; CARDOSO, M. J. E. M.; BARCIA, O. E. Excess Gibbs Free Energy Model for Calculating the Viscosity of Binary Liquid Mixtures. Ind. Eng. Chem. Res., v. 39, n. 3, p. 849-854, 2000. [8] PAPAIOANNOU, D.; EVANGELOU, T.; PANAYIOTOU, C. Dynamic viscosity of multicomponent liquid mixtures. Journal of Chemical and Engineering Data, v. 36, n. 1, p. 43-46, 1991. [9] PETRINO, P. J.; GASTON-BONHOMME, Y. H.; CHEVALIER, J. L. E. Viscosity and density of binary liquid mixtures of hydrocarbons, esters, ketones, and normal chloroalkanes. Journal of Chemical and Engineering Data, v. 40, n. 1, p. 136-140, 1995. [10] SCHRODT, J. T.; AKEL, R. M. Binary liquid viscosities and their estimation from classical solution thermodynamics. Journal of Chemical and Engineering Data, v. 34, n. 1, p. 8-13, 1989. [11] SMITH, V. C.; ROBINSON JR, R. L. Vapor-liquid equilibriums at 25. deg. in the binary mixtures formed by hexane, benzene, and ethanol. Journal of Chemical and Engineering Data, v. 15, n. 3, p. 391-395, 1970. [12] TASIĆ, A., DJORDJEVIĆ, B.; GROZDANIĆ, D.; AFGAN, N.; MALIĆ, D. Vapour—liquid equilibria of the systems acetone—benzene, benzene—cyclohexane and acetone—cyclohexane at 25° C. Chemical Engineering Science, v. 33, n. 2, p. 189-197, 1978.











