ISBN 978-85-85905-19-4
Área
Química Analítica
Autores
Santiago, J.C.C. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Leder, P.J.S. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Azevedo, W.H.C. (UNIVERSIDADE DO ESTADO DO PARÁ) ; Santanna, J.S. (UNIFESSPA) ; Venâncio, C.R.R. (UNIVERSIDADE DO ESTADO DO PARÁ)
Resumo
A permanganometria é a titulação em que se utiliza o permanganato de potássio como titulante, devido ser o íon permanganato um auto indicador. Este método pode ser empregado na determinação do teor de peróxido de hidrogênio (H2O2) em água oxigenada comercial, que se faz importante de ser realizado para fins de confirmação se a percentagem (m/V) de H2O2 e o número de volumes indicados no rótulo correspondem ao valor real. Desse modo, buscou-se determinar, por meio da permanganometria, o teor de H2O2 em três amostras de água oxigenada comercial. Os valores de H2O2 encontrados para as três amostras analisadas estavam acima do indicado no rótulo do produto, sendo o valor máximo de 3,26% em 10,73 volumes. Isto permite concluir que o acréscimo é para fins de aumento da validade do produto.
Palavras chaves
Permanganometria; água oxigenada; peróxido de hidrogênio
Introdução
O peróxido de hidrogênio (H2O2) é comercialmente encontrado na forma de solução aquosa com teores em cerca de 3%, 6%, 12% e 30% de peróxido de hidrogênio, conhecida como água oxigenada a 10, 20, 40 e 100 volumes, respectivamente. A terminologia “volumes” está baseada no volume de gás oxigênio (O2) produzido quando a solução é decomposta pela ebulição [1]. A decomposição do peróxido de hidrogênio ocorre conforme a equação química: 2 H2O2 → 2 H2O + O2, havendo relação massa-volume, sendo que 2 mols em gramas de H2O2 produz 1 mol em litros, isto é, 22,4 litros de O2 nas Condições Normais de Temperatura e Pressão (CNTP) [2]. Conforme já citado, a água oxigenada comercial contém determinada quantidade de peróxido de hidrogênio. Desse modo, é importante a realização de práticas experimentais que permitam confirmar se a percentagem em massa por volume de peróxido de hidrogênio e o número de volumes indicados no rótulo do produto correspondem ao valor real. Um dos métodos volumétricos utilizados, em laboratório, para a determinação do teor de H2O2 em água oxigenada comercial, é a titulação em permanganato de potássio (KMnO4) ou permanganometria. Este método faz uso do permanganato de potássio, um forte agente oxidante, como reagente volumétrico, sendo um dos mais importantes métodos volumétricos de óxido-redução [3], [4]. Sob este prisma, os procedimentos e os resultados apresentados neste trabalho utilizou-se da volumetria como medida das reações de óxido-redução, as quais envolvem diferentes estados de oxidação, ocorrendo o transporte de elétrons, onde uma substância é oxidada e outra reduzida. Neste sentido, a permanganometria foi o método escolhido para determinação de peróxido de hidrogênio em água oxigenada comercial.
Material e métodos
Foram obtidas três amostras de água oxigenada comercial, de marcas diferentes, em um supermercado da cidade de Belém do Pará. As amostras foram compradas na mesma data, 25 de maio de 2016, observando-se o mês e ano em que foram fabricadas. As marcas serão identificadas neste trabalho com as letras X, Y e Z. Foi realizada a padronização da solução de permanganato de potássio (KMnO4 0,02 M), utilizando-se como padrão primário o oxalato de sódio (Na2C2O4). A padronização foi realizada em duplicata utilizando-se 0,127 g de oxalato de sódio na primeira e na segunda titulação; foram adicionados 30 mL de água destilada e 7,5 mL de ácido sulfúrico (H2SO4 1:8), em Erlenmeyer de 200 mL. Em seguida, levou-se os Erlenmeyers para o aquecimento numa chapa aquecedora à 80 ºC, aproximadamente. Após entrar em ebulição, os Erlenmeyers foram retirados da chapa para a realização da titulação, até o aparecimento de uma coloração violeta clara, tendendo a rosa. Também foi realizada a prova em branco, em duplicata, utilizando-se 55,2 mL de água destilada na primeira e 55,0 mL na segunda, com adição de 7,5 mL de H2SO4 1:8 em Erlenmeyer de 200 mL. A titulação com KMnO4 foi realizada até que a cor rosa coincidisse com a cor do ponto final da titulação propriamente dita. Para a determinação de H2O2 em água oxigenada comercial, foram pipetados 10 mL de água oxigenada, transferida para um balão volumétrico de 200 mL, seguida de aferição com água destilada. Posteriormente, utilizando uma alíquota de 10 mL da solução previamente preparada de água oxigenada, juntou-se 75 mL de água destilada e 10 mL de H2SO4 1:5 em Erlenmeyer de 200 mL, para serem realizadas as titulações em triplicata. O procedimento foi repetido com as demais amostras analisadas.
Resultado e discussão
A massa medida de oxalato de sódio, o volume gasto de solução de KMnO4, bem
como os respectivos valores médios, são apresentados na Tabela 1. A reação
do permanganato de potássio com o oxalato de sódio, em meio ácido, ocorre
conforme a equação química (1). Com base na estequiometria da reação, e
usando-se o valor da massa média de oxalato de sódio medida, calculou-se a
massa de permanganato de potássio que reagiu com 0,127 g de oxalato de
sódio, que foi igual a 0,0599 g de KMnO4. Com o objetivo de se encontrar o
valor que estava acrescido no resultado da análise devido a presença de
possíveis “contaminantes” nos reagentes/soluções utilizadas, realizou-se a
prova em branco (volume médio = 0,1 mL de KMnO4). O volume médio do branco
foi subtraído do volume médio usado na titulação de oxalato de sódio. Com
isso, pode-se calcular a molaridade verdadeira da solução de KMnO4, por meio
da equação: M = m/MM×(VTit + VB). A molaridade verdadeira calculada em
0,0217 mol/L está próxima da teórica, que é de 0,02 mol/L. Após a
padronização do KMnO4, realizou-se a segunda parte do experimento, que
consistiu na determinação de peróxido de hidrogênio na água oxigenada
comercial, por meio da permanganometria. A Tabela 2 apresenta os volumes
gastos da solução de KMnO4 na determinação de H2O2 na água oxigenada, bem
como o valor médio. Após calculada a massa de permanganato de potássio
consumida na titulação, calculou-se a massa de peróxido de hidrogênio que
reagiu com a quantidade em gramas de KMnO4. Em seguida, calculou-se a
percentagem em massa por volume de peróxido de hidrogênio das três amostras
de água oxigenada comercial analisadas: X = 3,24 %; Y = 3,26 %; Z = 3,22 %.
O título em “volumes” encontrado paras as amostras analisadas foram: X =
10,67; Y = 10,73; Z = 10,6 volumes.
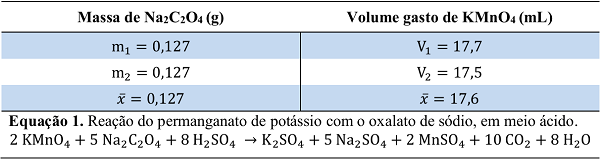
Massas de Na2C2O4 e volumes gastos de KMnO4 na padronização, e respectiva equação da reação.

Volumes gastos de KMnO4 na determinação de H2O2 na água oxigenada e a equação da reação.
Conclusões
Quanto a análise das amostras de água oxigenada comercial, o valor teórico de peróxido de hidrogênio que deveria ser encontrado era de 3% em 10 volumes, sendo o valor experimental calculado acima do indicado no rótulo do produto, para todas as amostras, o que sugere um aumento na concentração de peróxido de hidrogênio pelos fabricantes, a fim de aumentar o prazo de validade do produto, uma vez que o peróxido de hidrogênio se decompõe facilmente sob ação da luz.
Agradecimentos
À Universidade do Estado do Pará, pelo espaço cedido para a realização deste trabalho.
Referências
1 BACCAN, N.; ANDRADE, J. C.; GODINHO, O. E. S.; BARONE, J. S. Química analítica quantitativa elementar. 3. ed. São Paulo: Edgar Blücher, 2001.
2 SILVA, A. L. S. Dosagem de água oxigenada por solução de KMnO4. Info Escola: Navegando e Aprendendo, 2015. Disponível em: < http://www.infoescola.com/quimica/dosagemdeaguaoxigenadaporsolucaodekmno4/>. Acesso em: 10 abr. 2016.
3 OHLWEILER, O. A. Química analítica quantitativa. 2. ed. Rio de Janeiro: Livros Técnicos e Científicos, 1974.
4 SKOOG, A. D.; WEST, D. M.; HOLLER, F. J.; CROUCH, R. S. Fundamentos de Química Analítica. 6 ed. Thomson, Learning, 2006.











