ISBN 978-85-85905-19-4
Área
Química Analítica
Autores
da Silva Coutinho, M.A. (IFPI) ; Cardoso da Silva, E. (IFPI) ; Leal Alves, A. (IFPI) ; Germano de Matos, A.Z. (IFPI) ; Freitas Viana, V.G. (IFPI)
Resumo
Nos últimos anos, os pigmentos naturais de urucum têm sido substancialmente utilizados pelas indústrias de alimentos para dar cor a produtos. Dentre esses pigmentos destaca-se a bixina, um éster monometílico do ácido dicarbixílico alfa-norbixina pouco solúvel em óleo. Em virtude da crescente aplicação industrial da bixina, este trabalho teve como objetivo determinar a solubilidade desse corante natural em diferentes solventes, por meio de espectrofotometria UV-vis. Foram preparadas soluções sob as mesmas condições, utilizando-se os solventes: acetona, álcool etílico, álcool isopropílico, dimetilsulfóxido e clorofómio. A absorbância foi medida em função do comprimento de onda de cada solução por meio da análise dos espectros de UV-Vis, na região de 800 a 200 nm.
Palavras chaves
corante; solubilidade; uv-visível
Introdução
Os corantes são compostos orgânicos ou inorgânicos responsáveis pela cor de muitos materiais vivos ou inertes, como os alimentos, os tecidos, o papel, as bebidas, e tantos outros. De acordo com a sua origem, os corantes podem ser provenientes de fontes naturais ou sintetizados a partir de uma matéria prima precursora. A utilização de corante data da antiguidade e tem como o índigo o primeiro corante utilizado(LEAL, 2011). O urucum contém pigmentos carotenóide amarelo-alaranjado obtido das sementes do urucuzeiro(Bixa Orellana L.),planta originária das América central e do Sul. Do urucum são fabricados os corantes naturais mais difundidos na indústria de alimentos,cerca de 70% de todos os corantes naturais empregados e 50% de todos os ingredientes que exercem essa função(DOSSIÊ CORANTES,2009,P. 42).Segundo Leal(2011),muitos estudos das propriedades físicas, químicas e termodinâmicas já foram descritos sobre a bixina, no entanto, a solubilidade deste corante tem sido pouco pesquisada, embora esta propriedade termodinâmica seja muito importante para os processos industriais.Entende-se por solubilidade a quantidade máxima de soluto que pode ser dissolvida pela simples adição em um solvente à temperatura e pressão constantes, ou seja,corresponde à concentração de um soluto em uma solução saturada ε (RUSSEL, 2008).Várias técnicas e métodos já foram desenvolvidos para avaliar a solubilidade dos materiais, no entanto, os métodos propostos para a determinação da solubilidade são demorados. Mais recentemente, a solubilidade dos corantes e suas concentrações têm sido quantificadas por HPLC e espectrofotometria UV-vis (PETERS e FREEMAN, 1996). A espectrofotometria baseia-se na absorção da radiação nos comprimentos de onda que vão desde o ultravioleta ao infravermelho, passando pelo faixa do visível (LEAL, 2011). Um espectro Ultravioleta-Visível corresponde a um gráfico de Absorbância vs Comprimento de onda que abrange a faixa do ultravioleta (200 a 400 nm) e do visível (400 a 750 nm) (EWING, 1971, p. 07).O espectrofotômetro, aparelhagem utilizada na espectroscopia, informa a quantidade de luz absorvida a cada comprimento de onda. O conjunto das absorbâncias relacionadas aos vários comprimentos de onda para um composto é denominado de espectro de absorção (LEAL, 2011).Em virtude da quantidade de luz absorvida estar relacionada à concentração da substância pela lei de Lambert-Beer, a análise espectrofotométrica permite quantificar a concentração de uma determinada substância em cada solvente utilizado (HARRIS, 2005). De acordo com a lei de Lambert-Beer a absorbância, A, é diretamente proporcional à concentração, c, da espécie que absorve luz na amostra através da equação abaixo (SKOOG, HOLLER e NIEMAN, 1998): A=cεb (1). Onde, a concentração da amostra é expressa em mols por litro (mol/L), o percurso óptico (b) é expresso em centímetros, o coeficiente de absortividade molar (ε) é expresso em (mol/L)-1/cm. De acordo com a equação (1), pode-se deduzir que quanto maior a absortividade molar, tanto maior será a absorbância da amostra analisada.Segundo Harris (2005) a medida da absorbância aplica-se à maioria das substâncias quando a radiação é monocromática e as soluções são muito diluídas (≤0,01 mol/L). Desta forma, o objetivo deste estudo foi verificar por meio da determinação da concentração através da espectroscopia Ultravioleta-Visível (UV-vis) e da Lei de Lambert-Beer, a eficiência de diferentes solventes orgânicos (clorofórmio, álcool etílico, álcool isopropílico, acetona e dimetilsulfóxido) na dissolução do corante natural bixina.
Material e métodos
Os procedimentos experimentais da pesquisa foram realizados no laboratório de Físico-Química do Instituto Federal de Educação, Ciência e Tecnologia do Piauí. As sementes do urucunzeiro, fonte do produto natural bixina, foram adquiridas na zona rural da cidade de Teresina – PI. 100g das sementes foram adicionadas a um becker com 500mL de água sob agitação constante durante 1 hora em seguida foram feitas duas filtrações, uma com uma peneira para separar as sementes da solução e a outra com papel filtro. O corante retido no papel filtro foi levado para uma estufa e aquecido durante 2h a 70ºC e depois macerado para análise. Para a realização do teste de solubilidade foram preparadas 5 soluções utilizando-se os seguintes solventes orgânicos: acetona (C3H6), álcool Etílico (C2H6O), álcool isopropílico (C3H8O), dimetilsulfóxido (C2H6SO) e clorofómio (CHCl3). Foram dissolvidos 0,0012g de bixina, pesada em balança analítica (BEL Engineering M214Ai), em 30 mL de cada solvente.A absorbância foi medida em função do comprimento de onda de cada uma das soluções por meio de análise dos espectros de UV-Vis, obtidos em um espectrofotômetro Shimadzu UV-1800 na região de 800 a 200 nm. Aplicou- se a lei de Lambert-Beer aos resultados obtidos, determinando-se assim o melhor solvente, dentre os analisados, para o corante natural bixina.
Resultado e discussão
A Tabela 1 apresenta os valores de absorção da bixina em função do
comprimento de onda nos solventes utilizados na pesquisa, obtidos após a
análise no Uv-vis (espectroscopia do ultravioleta visível).
Parker (1999) dividiu os solventes em dois grupos de acordo com suas
interações específicas com ânions e cátions, nomeando-os solventes apróticos
dipolares e solventes próticos. Solventes apróticos dipolares, não são
doadores de ligação de hidrogênio, pois suas ligações C-H não são
suficientemente polarizadas, eles são geralmente doadores de pares de
elétrons e por isso solvatam cátions, devido à presença de pares solitários
de elétrons. Entre os mais importantes solventes apróticos dipolares está o
dimetilsulfóxido (DMSO). Por ser um solvente aprótico dipolar, o DMSO
dissolve muito bem o corante bixina que apresenta em sua estrutura, regiões
polares(C=O) e apolares(C—H).
A solução de clorofórmio também apresentou boa absorbância devido ao fato
do solvente ser muito apolar. Esse resultado corroboram com Agner (2004)
segundo ele o corante bixina é lipossolúvel, ou seja solúvel em compostos
apolares devidos às interações de Van der Waals entre as duas estruturas.
Para os outros solventes (Acetona, Álcool Isopropílico e Etanol), a
polaridade está aumentando respectivamente, sendo assim, a solubilidade dos
pigmentos de bixina vai diminuindo devido este dissolver melhor em
solventes apolares ou apróticos como é o caso do dimetilsulfóxido(DMSO).
Conforme a lei de Lambert-Beer a absorbância é diretamente proporcional a
concentração da solução, deste modo, a solução com maior teor de bixina
dissolvida será a de maior absorbância, enquanto que a de menor absorbância
será a de menor concentração.
Os dados obtidos referentes às análises no UV-Vis confirmam a maior
eficiência do dimetilfulfóxido como melhor solvente dentre os analisados,
visto que formou a solução que absorveu mais radiação, apresentado o maior
valor de absorbância. E a menor eficácia do Álcool Etílico em comparação aos
solventes analisados.
No gráfico da Figura 2. Estão os espectros de absorção na região
do UV-Vis (800 a 200 nm) dos pigmentos de Bixina nos diferentes solventes
utilizados na pesquisa.
Figura 2. Espectro de absorção no UV-Vis da Bixina em diferentes
solventes.
Fonte: Elaborada pelo autor
Analisando-se a absorbância das soluções a base de bixina no gráfico 1 fica
claro que a solução de Dimetilsulfóxido é a mais eficiente pois tem o maior
pico de absorção(0,801), seguida das soluções de Clorofórmio, Acetona,
álcool isopropílico e Álcool Etílico. Observou-se que todos os solventes
apresentaram um certo grau de dissolução do corante natural bixina pois
houve a formação dos três picos característicos dessa substância.
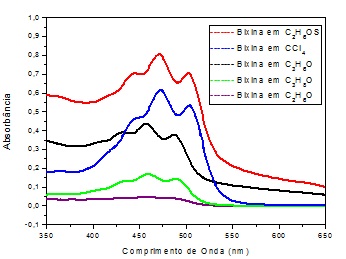
Espectro de absorção no UV-Vis da Bixina em diferentes solventes(DMSO, Clorofórmio, Acetona, Álcoo Etilico e Álcool Isopropilico).
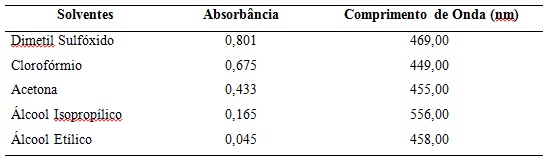
Fonte (próprio autor): Picos de absorção em função do comprimento de onda dos diferentes solventes utilizados na pesquisa.
Conclusões
Por meio de um método simples foi possível determinar a eficiência da ação de solventes orgânicos sobre os pigmentos de bixina. O Dimetilsulfóxido apresentou-se como o melhor dentre os solventes analisados, um resultado relevante para as pesquisas sobre o uso de corantes naturais, visto que tais corantes estão sendo cada vez mais utilizados na indústria em substituição aos corantes sintéticos. A bixina, em especial, tem despertado o interesse de muitos pesquisadores devido ser um produto natural de baixa toxicidade, fácil obtenção e baixo custo.
Agradecimentos
Ao IFPI (Instituto Federal de Educação, Ciência e Tecnologia do Piauí), pelo suporte técnico durante as análises, e à CAPES/ FAPEPI pelo suporte financeiro à pesquis
Referências
AGNER, A.R. et al. Absence of carcinogenic and anticarcinogenic effects of annatto in the rat liver medium-term assay. Food and Chemical Toxicology, v.42, n.10, p.1687-1693, 2005. Disponível em: . Acesso em: 2 set. 2010. doi:10.1016/ j.mrgentox.2005.01.009.
COSTA, Charllyton Luis S. da; CHAVES, Mariana H. Extração de pigmentos das sementes de Bixa orellana L.: uma alternativa para disciplinas experimentais de química orgânica. Quím. Nova, São Paulo, v. 28, n. 1, p. 149-152, 2005.
EWING, G W. Métodos Instrumentais de Análise Química (Volume 1). São Paulo. Editora Edgard Blücher, 1971.
HARRIS, D. C. Análise Química Quantitativa. 6ª edição. Rio de Janeiro, LTC – Livros Técnicos e Científicos Editora S.A., Rio de Janeiro, 2005.
LEAL, C. S. M. Solubilidade de corantes azo. Dissertação de Mestrado - Química Industrial, Universidade da Beira Interior, Covilnã, 2011.
OLIVEIRA, J. S. de. Caracterização, extração e purificação por cromatografia de compostos de urucum (Bixa orellana L.). Tese de Doutorado - Programa de Pós-Graduação em Engenharia Química, Universidade Federal de Santa Catarina, Florianópolis, 2005.
PETERS, A. T.; FREEMAN, H. S. Physico-Chemical Principles of Color Chemistry. Blackie Academic & Professional, volume 4, 1996.
PINMENTEL, F. A.; STRINGHETA, P. C. Produção de corantes de urucum em pó, por meio de precipitação ácida, a partir de extratos obtidos em diferentes soluções extratoras. Rev. Bras. Cor. Nat. vol. 1, p. 53 – 57, 1999.
RUSSEL, J. B. Química Geral. 2º ed. São Paulo: Makron Books, v. 1, 2008.
SKOOG, D. A.; HOLLER, F. J.; NIEMAN, T. A.; Principles of Instrumental Analysis, 5th ed., Saunders College: Philadelphia, 1998.
TOCCHINI, L.; MERCADANTE, A. Z. Extração e determinação, por CLAE, de bixina e norbixina em coloríficos. Ciênc. Tecnol. Alim., v. 21, p. 310-313, 2001.
YUSÁ-MARCO, D. J. et al. Characterization of colouring compounds in annatto (Bixa Orellana L.) used in historic textiles by means of Uv-Vis spectrophotometry and Ft-Ir spectroscopy. Arché. Publicación del Instituto Universitario de Restauración del Patrimonio de la UPV - Núm. 3, p. 153 – 158, 2008.











