ISBN 978-85-85905-19-4
Área
Ambiental
Autores
Rodrigues Filho, G.M. ((UFRRJ)) ; Higino, M.L. ((UFRRJ)) ; Megale, E.Z. ((UFRRJ)) ; Mendes, M.F. ((UFRRJ))
Resumo
O presente trabalho trata do processo de adsorção com uso de argila na remoção de corante têxtil, com experimentos em triplicata, usando argila Pure Flo Supreme e o corante Amarelo Reativo BF-4G, alcançando uma eficiência de remoção de 100% e quantidade adsorvida de 50 mg/g. Foi observada a completa perda de coloração da solução corante nos primeiros minutos de reação para os ensaios realizados em concentrações de 50 e 100 mg/L em todas as temperaturas trabalhadas 298, 303, 313 e 323 K. O modelo pseudo-segunda ordem se ajustou melhor aos dados, com R2 de 0,9998, 1,0000, 1,0000, 0,9969, assim como, a equação de Freundlich com valores de n de 9,20, 7,75, 11,25 e 1,09 e k de 38,03, 66,53, 27,88 e 9,94, respectivamente para todas as temperaturas estudadas, indicando uma adsorção favorável.
Palavras chaves
Adsorção; cinética; corante
Introdução
A crescente quantidade de compostos corados depositados nos recursos hídricos é um dos problemas mais indesejáveis relacionados ao meio ambiente, ocasionando um aumento da poluição no corpo receptor, o que requer a busca urgente por novas alternativas. Por exigir em seu processo produtivo um grande consumo de água, a indústria têxtil gera efluentes corados que, ao não passarem por um tratamento adequado, propiciam enormes problemas ao ambiente. Corantes orgânicos constituem um dos maiores grupos de poluentes nas águas residuais lançados pelo setor têxtil e outras indústrias (ELMOUBARKI et al., 2015). Corantes azo são usados extensivamente nas áreas têxteis, papel, alimentos, couro, cosméticos e farmacêutica (AL-AMRANI et al., 2014). Um dos métodos mais eficientes para a remoção de poluentes orgânicos de corantes é a adsorção (CRINI e BADOT, 2008). Argilas e minerais de argila são abundantes, baratos e materiais ambientalmente favoráveis aplicados como adsorventes. Muitos estudos atualmente desenvolvidos de novos materiais tem o objetivo de criar adsorventes capazes de atuar com grande eficiência em processos de adsorção e catalíticos (STRAWN et al., 1999; FROST et al., 2001; VENEZUELA e SANTOS, 2001); dentre os materiais mais estudados, estão as estruturas lamelares sintéticas e naturais como a esmectita, talco e zeólitas. Uma vantagem da ciência dos materiais está na obtenção de superfícies com grande capacidade de reação, partindo de materiais naturais como é o caso de argilominerais, usualmente aplicados em processos de modificação química estrutural/e ou superficial, como a montmorilonita no processo de pilarização (GUERRA et al., 2009), caulinita modificada com dimetil sulfóxido (GUERRA et al., 2011; FROST et al., 2001) e argilominerais organofuncionalizados com a imobilização de silanos que possuem grupos funcionais básicos, ancorados em sua superfície (LAZARIN e AIROLDI, 2009). Essas argilas mostram uma forte afinidade para a adsorção de corantes catiônicos e aniônicos (YAGUB et al., 2014). Alguns estudos da literatura investigaram a influência da temperatura no processo de adsorção utilizando argilas (GUERRA et al., 2011) estudaram a esmectita organo funcionalizada da Amazônia para a remoção de corante em solução aquosa e observaram que as capacidades de adsorção e remoção de cor da amostra de argila natural foram predominantemente altas nas temperaturas de 298, 303, 308 e 313 K. Concluíram que a adsorção do corante dependia do pH e do tempo de contato. O pH ótimo para a adsorção variou de 4,0 a 5,0 para todos os sistemas e o tempo de contato mínimo necessário para atingir o equilíbrio foi entre 12-16 minutos. Foi observado também que os sistemas são exotérmicos apresentando energia livre de Gibbs negativa e entropia positiva. De acordo com (ERRAIS et al., 2012) que avaliaram as propriedades de adsorção e mecanismo na superfície da argila bruta no corante RR120 e perceberam que a caulinita na argila crua Fouchana desempenha um papel importante na adsorção de corantes aniônicos, principalmente devido aos seus locais de superfície ácidas, mas também para alumínio trocável (III), cátions atuando como pontes entre o barro mineral e as moléculas de corante. A motivação para a realização desta pesquisa versa em propor uma técnica viável, de fácil operação e com baixo custo para a remoção de cor em efluentes têxteis, utilizando argila ativada ácida clarificante Pure Flo Supreme B81. Não existem trabalhos na literatura utilizando este adsorvente como agente clarificante de material orgânico proveniente de corante de efluente têxtil.
Material e métodos
O corante usado foi o Amarelo Reativo (Texpal, Brasil), foi utilizado como adsorvente a argila ativada ácida Pure Flo Supreme B81 (Oil-Dri, EUA). Inicialmente, preparou-se soluções contendo o corante, com concentrações de 50, 100, 150 e 200 mg/L. Foram usados uma mesa Orbital Digital Shaker (SK-O180-Pro) e um banho-maria com circulação externa (NT 249-269 Novatecnica). O shaker foi acoplado ao banho-maria a fim de manter a temperatura desejada durante a adsorção. Em erlenmeyers de 250 mL foram misturados 50 mL de corante, 0,2 g de argila e 10 g de NaCl P.A. Estes foram colocados no shaker e mantidos em contato em temperaturas de (280, 303, 313 e 323 K) e tempos (1, 30, 60, 90, 120, 150, 180, 210 e 240 min). Os experimentos foram realizados em triplicata e em pH natural da solução (6,47), massa de adsorvente (0,2 g), massa de corante na solução (0,2 g), volume de corante (50 mL), tempo de contato (240 min) e agitação de 200 rpm. Ao fim do estudo cinético, a solução resultante foi filtrada a vácuo utilizando membrana milipore de fibra de vidro (GF, 47 mm). As concentrações de corante foram determinadas em Espectrofotômetro FEMTO (CIRRUS 60 SA). De posse dos dados obtidos e utilizando as equações (1-6) de quantidade adsorvida (1), percentual de remoção (2), pseudo-primeira ordem (3), pseudo-segunda ordem (4), Langmuir (5) e Freundlich (6) foram calculados os percentuais de remoção, as capacidades de adsorção e realizados os cálculos dos modelos de pseudo-primeira ordem, pseudo-segunda ordem e os parâmetros cinéticos das isotermas. As determinações do percentual de remoção de cor (%) e da quantidade adsorvida q (mg/g), foram realizadas utilizando as equações (1) e (2). Sendo C0 e Ce (mg/L) as concentrações inicial e final do corante na solução, respectivamente, V (L) o volume de efluente, W (g) a massa de adsorvente, E(%) o percentual de remoção de cor, Ci a concentração inicial do corante e Cf a concentração final do mesmo. O modelo de pseudo-primeira ordem (equação 3) e pseudo-segunda ordem (equação 4) representam os modelos cinéticos escolhidos. Sendo qeexp. e qecalc. as quantidades adsorvidas no equilíbrio, k1 e k2 as constantes de primeira e segunda ordem e R2 o coeficiente de determinação. No modelo pseudo-primeira ordem, a adsorção ocorre pela ocupação de um sítio ativo do adsorvente (LAGERGREN, 1898) e no modelo de pseudo-segunda ordem, o adsorbato ocupa o adsorvente por dois sítios ativos (WEBER et al., 1963). As isotermas de adsorção aplicadas aos dados experimentais (Langmuir) em que a adsorção ocorre em sítios específicos e homogêneos do adsorvente (LANGMUIR, 1918) e (Freundlich) onde o adsorbato ocupa o adsorvente por dois sítios ativos (WEBER et al., 1963), estão apresentadas nas equações (5) e (6), sendo qo e b constantes relacionadas com a capacidade de adsorção máxima e energia de ativação,respectivamente e k é a constante de Freundlich, n está relacionado com a distribuição de sítios energéticos e R é o coeficiente de correlação.
Resultado e discussão
A Tabela 1 mostra para as temperaturas estudadas os parâmetros dos modelos cinéticos, assim como, os resultados experimentais. A concentração inicial de corante escolhida para este estudo foi de 200 mg/L.
Verifica-se que a modelagem pseudo-segunda ordem é a que melhor se adequa ao processo de adsorção estudado.
A Tabela 2 mostra os resultados dos estudos com as isotermas de Langmuir e Freundlich, sendo os perfis das isotermas de adsorção do corante descritos pelos referidos modelos para as temperaturas de 298 e 313 K mostrados na Figura 1. Esta apresenta os dados experimentais melhor ajustados pela equação de Freundlich. A isoterma de Freundlich é função de dois parâmetros, k e o expoente 1/n. Segundo (SPOSITO,1989), o valor de n do modelo está relacionado com a distribuição de sítios energéticos. Os valores de n neste trabalho variaram de 1,09 a 11,25, superiores a um em todas as temperaturas, indicando a presença de sítios altamente energéticos. O modelo de Freundlich indicou maior capacidade de adsorção (k) para a temperatura de 303 K. O fato da cinética ser rápida pode ser explicado através do uso do NaCl, onde eletrólitos são adicionados ao banho de tingimento têxtil para melhorar a solidez da cor (RIGA et al., 2007). Verificou-se assim que o método utilizado no presente trabalho produz resultados satisfatórios quando comparados com os de (MAFRA et al., 2013).
Alguns estudos na literatura mostram comportamentos semelhantes (DOTTO et al., 2011) compararam quitosana, carvão ativado, terra ativada, quitina e terra diatomácea como adsorventes para a remoção dos corantes azul brilhante, amarelo crepúsculo e amarelo tartrazina de soluções aquosas com diferentes pHs. Os resultados apresentados mostraram que a quitosana em pH 3 foi o melhor adsorvente para todos os corantes, removendo 50, 90 e 80% dos corantes azul brilhante, amarelo crepúsculo e amarelo tartrazina, respectivamente e foi observado que o aumento da temperatura causou uma diminuição na capacidade de adsorção.
(BULUT, OZACAR e SENGIL, 2008) e (TAHIR e RAUF, 2006) estudaram a adsorção do corante verde malaquita em bentonita, e avaliaram a capacidade de adsorção do corante em diferentes parâmetros, tais como: concentração, pH, quantidade de adsorvente e tempo de contato. Observaram que a isoterma apresentou uma quantidade de corante adsorvida por unidade de adsorvente de aproximadamente, 7,2 mg/g, obtendo resultados inferiores aos apresentados neste trabalho.
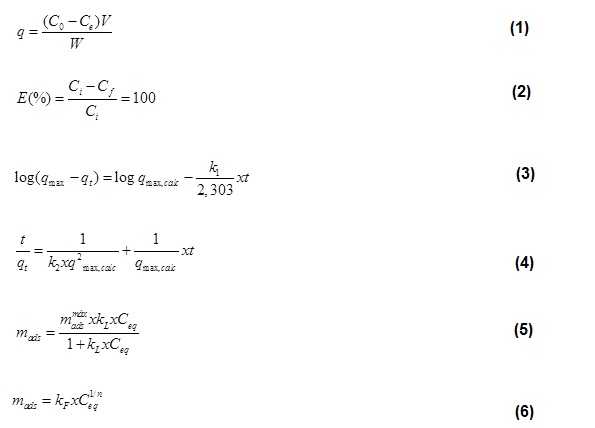
Equações de quantidade adsorvida (1), percentual de remoção (2), pseudo-primeira ordem (3), pseudo-segunda ordem (4), Langmuir (5) e Freundlich (6).
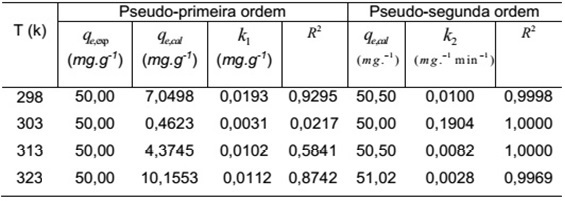
Temperaturas estudadas e modelagem pseudo-primeira ordem e peseudo-segunda ordem de reação cinética.
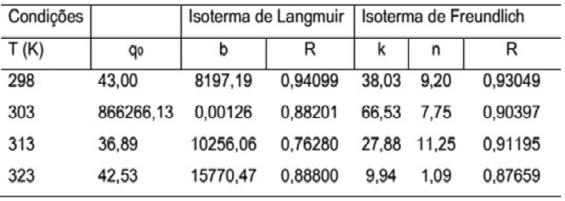
Comparação entre as isotermas de Langmuir e Freundlich nas temperaturas estudadas.
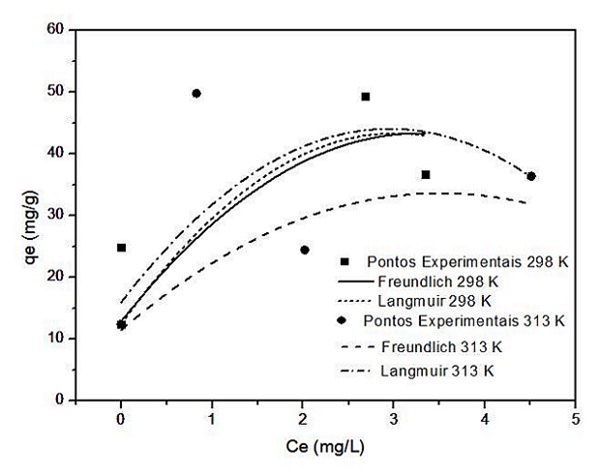
Relação entre as isotermas de Langmuir e Freundlich com os dados experimentais nas temperaturas de 298 e 313 K.
Conclusões
Diante do exposto, pode-se concluir que a adsorção é uma técnica promissora e viável para a remediação de corantes têxteis usando a argila ácida clarificante Pure Flo Supreme B81. Os melhores resultados foram a 298 K, atingindo 100% de remoção de cor no primeiro minuto do processo. Este comportamento também ocorreu nos ensaios para as demais temperaturas em estudo, já que é possível perceber sua ocorrência para as concentrações abaixo de 150 mg/L nos 100 primeiros minutos de reação. Foi observado ao se analisar comportamento da capacidade adsorvida, que essa chegou a 50 mg/g em praticamente todos os ensaios estudados e em especial a 298 K. Foi observado que a elevação da temperatura não causou aumento significativo na capacidade de adsorção. O modelo de pseudo-segunda ordem se ajustou melhor aos dados experimentais e a adsorção obedeceu a isotérma de Freundlich.
Agradecimentos
Os autores agradecem a CAPES, ao CNPq e a FAPERJ pelo apoio financeiro, a Texpal pelo fornecimento do corante e ao DEQ/PPGEQ/UFRRJ.
Referências
AL-AMRANI, W. A.; LIM, P-E.; SENG, C-E; NGAH, W. S. W. Bioregeneration of azo dyes-loaded mono-amine modified silica in batch. system: Effects of particle size and biomass acclimation condition. Chemical Engineering Journal, n° 251, 175–182, 2014.
CRINI, G.; BADOT; P. M. Application of chitosan, a natural aminopolysaccharide, for dye removal from aqueous solutions by adsorption processes using batch studies: a review of recent literature. Progress in Polymer Science, n° 33, 399-447, 2008.
DOTTO, G. L.; VIEIRA M. L. G.; GONÇALVES, J. O.; PINTO L. A. A. Remoção dos corantes azul brilhante, amarelo crepúsculo e amarelo tartrazina de soluções aquosas utilizando carvão ativado, terra ativada, terra diatomácea, quitina e quitosana: estudos de equilíbrio e termodinâmica. Quimica Nova, n° 34, 1193-1199, 2011.
ELMOUBARKI, R.; MAHJOUBIA, F. Z.; TOUNSADI, H.; MOUSTADRAFA, J.; ABDENNOURI, M. ZOUHRI, EL ALBANI A.; BARKA N. Adsorption of textile dyes on raw and decanted Moroccan clays: Kinetics, equilibrium and thermodynamics. Water Resources and Industry, n° 9, 16–29, 2015.
ERRAIS, E; DUPLAY, J.; ELHABIRI, M., KHODJA, M.; OCAMPO, R.; BALTENWECK-GUYOT, R.; DARRAGI, F. Anionic RR120 dye adsorption onto raw clay: Surface properties and adsorption Mechanism. Colloids and Surfaces A: Physicochemical and Engineering Aspects, v. 403, 69–78, 2012.
FREUNDLICH, H. M. F. Uber die adsorption in losungen. Z. Phys. Chem., n° 57(A), 385-470,1906.
FROST, R. L.; KRISTOF, J.; HORVATH, E.; KLOPROGGE, J. T. The Modification of hydroxyl surfaces of formamide-intercalated kaolinites synthesized by controlled rate thermal analysis. Journal of Colloid and Interface Science, v. 239, n°1, 126-133, 2001.
GUERRA D. L.; LEMOS, V. P.; ANGÉLICA, R. S.; AIROLD, C. Influência da razão Al/Argila no processo de pilarização da esmectita. Cerâmica, v. 52, n° 323, 200-206, 2009.
GUERRA, D. L.; SILVA, W. L. L.; OLIVEIRA, H. C. P.; VIANA, R. R.; AIROLDI, C. Organofunctionalized Amazon smectite for dye removal from aqueous medium—Kinetic and thermodynamic adsorption investigations. Journal of Hazardous Materials, n°186, 675–682, 2011.
LAGERGREN, S. Zur theorie der sogenannten adsorption gelöster stoffe, Kungliga Svenska Vetenskapsakademiens. Handlingar, v. 24, n° 4, 1-39,1898.
LANGMUIR, I., The adsorption of gases on plane surfaces of glass, mica and platinum. J. Am. Chem. Soc., n° 40, 1361-1403, 1918.
LAZARIN, A. M.; AIROLDI, C. Thermodinamics of the nickel and cobalt removal from aqueous solution by layered crystalline organofunctionalized barium phosphate. The Journal of Chemical Thermodinamics, 21-25, 2009.
MAFRA, M. R., IGARASHI-MAFRA, L., ZUIM, D. R., VASQUES, É. C., FERREIRA, M. A. Adsorption of remazol brilliant blue on an orange peel Adsorbent. Brazilian Journal of Chemical Engineering, v. 30, n° 3, 657-665, July - September, 2013.
RIGA, A., SOUTSAS, K., NTAMPEGLIOTIS, K., KARAYANNIS, V., PAPAPOLYMEROU, G. Effect of system parameters and of inorganic salts on the decolorization and degradation of Procion H-exl dyes. Comparison of H2O2/UV, Fenton, UV/Fenton, TiO2/UV and TiO2/UV/H2O2 processes. Desalination, v. 211, n° 1–3, 10, June 72-86, 2007.
SANTOS, R. M., Processo de adsorção de Cádmio e Chumbo em Argila. Unicamp, Campinas, 28, 2005.
SPOSITO, G. 1989. The Chemistry of Soils. 277 pp. New York, Oxford: Oxford University Press,
STRAWN, D. G.; SPARKS, D. L. The use of XAFS to distinguish between inner- and outer sphere lead adsorption complex on montmorillonite. Journal of Colloid and Interface Science, v. 216, 257-269, 1999.
TAHIR S.S, RAUF, N. Removal of a cationic dye from aqueous solutions by adsorption onto bentonite clay. Chemosphere, n° 11, 1842-8, 2006.
WEBER, A.; HERZ, R.; REISS I. On the mechanism of the relaxing effect of fragmented sarcoplasmic reticulum. J. gen Physiol, n° 46, 679–702, 1963.
YAGUB, M. T.; SEN, T. K.; AFROZE, S.; ANG, H. M. Dye and its removal from aqueous solution by adsorption: A review. Advances in Colloid and Interface Science, n° 209, 172-184, 2014.











