ISBN 978-85-85905-19-4
Área
Ensino de Química
Autores
de Moraes Silva, A. (IFRJ) ; Guimarães Faillace, J. (IFRJ) ; Cavalcante de Brito Mello, L. (IFRJ) ; Viana de Freitas, L. (IFRJ)
Resumo
O CICLO DE BORN-HABER É NORMALMENTE ESTUDADO NAS DISCIPLINAS DE QUÍMICA GERAL E QUÍMICA INORGÂNICA DOS CURSOS DE GRADUAÇÃO EM QUÍMICA. ESSE CICLO RELACIONA A ENERGIA RETICULAR COM OUTRAS QUANTIDADES TERMOQUÍMICAS. COM O OBJETIVO DE QUE O ESTUDO DO CICLO DE BORN-HABER NÃO FICASSE RESTRITO A CÁLCULOS E DEMONSTRAÇÕES TEÓRICAS EM SALA DE AULA, FORAM PESQUISADAS EXPERIMENTAÇÕES PARA SEREM EXECUTADAS EM LABORATÓRIO, PERMITINDO A CONSTRUÇÃO DO CICLO. AS REAÇÕES SELECIONADAS FORAM A DO ALUMÍNIO COM IODO E A DO SÓDIO COM O ENXOFRE. ATRAVÉS DA CONSTRUÇÃO DO CICLO DE BORN-HABER DAS REAÇÕES REALIZADAS EM LABORATÓRIO E A COMPARAÇÃO COM OS RESULTADOS DA EQUAÇÃO DE BORN-LANDÉ FOI POSSÍVEL TRABALHAR, ENTRE OUTROS, CONCEITOS COMO LIGAÇÕES QUÍMICAS, ENERGIA RETICULAR E FORMAÇÃO DE SÓLIDOS IÔNICOS.
Palavras chaves
Ciclo; Ensino; Química
Introdução
O ciclo de Born-Haber é normalmente estudado nas disciplinas de Química Geral e Química Inorgânica dos cursos de graduação em Química. Esse ciclo relaciona a energia reticular com outras quantidades termoquímicas. Frequentemente, ao estudarmos o tema, comparamos o resultado da energia reticular obtido pelo ciclo com o valor teórico obtido pela equação de Born- Landé. Quanto maior a concordância dos valores, maior o caráter iônico da ligação e mais apropriado é o uso da equação para prever a energia reticular do sólido formado.(Atkins) Com o objetivo de que o estudo do ciclo de Born- Haber não ficasse restrito a cálculos e demonstrações teóricas em sala de aula, foram pesquisadas experimentações para serem executadas em laboratório, que permitissem a construção do ciclo e a análise da espontaneidade da reação
Material e métodos
A primeira reação selecionada e testada pelos alunos no laboratório foi a do alumínio em pó com o iodo pulverizado, com a adição de uma gota d’água a esta mistura, sendo realizada em gral de porcelana. A outra reação foi a do sódio metálico com o enxofre, realizada em tubo de ensaio pyrex, com aquecimento inicial realizado através de um bico de Bunsen. A partir dessas reações, onde duas substâncias elementares reagem produzindo um sal com maior ou menor característica iônica, propusemos aos alunos a construção e a análise do ciclo de Born-Haber que melhor representasse o fenômeno. Sugerimos a pesquisa bibliográfica dos dados experimentais necessários para os cálculos assim como o uso de sites que disponibilizassem material sobre o assunto na forma de exercícios.
Resultado e discussão
Durante a prática, foram observadas as características das reações, onde a
reação do alumínio com o iodo, ao se adicionar pequena quantidade de água
leva à ignição o produto, já que o iodeto de alumínio é muito instável e
reage violentamente com a água. Já a reação do sódio com o enxofre, após
pequeno aquecimento do conjunto, onde o sódio é fundido, é também
extremamente vigorosa. A partir das experimentações realizadas, foram
analisadas as etapas da reação e a sua espontaneidade sendo proposta a
construção do ciclo de Born-Haber para as reações entre iodo e alumínio e
entre sódio e enxofre. Na Figura 1 são apresentadas as etapas do ciclo para
o sulfeto de sódio proposto pelo site indicado no referencial bibliográfico,
em que uma das etapas é colocada como incógnita para cálculo pelo
internauta. A resposta é conferida pelo programa.
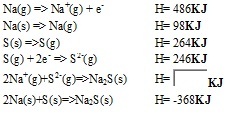
A figura destaca as etapas para o Ciclo de Born- Haber para o sulfeto de sódio.
Conclusões
Os resultados encontrados para os valores de energia reticular calculados utilizando-se o ciclo de Born-Haber e os valores teóricos obtidos pela equação de Born-Landé foram divergentes para ambos os experimentos, sugerindo caráter covalente aos compostos, sendo mais significativo para o AlI3. A realização do como procedimento experimental permite um melhor entendimento do conteúdo teórico de sólidos iônicos, além de favorecer a contextualização de diversos conceitos teóricos anteriormente estudados, como estrutura atômica, ligações químicas e polarizabilidade.
Agradecimentos
IFRJ
Referências
1- ATKINS,Peter W. et al Química Inorgânica.4 ed. Porto Alegre: Bookman,2008.
2- Disponível em:http://www.sciencegeek.net/Activities/bornhaber.html. Acessado em 18/08/16.











