ISBN 978-85-85905-19-4
Área
Ensino de Química
Autores
Rodrigues, R.C. (UEPA) ; Ramos, G.C. (UEPA) ; Rodrigues-moura, S. (IFPA/CAMPUS PARAUAPEBAS)
Resumo
Experimentar recursos naturais para o ensino de química tão somente é um meio eficaz na orientação do estudante a compreender e apreciar seu meio, como um desafio para a sua aprendizagem. Como elemento potencial para o desenvolvimento desta pesquisa, utilizamos a flor conhecida como “onze-horas”, do gênero Portulaca glandiflora e por ser uma espécie que possui um pigmento característico, advindo das antocianinas. A metodologia aplicada possibilitou uma reconstrução da práxis pedagógica trazendo novas possibilidades para o ensino de química e gerando resultados satisfatórios a partir da proposta apresentada.
Palavras chaves
ensino de química; onze-horas; indicador ácido-base
Introdução
A Portulaca Grandiflora é uma planta nativa da América do Sul, muito resistente ao clima quente e de manejo fácil, contendo pétalas delicadas em várias cores vibrantes, tornando-se uma felicidade em flor para ornamentação, desabrochando por volta das onze horas quando a luz solar fica mais intensa e se recolhe no final do dia, quando o sol se põe, tendo florescimento o ano inteiro (XXX). Por se tratar de uma planta que nos despertou o interesse de pesquisa, percebemos que pode servir como um potencial indicador ácido-base, pelo fato de o extrato de suas flores apresentarem antocianinas em sua composição, substâncias do grupo flavonoides capazes de mudar a coloração de produtos conforme o seu pH. Nesse sentido, contextualiza os buscamos meios para contextualizar o conhecimento da química aos aspectos do cotidiano do estudante, dando-nos a possibilidade de reconstrução da prática docente, bem como nos permitir como professores preocupados com a realidade educacional atual para conduzir o estudante a desvendar as múltiplas realidades existentes no seu meio. (FREIRE, 1970)
Material e métodos
Apesar de a flor da onze-horas possuir variados tons de cores que passam pelo branco, amarelo, rosa e vermelho, seja ela com flores simples ou dobradas e até em série, utilizamos em nossa pesquisa o extrato das pétalas de cor vermelho, pela maior concentração de antocianina característica da pigmentação vermelho e azul (MEZAROBA, 2001). Foram utilizadas no experimento pétalas maceradas de três flores onze-horas adicionadas em 100 mL de álcool etílico a 70%, deixando-as mergulhadas na solução por trinta segundos, o que formou uma solução vermelho escuro, por conta da ação do álcool nos pigmentos da flor, a qual foi filtrada. Em cinco tubos de ensaio foram utilizadas 10 mL de soluções distintas previamente preparadas com o objetivo de testar o possível indicador e medidos seu potencial hidrogeniônico em laboratório: (1) extrato do limão biribirí (Averrhoa bilimbi); (2) vinagre (H3CCOOH); (3) sabão líquido verde (C17H35COO-Na+); (4) hidróxido de magnésio [Mg(OH)2] e (5) soda cáustica (NaOH). Após esse processo, em cada tubo contendo as soluções anteriormente descritas foram adicionada a solução obtida do extrato da flor onze-horas.
Resultado e discussão
Para misturar a solução do extrato da flor aos elementos citados
anteriormente, utilizamos uma seringa descartável contendo 5 mL de solução e
adicionamos nos cinco tubos de ensaio. Após 30 segundos, pode-se notar a
mudança na coloração das misturas nos tubos, como detalha a Tabela 1.
Ao adicionar o extrato das pétalas da flor onze-horas nos tubos contento
solução de biribirí, vinagre, água destilada, sabão líquido e bicarbonato de
sódio, a mistura final apresentou uma coloração diferenciada, como mostram a
Tabela 1 e a Figura 3, demostrando o grande potencial de as pétalas
funcionarem como indicador ácido-base.
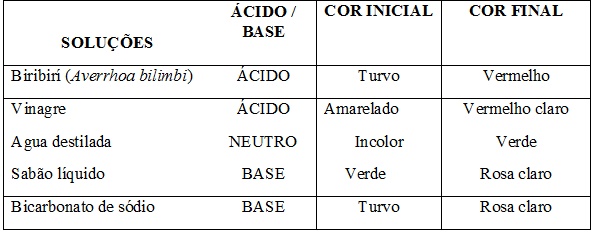
Soluções e colorações de ácido-base.

Misturas indicativas do indicador ácido-base.
Conclusões
O extrato das pétalas da flor onze-horas demonstrou seu potencial de indicar substâncias ácidas e básicas, mesmo sem a necessidade de usar um pHmetro para saber seu caráter ácido-base, mas apenas pela coloração apresentada nos tubos de ensaios ao adicionar a solução. Nossa metodologia apresenta não só a busca por novos indicadores químicos, mas a dinamização que um professor pode buscar no meio social e conduzir os estudantes a um processo educativo mais prazeroso e que permita-lhe ser o protagonista de suas ações e exercendo sua cidadania.
Agradecimentos
A Deus, primeiramente, por nos conceder sabedoria e aos parceiros que conduziram com presteza esta pesquisa.
Referências
FREIRE, P. Pedagogia do Oprimido. Rio de Janeiro: Paz e Terra, 1970.
MEZAROBA, M. E. P. C. Extração de antocianina de casca de uva isabel. Dissertação (Mestrado em Engenharia Química), Universidade federal de Santa Catarina, Florianópolis, 2001.











