ISBN 978-85-85905-19-4
Área
Produtos Naturais
Autores
Almeida, L.S. (UFPA) ; da Trindade, R.C.S. (UFPA) ; Meirelhes, E.N. (UFPA) ; Xavier, L.P. (UFPA) ; Maia, J.G.S. (UFOPA) ; de Mello, A.H. (UNIFESSPA) ; Ramos, A.R. (UNIFESSPA) ; da Silva, J.K.R. (UFPA)
Resumo
Este estudo buscou analisar a composição química do óleo essencial (OE) e monitorar a atividade da Lipoxigenase (LOX) em mudas de Piper nigrum com (PNFMA) e sem (PN) fungos micorrízicos arbusculares (FMAs). Os OEs de folhas e raízes foram extraídos por hidrodestilação e analisados por cromatografia gasosa acoplada a espectrometria de massas. A atividade da LOX foi feita em 7, 21, 30, 45 e 60 dias após a inoculação (DAI) com FMAs. Os OEs das folhas e raízes mostraram-se ricos em compostos terpênicos como δ-elemeno, elemol, α-bisabolol, canfeno, limoneno e β- cariofileno. Em folhas de PNFMA a atividade da LOX foi maior a partir do 21º DAI e nas raízes do 7º DAI. A associação P. nigrum com FMAs promoveu variações na composição química de seus OEs e a ativação e/ou aumento da atividade de LOX.
Palavras chaves
composição química; atividade enzimatica; via metabolica
Introdução
Piper nigrum L. conhecida popularmente como pimenta-do-reino é uma planta trepadeira perene pertencente à família Piperaceae (APG III, 2009 ). Os frutos de pimenta-do-reino possuem pungência característica devido à presença do alcaloide piperina e são utilizados na indústria de alimentos, cosméticos e na fitoterapia tradicional (Gopalakrishnan et al., 1993; Ravindran, Kallupurackal, 2004). Além disso, os demais órgãos da espécie possuem óleos essenciais (OE) ricos em terpenos tais como: limoneno, β- cariofileno, β-pineno, sabineno, mirceno, canfeno, entre outros (Singh et al., 2004; Zachariah, Parthasarathy, 2008). O Estado do Pará é o maior produtor brasileiro de pimenta-do-reino (Lourinho et al., 2014). Contudo, desde a década de 50 têm ocorrido perdas na produtividade da cultura, devido a ocorrência da doença fusariose, causada pelo fungo Fusarium solani f. sp. piperis (Albuquerque, Duarte, 1986). A prospecção de biomoléculas ativas e o uso de fungos micorrízicos arbusculares (FMAs), podem constituir formas de controle biológico à fusariose (Chu et al., 1997). FMAs são simbiontes vegetais obrigatórios, que auxiliam na nutrição e defesa das plantas (Azcón-Aguilar, Barea, 1996). Algumas enzimas vegetais, tal como as lipoxigenases (LOXs) estão envolvidas no controle da colonização por FMAs e no aumento da resistência a fungos patógenos (Morcillo, Ocampo, Garrido, 2012). Dessa forma, o objetivo do nosso estudo foi avaliar a composição do OE e monitorar a atividade da enzima Lipoxigenase de P. nigrum durante a associação com FMAs.
Material e métodos
As mudas de P. nigrum cv. Bragantina foram cedidas pela Embrapa Amazônia Oriental. Os inóculos de FMAs com a Universidade Federal do Sul e Sudeste do Pará (UNIFESSPA). Cinco mudas de P. nigrum foram inoculadas com FMAs (PNFMA) e outras cinco constituíram o grupo controle não inoculadas (PN). Folhas e raízes foram coletadas 90 dias após a inoculação (DAI) com FMAs e os OEs foram extraídos por hidrodestilação, durante 3h, e analisados por CG-EM. A identificação química foi feita baseada nas bibliotecas do sistema e por comparação com a literatura (Nist, 2011; Adams, 2007). A atividade de LOX foi determinada nas folhas (PNFFMA e PNF) e raízes (PNRFMA e PNR) coletadas nos intervalos de 7, 21, 30, 45 e 60 DAI (tratamento e controle, respectivamente). A obtenção da fonte de enzima para a realização do ensaio enzimático descrito por Vieira et al., 2001. E a determinação da atividade de LOX descrita por Axelrod et al., (1981). No qual considera o aumento da absorbância a 234nm. Uma mistura contendo 5µL de fonte de enzima, 50µL da solução de linoleato de sódio e 1.945µL de tampão fosfato de sódio foi utilizada como amostra. O branco foi constituído da mesma quantidade de substrato e 1950µL de tampão. A absorbância da reação foi determinada a 234nm a cada 30s durante 120s. As leituras foram realizadas em triplicata e a partir da regressão linear aos valores médios, foi obtida a inclinação da reta, pela qual se calculou a velocidade de formação de produtos, durante as reações enzimáticas. As velocidades foram expressas em (M/s), utilizando a seguinte equação: V= ΔA234/ε.l.t. Onde: ΔA234= variação da absorbância à 234nm; ε= 25.000 M-1.c-1 (coeficiente de extinção molar dos hidroperóxidos do ácido linoléico a 234nm); t= 120s (tempo de análise); l= 1,0cm (caminho óptico).
Resultado e discussão
A inoculação com FMAs resultou em variações qualitativas e quantitativas nos
compostos
majoritários (Tab1). Os compostos pentano, β-pineno, Z-β-ocimeno, timol, 2-
undecanona, α-
ilangeno, Z-α-bisabolol, óxido de ledeno e α-eudesmol foram encontrados apenas
no OEPNFFMA. Houve
aumento superior a 30% na concentração dos compostos 3Z-hexenol (0,2-0,6%), E-β-
ocimeno (0,9-
1,2%), germacrene D (2,6-3,3%), β-bisaboleno (2,6-3,3%), Z-sesquilavandulol
(0,8-1,2%), α-
eudesmol (0,91,2%). Não ocorreram mudanças significativas nos componentes do OE
de PNRFMA,
contudo houve a emissão em baixas proporções dos terpenos β-pineno, α-
felandreno, cis-muurola-
3,5-dieno e cubebol. Nos hidrocarbonetos sesquiterpenos sesquitujeno, α-E-
bergamoteno, β-
santaleno, β-bisaboleno e E--bisaboleno também houve aumento superior a 30% na
concentração.
A composição química do espécime estudado é semelhante ao coletado na Índia, que
exibiu como
majoritários α-bisabolol (24,3%), α-cubebeno (20,0%) e elemol (15,0%)
(Sasidharan e Menon, 2010).
A atividade enzimática de LOX em todos os grupos variou ao longo dos 60 dias
(Fig 1a, b e c).
Não houve variação significativa entre a atividade enzimática de PNF e PNFFM. A
partir do 7º DAI,
PNRFMA teve maior atividade enzimática, que se manteve até o 60º DAI. A maior
atividade em PNRFMA
pode ser relacionada com a inoculação dos FMAs, feita diretamente no solo. Os
resultados
corroboram a hipótese de Morcillo et al., 2012. Que embora FMAs estabeleçam uma
relação benéfica
com o hospedeiro, a fisiologia do vegetal controla o nível de colonização e visa
manter uma
relação simbiótica estável. Durante este mecanismo pode ocorrer à ativação de
LOXs, que exercem
funções no metabolismo primário e secundário do vegetal, sobretudo na defesa e
resistência contra
fungos fitopatógenos.
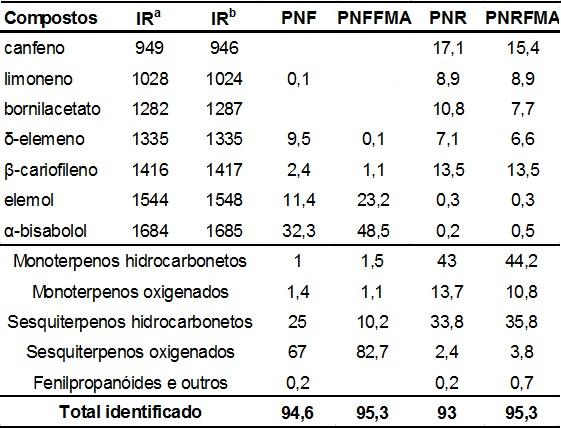
Componentes majoritários da fração volátil das folhas e raízes de P. nigrum cv. bragantina inoculadas e não-inoculadas com FMAs.
Atividade enzimática da LOX em folhas (A) e raízes (B) de P. nigrum micorrizadas e não micorrizadas e (C) velocidade de reação da LOX, para ambos.
Conclusões
Os resultados indicam que a inoculação de mudas de P. nigrum com FMAs pode alterar a composição química dos óleos essenciais quantitativa e qualitativamente. Além de ativar e/ou aumentar a ação da via das Lipoxigenase, que é uma importante via metabólica na defesa contra fitopatógenos.
Agradecimentos
A Embrapa Amazônia Oriental, a Universidade Federal do Sul e Sudeste do Pará, ao CNPQ, a FAPESTA.
Referências
ADAMS, R. P. Identification of essential oil components by gas chromatography / mass spectrometry. Illinois: Allured Publishing Corporation, 2007.
ALBUQUERQUE, F. C.; DUARTE, M. L. R. Estagio atual do conhecimento do melhoramento da cultura da pimenta-do-reino no trópico úmido brasileiro. Simpósio do Trópico Úmido, 1. Anais Proceedings Anales, v. 4, p. 359-372,1986.
APG III. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Botanical APG III. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, v.161, p.105-121, 2009.
AXELROD, B.; CHEESBROUGH, T. M.; LAASKO, S. Lipoxygenases from soybeans. Methods Enzymology, v.71, p.441-451, 1981.
AZCÓN-AGUIAR, C.; BAREA, J. M. Arbusculau mycorrhizas and biological control of soil-borne plant pathogens – an overview of the mechanisn involved. Micorrhiza, v. 6, p. 457-464, 1996.
CHU, E.Y.; ENDO, T.; STEIN, R. L. H.; ALBUQUERQUE, F. C. Avaliação da inoculação de Fungos Micorrízicos Arbusculares sobre a incidência da fusariose da pimenta-da-reino. Fitopatologia brasileira, v. 22, p. 205-208, 1997.
GOPALAKRISHNAN, M.; PADMAKUMARI, K. P.; JAYALEKSHMY, A.; NARAYANAN, C. S. Gas chromatographic analysis and odor profiles offew Indian genotypes of Piper nigrum L. Journal of Essential Oil Research, v.5, p.247-253, 1993.
LOURINHO, M. P.; COSTA, C. A.S.; SOUZA, L. C.; SOUZA, L. C.; NETO, C. F. O. Conjntura da pimenta-do-reino no mercado nacional e na região norte do Brasil. Enciclopédia Biosfera, Centro Cientifico Conhecer- Goiânia, v. 10, p 1017-1031, 2014.
MORCILLO, R. J. L.; OCAMPO, J. A.; GARRIDO, J. M. G. Plant 9-lox oxylipin metabolism in response to arbuscular mycorrhiza. Plant Signaling & Behavior, v. 17, p. 1584–1588, 2012.
NIST (National Institute of Standards and Technology). Mass Spectral Library. The NIST Mass Spectrometry Data Center, Gaithersburg, 2011.
RAVINDRAN, P. N.; KALLUPURACKAL, J. A. Black pepper. In Handbook of Herbs and Spices. In: PETER, P.K. (Ed.). New York: CRC Press, Taylor & Francis Group. p. 62-110, 2004.
SASIDHARAM, I.; MENON, A. N. Comparative chemical composition and antimicrobial activity of berry and leaf essential oils of Piper nigrum L. International Journal of biological and medical research, v. 1, p. 215-218, 2010.
SINGH, G.; MARIBUTHU, P.; CATALAN, C.; DE LAMPASONA, M. P. Chemical, antioxidant and antifungal activies of volatile oil of black pepper and its acetone extract. Journal of the Science of Food and Agriculture, v. 84, p. 1878-1884, 2004.
VIEIRA, A.A.; OLIVEIRA, M.G.A.; JOSÉ, I.C.; PIOVESAN, N.D.; REZENDE, S.T.; MOREIRA, M.A.; BARROS, E.G. Biochemical evaluation of lipoxygenase pathway of soybean plants submitted to wounding. Revista Brasileira Fisiologia Vegetal, v.13, p.5-12, 2001
ZACHARIAH, T.J.; PARTHASARATHY V. A. Black Papper. In: PARTHASARATHY V. A.; CHENPAKAM, B.; ZACHARIAH, T. J. (Ed). Chemistry of Spices. India: CAB international. p. 21-40, 2008.











