ISBN 978-85-85905-19-4
Área
Química Verde
Autores
da Paz, J.A. (UFPE) ; Sales, A. (IFPE) ; Navarro, M. (UFPE) ; Vilar, M. (IFPE)
Resumo
A influência do Ultrasom (US) na hidrogenação eletrocatalítica da Pulegona estudada. A Pulegona é uma cetona α,β-insaturada, com baixa solubilidade em água e que ocorre naturalmente nos óleos essenciais de plantas como Mentha piperita e poejo. Os procedimentos foram realizados em um aparelho Autolab PGSTAT101 utilizando célula eletroquímica de compartimento único de 30 mL de capacidade e eletrodos de Ni.Observou- se que a aplicação de US aumentou em 34,8% os rendimentos reacionais quando comparada a eletrólise na ausência de US, enquanto que ao se duplicar a intensidade de US, os rendimentos aumentaram 103%. Neste sentido, por se tratar de uma metodologia sintética verde e versátil o uso sinergético de US e HEC torna- se uma excelente opção na área de eletrocatalise.
Palavras chaves
Ultrasom; hidrogenação; quimica verde
Introdução
A geração eletroquímica de hidrogênio “in situ” é um processo atraente na hidrogenação catalítica, que dispensa a necessidade de suprimento de gás hidrogênio, pois o mesmo já é produzido sob forma ativa eliminando-se problemas de envenenamento do catalisador (AUGUSTIN, 1965). A Hidrogenação eletrocatalítica (HEC) é conhecida desde o início do século passado, quando foi sugerido que reduções eletroquímicas, realizadas em cátodos de metais de transição, deveriam envolver reações entre substratos insaturados e átomos de hidrogênio adsorvidos na superfície do eletrodo, após serem gerados pela descarga eletrônica de prótons. O sucesso da técnica está relacionado à conjugação de dois mecanismos: geração eletroquímica de hidrogênio seguida da hidrogenação propriamente dita (NAVARRO et al, 2008; NAVARRO et al, 2003; NAVARRO et al, 2004). Na primeira etapa ocorre a eletrorredução da água (ou íons hidrônio) gerando hidrogênio radical que permanece adsorvido na superfície do eletrodo (reação de Volmer). A geração de hidrogênio é observada na superfície catódica sob forma de bolhas que podem ser geradas pela combinação de dois átomos de hidrogênio adsorvidos na superfície metálica (reação de Tafel) antes de reagir com a molécula orgânica também adsorvida, ou através da associação de um próton e um átomo de H (desorção eletroquímica – etapa de Heyrovsky)(NAVARRO e VILAR, 2012). Substratos como olefinas, aldeídos aromáticos e cetonas α,β insaturadas têm sido hidrogenados sob diversas condições eletrocatalíticas (MOUTET e COCHE, 1987; MÉNARD et al, 2003). No entanto, com o aumento da hidrofobicidade dos substratos, os rendimentos reacionais tendem a diminuir, pois há uma limitação no transporte de massa entre as fases. Uma técnica alternativa e eficiente para contornar a problemática da limitação de transporte de massa até a interface eletrodo- solução é a aplicação de ultrassom (US). A aplicação de irradiação por US é uma das mais promissoras ferramentas na área de catálise heterogênea. Este processo é denominado cavitação, onde em um meio líquido, promove um efeito de ativação em reações químicas. Durante a etapa de compressão a pressão é positiva, enquanto que a expansão resulta em “vácuo”, chamado de pressão negativa, constituindo-se em um ciclo de compressão-expansão que gera as cavidades. A cavitação de bolhas próximas à superfície do catalisador é um processo assimétrico e produz um jato de alta pressão causando danos à sua superfície levando a um aumento do número de arestas, fendas e defeitos expondo pontos altamente ativos da superfície que outrora eram indisponíveis. Além destes efeitos o tratamento por US é capaz de alterar a morfologia do catalisador, o tamanho de partículas e, conforme mencionado anteriormente, melhorar a transferência de massa das espécies eletroativas em processos eletroquímicos. O método tem sido aplicado com eficiência em processos de polimerização (KRUUS et al, 1979), sonoeletrossíntese (ATOBE et al., 1999), hidrogenação sonoquímica (ZHANG et al, 2007), etc. Entretanto, na área de eletrocatálise, o número de artigos que relatam o uso de US em reações de HEC é limitado. Neste sentido, o presente trabalho tem por objetivo avaliar o efeito da aplicação de US na reação de HEC da (+)- Pulegona em água. A Pulegona é uma cetona α,β-insaturada exocíclica, com baixa solubilidade em água e que ocorre naturalmente nos óleos essenciais de uma variedade de plantas, como Nepeta cataria, Mentha piperita e poejo. O presente trabalho é relevante do ponto de vista eletrocatalítico e verde, pois atende aos princípios 2, 3, 5, 6 e 9 da química verde (HANEFELD, 2007) e não há registro de trabalhos semelhantes descritos na literatura.
Material e métodos
A Pulegona (96%) foi adquirida pela Aldrich e o NH4Cl através da FLUKA e foram usados conforme recebidos. A água utilizada foi MilliQ®. Microscopias eletrônicas de varredura (MEV) foram utilizadas para análises morfologicas das partículas de níquel eletrodepositadas sobre a matriz catódica sendo realizadas em um instrumento Quanta 200 FEG no Laboratório de Microscopia Eletrônica e Microanálise do Centro de Tecnologias Estratégicas do Nordeste do Brasil. Os procedimentos de HEC foram realizados em um aparelho Autolab PGSTAT101 potenciostato/galvanostato acoplado a um computador através de interface externa USB, utilizando célula eletroquímica de compartimento único de 30 mL de capacidade contendo três entradas, sendo uma para o ânodo de sacrificio de Ni (0,1 dm de diâmetro; 0,078 dm2 área), outra para o cátodo de Ni (0,1 dm de diâmetro e 0,078 dm2 de área)] e uma terceira para "probe" de US. A fim de avaliar a influência do USC no sistema eletrocatalítico, utilizaram-se potencias de 20W, 40W e 100W. Os experimentos com US foram realizados em equipamento Bandelin Sonopuls utrasonic homogeneizer HD 2200. Para inicio do experimentos a célula eletrolítica foi preenchida com 25,0 mL de eletrólito de suporte (NH4Cl; 0,2 molL-1). A eletrólise foi realizada com aplicação de densidades de corrente de 350 mA dm-2. Os experimentos tomaram por base a passagem de 1 F mol-1. Ao término da reação a solução aquosa foi extraída com éter dietílico (3x20 mL). Os rendimentos foram determinados através da análise por cromatrografia gasosa (CG), utilizando um equipamento Thermo Focus Finnigan equipado com coluna de 30m de 0,25 milímetros OV-5, usando uma escala de 60- 200oC de temperatura (10 oC min-1). Comparações com amostras autênticas foram realizadas com o intuito de identificar os produtos de hidrogenação e os reagentes, os quais foram confirmados por espectrometria de massa.
Resultado e discussão
Quando o US é aplicado a um sistema eletroquímico, parâmetros como a freqüência
(Hz), a intensidade (W), o poder ultrasônico (W cm-2), o tipo de
solvente e a temperatura devem ser considerados. Diante dos trabalhos
publicados na literatura a respeito da introdução do poder do US em uma célula
eletroquímica, as duas maiores fontes de liberação do US encontradas foram os
banhos ultra-sônicos e as sondas de imersão em forma de ponta, popularmente
conhecidos como “probes”. O banho ultra-sônico consiste de um número de
transdutores de freqüência fixa (20-100 KHz) e tem a capacidade de limpar as
superfícies e de ajudar a dissolução de substâncias. A ponteira ultra-sônica
apresenta uma série de vantagens em relação ao banho ultra-sônico. Entre as
principais destaca-se a capacidade dos “probes” em suportar altas intensidades
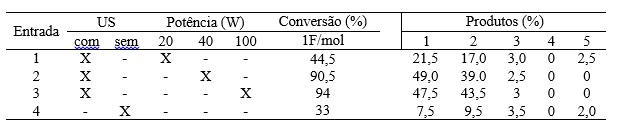
de US (10-1000 Wcm-2). Neste contexto, a Pulegona foi
sonoeletrocataliticamente hidrogenada após o consumo de 1Fmol-1,
gerando como como produtos: Mentona (1), Isomentona (2), neoisomentol (3),
Mentol (4) e neomentol (5) (Tabela 1, entradas 1-3). Observa-se que a aplicação
de US proporcionou o aumento de 34,8% nos rendimentos reacionais (Tabela 1,
entrada 1), quando comparada a eletrólise na ausência de US (Tabela 1, entrada
4).A intensidade da sonicação é proporcional ao quadrado da amplitude das
vibrações liberadas pelo dispositivo ultrasônico e, portanto, um aumento na
amplitude de vibração levará a um aumento na intensidade de vibração e a uma
elevação nos efeitos sonoquimicos citados anteriormente. Corroborando este
raciocínio, observa-se que ao se duplicar a intensidade de US, os rendimentos
reacionais aumentam 103% (Tabela 1, entrada 2). Todavia, a utilização de
intensidade mais elevada (Tabela 1, entrada 3), eleva em apenas 3,8% os
rendimentos reacionais se comparado com a aplicação de 40W de potência (Tabela
1, entrada 2). De fato, como regra geral, o aumento da intensidade aumenta o
efeito sonoquímico, porém, a energia ultrasonica que um sistema pode absorver é
limitada. Deste modo, a cavitação de bolhas, que são inicialmente difíceis de
criar em frequências mais elevadas como um resultado da menor duração dos
ciclos de rarefação decorrentes do processo de cavitação, é agora possível. No
entanto, a intensidade de sonicação não pode ser aumentada indefinidamente pois
o tamanho da bolha é também dependente da amplitude de pressão em seu interior.
Em síntese, quando um grande conteúdo de energia é imposto ao sistema, a
solução produz um grande número de bolhas de cavitação que, em sua maioria, se
aglutinam e geram bolhas cada vez maiores e com “tempo de vida” mais duradouro.
Nestes casos, o efeito causado pelas bolhas pode bloquear/impedir o transporte
de energia acústica através do líquido, o que justifica a observação
supracitada. Todavia, não se pode justificar o aumento dos rendimentos
reacionais ao fato único e exclusivo do aumento no transporte de massa da
Pulegona até a superfície do eletrodo. A temperatura da solução é um fator que
deve ser levado em conta emsistemas eletroquímicos e de US, pois tem sinergia e
influência direta com o fenômeno de transporte de massa na interface eletrodo-
solução. A utilização de “probes” ultrasônicos reconhecidamente elevam a
temperatura da solução. Do ponto de vista de reações de HEC, a temperatura é um
fator que influencia a taxa de conversão, a seletividade, a eficiência
eletroquímica e a vida útil do catalisador. Quanto mais alta a intensidade de
US empregada, mais rapidamente a temperatura aumenta. Neste sentido, a
viscosidade da solução tende, como regra geral, a diminuir, propiciando uma
maior difusão da especíe eletroativa até a superfície do catalisador. Neste
sentido, o aumento da intensidade de US no presente trabalho, eleva a
temperatura da solução de 26oC (temperatura inicial de reação) para
50oC, 53oC e 61oC (Tabela 1, entradas 1-3,
respectivamente). A influência do solvente em processos eletroquímicos e
ultrasônicos é por vezes subestimada e sua eficácia muitas vezes negligenciada.
A natureza do solvente, por exemplo, afeta fortemente a taxa de conversão de
reações de HEC, uma vez que parâmetros como de constante dielétrica, adsorção
e a solubilidade do substrato são diretamente influenciados pelo solvente.
Como regra geral, a maioria das aplicações que envolvem US são realizadas em
água. A irradiação por US causa a formação de radicais livres e varias outras
espécies em solução. No caso específico da água, a sonicação gera a formação de
radicais H⋅ e OH⋅. Como se sabe, a catálise é um fenômeno de superfície, neste
sentido, conforme anteriormente mencionado, a primeira etapa do processo de HEC
é a eletrorredução da água gerando hidrogênio radicalar que permanece adsorvido
na superfície do eletrodo (reação de Volmer). Desta forma, é razoável afirmar
que a combinação de radicais hidrogênios, gerados eletroquimicamente e pelo
processo de US, acentuam e aumentam a concentração desta espécie na superfície
do eletrodo e, sinergicamente aos fatores anteriormente discutidos, eleva as
taxas de conversão observadas na Tabela 1 (entradas 1-3). Por fim, sabe-se que
o uso de US em sistemas heterogêneos altera a morfologia e as propriedades
superficiais do eletrodo. Uma das principais consequências associadas ao uso de
US em processos de eletrodeposição é a redução do tamanho das partículas. Esse
comportamento pode ser mais bem entendido a partir do estudo da morfologia do
depósito de níquel no que diz respeito à sua forma, espaçamento, homogeneidade
e tamanho de partículas. A MEV dos depósitos de níquel sobre a matriz catódica
de Níquel (Figua 1) revelou que a irradiação acústica durante o processo de HEC
parece suavizar a morfologia das partículas, tornando a distribuição das
partículas mais regular e com dimensões nanométricas. Esta característica torna
a matriz catódica mais ativas, o que potencializa a reatividade da superfície e
aumenta a eficiência no processo de hidrogenação.
Resultados da HEC da Pulegona assistida por US.

MEV dos depósitos de níquel após tratamento com US
Conclusões
A utilização de uma célula de compartimento único permite um novo campo de aplicação do método em reações de síntese orgânica. Além disso, o ânodo de sacrifício de níquel permite a estimativa direta dos efeitos das matrizes catódicas sobre o depósito de níquel. Os resultados demostraram que que a aplicação de US proporcionou o aumento de 34,8% nos rendimentos reacionais quando comparada a eletrólise na ausência de US. Ademais, ao se duplicar a intensidade de US, os rendimentos reacionais aumentam 103. Todavia, este efeito é menos pronunciado quando de eleva a intensidade do US, no qual se eleva em apenas 3,8% os rendimentos reacionais quando comparado com a aplicação de 40W de potência. Paralelamente a estas observações, verificou-se que o aumento da intensidade de US leva a um aumento da temperatura da da solução. A MEV dos depósitos de níquel sobre a matriz catódica de Níquel revelou que a irradiação acústica durante o processo de HEC parece suavizar a morfologia das partículas, tornando a distribuição das partículas mais regular e com dimensões nanométricas. Por fim, o 2º princípio da química verde destaca o conceito de economia de átomos ou eficiência atômica. Sabe-se que sínteses que envolvem reações com boa economia de átomos (adição, rearranjos, catálise e biocatálise) são chamadas de síntese verde. Neste sentido, e de acordo com o princípio 9, reações catalíticas são superiores às reações estequiométricas. Portanto, levando em conta que a metodologia proposta neste trabalho (i) não usa solventes orgânicos (princípio 5), (ii) que as reações foram conduzidas a temperatura e pressões ambientes (princípio 6) e (iii) que os produtos gerados possuem pouca ou nenhuma toxicidade à saúde humana e ao ambiente (princípio 3), torna-se emergente e factível a combinação poderosa entre técnicas de US e HEC para fins de modificação eletroquímica de compostos orgânicos em água.
Agradecimentos
Ao CNPq pelo apoio financeiro, a Central Analítica da UFPE e ao laboratório de eletroquímica e Cromatografia do IFPE.
Referências
1.AUGUSTIN L.R., Catalytic Hydrogenation: Techniques and Applications in Organic Synthesis, Dekker, New York, 1965, pp. 11–15.
2.ATOBE, M., TONOI, T., NONAKA, T.. Electrochem. Commun., 1999, 1, 593-596.
3. COCHE, L.; MOUTET, J. C.; J. Am. Chem. Soc. 109, 1987, 6887
4. DONALDSON D.J., FARRINGTON M.D., KRUUS P.. J. Phys. Chem., 1979, 83, 3130-3135.
5. DUBÉ, P.; KERDOUSS, F.; LAPLANTE, F.; PROULX, P.; BROSSARD, L. ; MÉNARD, H. J. Apll. Elect.. 33, 2003, 541.
6.HUANG, W., LI, H., ZHU, B., FENG, Y., WANG, S., ZHANG, S. Ultrason. Sonochem., 2007, 14, 67-74.
7.LIMA M.V.F., MENEZES F.D., NETO B.B, NAVARRO M., J. Electroanal. Chem. 2008; 613:58-66
8. MASON T.J., Chem. Soc. Rev. 1997, 26, 443-451.
9. MASON, T.J., BERNAL V.S., in: Pollet B.G., Power ultrasound in Electrochemistry – From versatile laboratory tool to engineering solution., John Wiley & Sons, Ltd, 2012, pp. 28–29.
10. MASON T.J., Advances in sonochemistry, v. 4, 1996, pp. 206-212
11. SANTANA D.S., LIMA M.V.F, DANIEL J.R.R., NAVARRO M., Tetrahedron Lett., 2003; 44:4725-4727.
12. SANTANA D.S., MELO G.O., LIMA M.V.F., DANIEL J.R.R., AREIAS M.C.C., NAVARRO M., J. Electroanal. Chem. 2004; 569:71-78.
13. SCHÜTH, F., SHELDON, R.A., ARENDS I., HANEFELD U., Green Chemistry and Catalysis. 2007 Wiley-VCH Verlag GmbH & Co. KGaA, pp.
14. SUSLICK, K.S., CASADONE, D.J., GREEN, M.L.H., THOMPSON M.E., Ultrasonics, 1987, 25, 56-59.
15. VILAR M., NAVARRO M. Electrochim. Acta 2012; 59:270-278











