ISBN 978-85-85905-19-4
Área
Química Tecnológica
Autores
Morais, T. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ) ; Neto Santos, O. (UNIVERSIDADE FEDERAL DO SUL E SUDESTE DO PARÁ) ; Corrêa, A. (UNIVERSIDADE FEDERAL DO PARÁ) ; Lamarão, C. (UNIVERSIDADE FEDERAL DO PARÁ) ; Moraes, D. (UNIVERSIDADE FEDERAL DO PARÁ)
Resumo
O objetivo deste trabalho é obter cobre a partir da eletrólise de soluções produzidas pela lixiviação ácida do minério oxidado oriundo da Província Mineral de Carajás-PA. Os agentes lixiviantes foram o HCl, H2SO4 e o HNO3 (0,5, 1,0 e 5,0 M) utilizados a temperatura ambiente. A eletrodeposição a partir dos licores obtidos foi realizada com uma corrente de 0,1A por 20min. As caracterizações necessárias foram realizadas por DRX, FRX e MEV/EDS. O processo eletrolítico utilizando o HCl 0,5 M como agente lixiviante foi o que mostrou o melhor rendimento.
Palavras chaves
cobre; minério oxidado; eletrodeposição
Introdução
O uso do cobre é diversificado nas áreas tecnológicas e industriais, aumentando a busca por seus minérios e otimização de processos de exploração e beneficiamento do insumo (MUSTAFA, et al., 2004.). Com a constante exploração dos depósitos minerais, estima-se o esgotamento das suas reservas a médio prazo. Assim, empresas do setor mineral na região de Carajás-PA., vêm estocando toneladas do minério secundário do metal, de forma que no futuro venham a substituir a fonte primária existente e garantir a demanda do metal no mercado. Pesquisas apontam a extração hidrometalúrgica a partir do minério oxidado, como o ramo que as indústrias desenvolvem processos economicamente viáveis e ambientalmente menos agressivos a serem adotados (HABBASCHE, et al., 2009). No processo, um agente lixiviante, em geral um ácido mineral ou orgânico, extrai o cobre do minério colocando-o em solução; a recuperação final ocorre geralmente por cimentação, troca iônica- eletrodeposição ou em circuito de extração solvente-eletrodeposição (HABBASCHE, et al., 2009; HAGHIGHI, et al., 2013). O objetivo deste trabalho é obter o cobre a partir da eletrólise de soluções produzidas pela lixiviação ácida do minério oxidado e utilização de técnicas que proporcionem uma melhor e mais eficiente caracterização do material eletrodepositado.
Material e métodos
O processo de lixiviação foi conduzido em erlenmayer (100 mL) pela agitação (± 200 rpm) de 6 g de amostras de um concentrado de minério oxidado (cedido pela mineradora VALE) em 30 mL de ácido (HCl, H2SO4 e HNO3; concentrações 0,5; 1 e 5 M) por 15 min a temperatura ambiente. As suspensões obtidas foram filtradas sob pressão reduzida e os filtrados (licores) encaminhados ao processo de eletrodeposição; o resíduo foi pesado em balança analítica (Marca Sartorius mod. BP 2215, ± 0,001 g) para fins de determinação de percentual de massa extraída. Na eletrólise, 30 mL dos licores foram colocados em um béquer (50 mL), que compõe a célula eletrolítica (Figura 1). Ao sistema foi aplicado uma corrente de 0,1 A (± 0,01) gerada por uma fonte (marca Cidepe mod. EQ030), por 20 min. Decorrido esse período, os eletrodos foram lavados com água deionizada, secos a 110° C por 45 min, pesados e guardados em dessecador. A identificação mineralógica foi conduzida por difração de raios-X, DRX (método do pó), em difratômetro modelo X’Pert PRO MPD da PANalytical (radiação de Cu, 2teta de 0 a 75°). A composição química mineral foi determinada por fluorescência de raios-X, FRX, (método das pastilhas prensadas; 3g de amostra/0,9g de parafina) em espectrômetro modelo Axios-Minerals da PANalytical. A caracterização morfológica do eletrodepositado foi realizada por microscopia eletrônica de varredura, MEV, em microscópio Zeiss modelo LEO 1430; a composição química do eletrodepositado foi investigada por análise de energia dispersiva, EDS, em imagens de elétrons secundários (20 kV e corrente de 90 μA).
Resultado e discussão
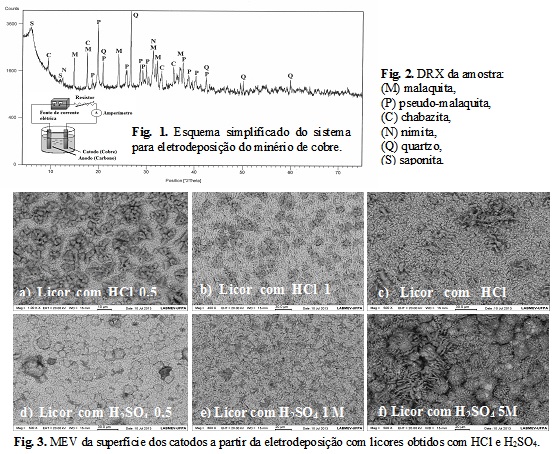
O difratograma de raios-X do minério investigado (Fig. 2) mostra reflexões
características de malaquita [Cu2(OH)2CO3] e pseudo-malaquita
[Cu5(PO4)2(OH)4] como os principais minerais de cobre; também foi observado
reflexões características dos minerais chabazita, nimita e quartzo, além do
argilomineral saponita. A composição química da amostra de minério de cobre
oxidado está apresentada na tabela 1 e corrobora a observação dos minerais
encontrados. A presença de titânio pode estar relacionada a algum mineral
acessório desse elemento tal como rutilo, anatásio ou ilmenita, não
detectado pela DRX. O percentual de material lixiviado está apresentado na
tabela 2; a maior taxa lixiviada foi obtida com H2SO4 5M, o que ocorreu
juntamente com uma liberação gasosa, oriunda do ataque ácido aos minerais de
cobre. A tabela 3 mostra os valores em massa de material eletrodepositado no
catodo; o licor produzido com HCl 0,5 M apesar de apresentar a menor
eficiência lixiviante foi o que gerou maior massa de material
eletrodepositado. O baixo rendimento eletrolítico com os licores obtidos com
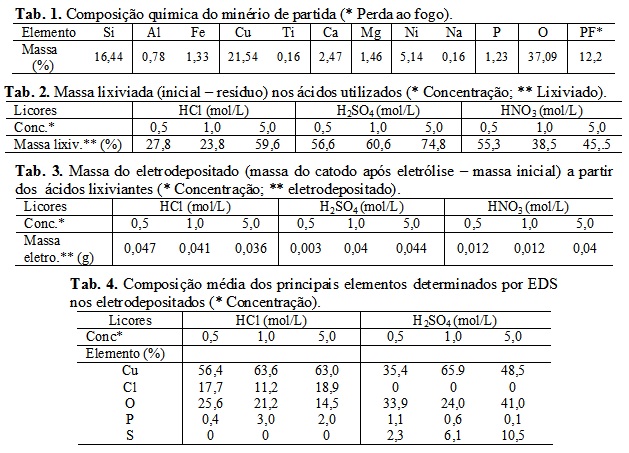
o HNO3 sugere o não aprofundamento dos estudos com esse ácido. Imagens de
MEV (Figura 3) da superfície dos catodos, mostram aglomerados de cristais
com diferente morfologia a partir dos licores obtidos com HCl e H2SO4; a
proporção depositada desse aglomerados acompanha os resultados apresentados
na tabela 3. Análises de EDS desses cristais (Tabela 4) revelam sua não
homogeneidade com relação ao cobre; outros elementos também foram
observados, o que provavelmente pode estar associado a uma dupla camada
estabelecida (BRETT e BRETT, 1996).
Conclusões
Após a execução do estudo concluiu-se: 1. O HCl foi o ácido que mostrou o melhor rendimento no processo eletrolítico, principalmente, na menor concentração empregada. 2. A composição química do eletrodepositado revelou o cobre como elemento majoritário, os outros elementos associados demonstram a necessidade de um beneficiamento secundário. 3. A MEV/EDS pode ser considerada como uma ferramenta útil no monitoramento do processo eletroquímico 4. A pesquisa sugere o controle de outros fatores como pH e corrente elétrica no processo eletroquímico a fim de obter um maior rendimento em cobre.
Agradecimentos
A PROPESP/UFPA e a FADESP pelo financiamento; a Vale S/A pela amostra mineral; aos laboratórios LaPAC e LCO do ICEN e aos laboratórios de Microanálises e Difração de
Referências
BRETT, A. M. O.; BRETT, C. M. A. 1996. Eletroquímica: Princípios, métodos e aplicações. Coimbra, Portugal: Ed. Almedina.
HABBASCHE, N.; ALANE, N.; TIFOUTI, L. Leaching of copper oxide with different acid solutions. Chemical Engineering Journal, n° 152, 503-508, 2009.
HAGHIGHI, H. K.; MORADKHANI, D.; SEDAGHAT, B.; NAJAFABADI, M. R.; BEHNAMFARD, A. Production of copper cathode from oxidized copper ores by acidic leaching and two-step precipitation followed by electrowinning. Hidrometallurgy, n° 133, 111-117, 2013.
Mineradora Vale S.A. Divisão Não Ferrosos Norte, Canaã dos Carajás-PA.
MUSTAFA, S.; HAMID, A.; NAEEM, A. Temperature effect on xanthate sorption by chalcopyrite. Colloid and Interface Science, n° 275, 368-375, 2004.











