Síntese de polifenóis pirrolidínico-naftoquinônicos derivados da 2-hidróxi-1,4-naftoquinona (lausona) obtidos a partir das reações de Mannich multicomponente e adição conjugada
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Allochio Filho, J.F. (UFES) ; Klein Antoniazi, M. (UFES) ; Pirola Madeira, K. (UFES) ; B. A. Rangel, L. (UFES) ; Greco, S.J. (UFES)
Resumo
Os polifenóis representam uma classe de fitoterápicos capazes de atuar em diferentes estágios do desenvolvimento do câncer, tais como: iniciação, promoção e progressão da doença. Aliada à vasta aplicação das naftoquinonas contra diversas doenças, principalmente como quimioterápicos, pode-se vislumbrar a sinergia entre estes dois grupos fitoquímicos. Nesse sentido, reporta-se neste trabalho a síntese de polifenóis naftoquinônicos derivados da 2-hidróxi-1,4-naftoquinona (lausona) contendo o núcleo pirrolidínico, obtidos a partir da reação de adição conjugada entre a lausona e adutos de Mannich, usando etanol como solvente, sob refluxo. Os produtos foram obtidos com rendimentos de 87-96% e tempos reacionais de 1,2-5,0 horas.
Palavras chaves
Lausona; Polifenóis; Adição conjugada
Introdução
O câncer é uma das doenças que mais causam temor na sociedade, por ter se tornado um estigma de mortalidade e dor. Existem quase duzentos tipos de câncer que correspondem aos vários sistemas de células do corpo, os quais se diferenciam pela capacidade de invadir tecidos e órgãos, vizinhos ou distantes, por mecanismos diversos a partir de mudanças metabólicas que desencadeiam processos carcinogênicos como angiogênese e metástase, por exemplo. O desenvolvimento de resistência a fármacos (Multiple Drug Resistance - MDR) e a baixa seletividade de compostos antineoplásicos em atingir alvos metabólicos da carcinogênese representa um enorme desafio no tratamento quimioterápico do câncer. Portanto, apesar do grande número de compostos que compõem o arsenal quimioterápico de combate ao câncer, o problema de resistência e de especificidade terapêutica requer a busca constante por novas drogas seletivas eficazes no combate a essa doença que afeta milhões de pessoas ao redor do mundo. Culturalmente, a natureza é a principal fonte de obtenção de variados compostos bioativos aplicados no tratamento de diversas enfermidades humanas, dentre os quais se destacam os alcalóides, terpenos e polifenóis. [1-3] Conhecidamente, os polifenóis se enquadram na classe de compostos fitoquímicos denominados antioxidantes - substâncias as quais defendem o organismo de processos oxidativos danosos ao metabolismo de proteínas, lipídios e DNA, por exemplo, desencadeando um mau funcionamento do organismo e desencadeando enfermidades diversas. Não bastando a milenarmente conhecida e difundida ação antienvelhecimento dos polifenóis, estes compostos vêm sendo estudados profundamente ao longo dos anos devido ao seu vasto potencial farmacológico, que inclui a prevenção e o tratamento de diversas doenças que afligem a sociedade, por exemplo: osteoporose, infecções microbianas, processos inflamatórios, doenças cardiovasculares, diabetes, doenças neurodegenerativas e câncer, principalmente.[4] Dentre as principais propriedades farmacológicas dos polifenóis, indiscutivelmente aquela atribuída ao câncer, por intermédio da quimioprevenção e/ou da quimioterapia, se destaca pelo alto índice de incidência, propagação e mortalidade associada a esta doença no Brasil e nos demais países.[5] Inúmeros dados epidemiológicos demonstram que os compostos polifenólicos podem exercer a atividade de prevenir e inibir o desenvolvimento da carcinogênese em diversos tipos de câncer humano in vitro e in vivo.[3a,6] Estudos de mecanismo de ação revelam que os polifenóis podem atuar em diferentes estágios do desenvolvimento do câncer, por exemplo: i) na iniciação, agindo como antioxidantes e antimutagênicos na inibição de processos enzimáticos e vias de sinalização, e estimulam o reparo do DNA; ii) na promoção, funcionando como anti-inflamatórios da célula, induzindo apoptose e inibindo a proliferação celular; e iii) na progressão, regulando o funcionamento de proteínas, e prevenindo a angiogênese e a metástase.[7] Outro núcleo com alto valor farmacológico é a quinona e seus derivados, pois possuem uma vasta e conhecida gama de atividades biológicas desde antibacterianas, antifúngicas, antiprotozoárias, moluscicidas, anti- inflamatórias, anti-HIV-1 e, principalmente, antitumorais.[8] Dentre as Quinonas, destacam-se aquelas contendo o núcleo naftaleno (1,2- e 1,4- naftoquinona), principalmente a 2-hidróxi-1,4-naftoquinona, mais conhecida como lausona. Diversos estudos farmacológicos demonstram que as naftoquinonas e seus derivados possuem diversas atividades anticâncer, dentre as quais: se ligar covalentemente e intercalar ao DNA (intercaladores de DNA); inibir a replicação do DNA e a transcrição do RNA (inibição de DNA-polimersases); agir como venenos de topoisomerases; modular e/ou inibir vias de sinalização de proteínas quinases (RTK, PKC, CDK, JNK); e induzir a quebra de DNA e modificações cromossomais.[9] Uma propriedade metabólica relevante das naftoquinonas é a sua capacidade de induzir o estresse oxidativo através da formação intracelular de espécies reativas do oxigênio (ROS), por exemplo: peróxido de hidrogênio (H2O2), ânion-radical superóxido (O2‒•) e radical hidroxila (HO•), espécies estas que podem danificar certos componentes celulares importantes (proteínas, enzimas, DNA) tanto de células normais como de citotóxicas.[9a,10] Nessa abordagem, a sinergia entre diferentes grupos farmacofóricos acoplados em uma única molécula representa uma estratégia sintética indubitável na obtenção de compostos que possam atuar por diferentes mecanismos de ação contra o câncer. Dessa maneira, com base nos conhecimentos bioquímicos e na vasta aplicação dos polifenóis contra diversas doenças, principalmente como agentes anticâncer, nos permite vislumbrar uma sinergia entre este grupo e o da naftoquinona na síntese e obtenção de novas substâncias como potenciais fármacos quimioterápicos para o câncer.
Material e métodos
Os polifenóis naftoquinônicos contendo o núcleo pirrolidínico foram obtidos utilizando adutos de Mannich como intermediários, os quais foram obtidos a partir da reação de Mannich multicomponente na lausona, utilizando a pirrolidina e variados aldeídos (benzaldeído, salicilaldeído, anisaldeído, p-nitrobenzaldeído e 1-naftaldeído), em meio catalítico contendo 20 mol% de ácido p-toluenossulfônico (p-TsOH) e acetonitrila CH3CN como solvente, temperatura ambiente e ao abrigo da luz. Vale destacar que esta metodologia foi desenvolvida e aplicada amplamente na obtenção de adutos de Mannich em nosso laboratório, cujo resultado já foi publicado por nosso grupo de pesquisa recentemente.[11] Posteriormente, os adutos de Mannich foram reagidos estequiometricamente com a lausona em etanol, sob refluxo, mediante adição conjugada, para a obtenção dos polifenóis naftoquinônicos desejados. Os produtos obtidos foram purificados mediante recristalização ou lavagem com etanol a quente. As análises de cromatografia em camada fina foram realizadas utilizando cromatofolhas de alumínio recobertas com sílica gel UV254 (250 µm, 20x20 cm). As amostras foram diluídas em diclorometano e sua revelação foi efetuada por exposição à luz ultravioleta (250 e 300 nm). As análises de espectroscopia de infravermelho foram realizadas utilizando o espectrômetro Perkin Elmer Spectrum 400. Todas as análises foram feitas utilizando o modo de Reflectância Total Atenuada (Attenuated total reflection - ATR) com cristal horizontal de seleneto de zinco (ZnSe), média de 16 scans e resolução de 4 cm-1. A janela espectral a ser utilizada é de 4000 a 650 cm-1, região compreendida pelo infravermelho médio (Mid-infrared spectroscopy - MIR). As análises de espectroscopia de ressonância magnética nuclear de 1H e de 13C foram realizadas utilizando o espectrômetro Varian 400MHz e sonda de 5 mm Broadband 1H/X/D. Os deslocamentos químicos (δ) estão relatados em ppm em relação a um padrão interno. Foram utilizados o DMSO-d6 e o CDCl3 como solventes e o TMS como padrão interno.
Resultado e discussão
Estudos prévios realizados em nosso laboratório de pesquisa, já publicados
na literatura, mostrou a formação de produtos polifenólicos contendo o
núcleo naftoquinônico originados da adição conjugada em alguns adutos de
Mannich derivados da lausona a partir de condições reacionais de Mannich
catalisada em meio aquoso.[12] A partir desta constatação, vislumbrou-se
estudar uma metodologia sintética para a obtenção desses polifenóis
naftoquinônicos a partir de diferentes adutos de Mannich utilizados como
intermediários e, ainda, posteriormente, avaliar a atividade anticâncer
destes compostos, devido a presença de dois importantes grupos
farmacofóricos, como relatado anteriormente neste trabalho.
Nesse sentido, o estudo iniciou-se com a síntese dos adutos de Mannich
derivados da lausona contendo o núcleo pirrolidínico - intermediários na
obtenção dos polifenóis naftoquinônicos -, os quais foram obtidos mediante
metodologia desenvolvida e reportada na literatura pelo nosso grupo de
pesquisa, que consiste na reação de Mannich multicomponente na lausona,
empregando catalisador ácido p-toluenossulfônico (p-TsOH) e acetonitrila
(CH3CN) como solvente, sob agitação constante, temperatura ambiente e ao
abrigo da luz (Figura 1).[11]
Posteriormente, estudos de variação de temperatura na obtenção dos
polifenóis naftoquinônicos derivados dos respectivos adutos de Mannich foram
realizados. Para tal, utilizou-se como modelo a reação entre o aduto de
Mannich A2 derivado do salicilaldeído, obtido com 99% de rendimento em 1,6 h
e a lausona, em quantidades equimolares e etanol como solvente.
Dessa maneira, primeiramente, uma suspensão do respectivo aduto de Mannich e
da lausona em etanol foi agitada constantemente à temperatura ambiente e ao
abrigo da luz. Verificou-se que a reação se processa em suspensão e
lentamente nessa condição experimental, resultando em um longo tempo
reacional (3 dias). Em seguida, realizou-se o experimento em condições de
refluxo, reagindo novamente uma suspensão do respectivo aduto de Mannich e
da lausona em etanol sob agitação constante. Verificou-se a formação do
polifenol naftoquinônico P2 desejado quase que imediatamente após o início
do refluxo, através da precipitação de um sólido amarelo no meio reacional.
A reação foi acompanhada por CCF e findou após 2,0h de reação com 87% de
rendimento. Ressalta-se ainda que o rendimento global das duas etapas
reacionais foi de 86%.
Em prosseguimento ao estudo de síntese dos demais polifenóis naftoquinônicos
contendo o núcleo pirrolidínico foram aplicadas as condições experimentais
supracitadas para os demais adutos de Mannich A1, A3-A5 descritos na Figura
1, os quais derivam dos seguintes aldeídos: benzaldeído, p-nitrobenzaldeído,
anisaldeído e 1-naftaldeído, respectivamente. Os resultados obtidos para a
formação dos polifenóis derivados dos adutos de Mannich podem ser
verificados na Figura 2.
Acerca do processo de obtenção dos compostos polifenólicos derivados da
lausona, os mecanismos reacionais propostos são mostrados na Figura 3.
Posteriormente, o potencial anticâncer dos compostos sintetizados foi
testado utilizando ensaios de citotoxidade in vitro realizados pelo método
do MTT,[13] a partir do teste de viabilidade celular frente a linhagem de
célula de câncer humano: pulmão - A549 e H460; ovário – OVCAR-3 e mama
triplo-negativo - MDA-MB231. As porcentagens de inibição média dos
compostos, em concentrações de 10-4 a 10-8M, foram avaliadas após 24 horas
de cultivo celular. Cisplatina e Doxorrubicina, nas concentrações de 10-4 a
10-8M, foram utilizadas como controle positivo e os ensaios foram realizados
em triplicata. Analisando os resultados obtidos pode-se destacar os
resultados surpreendentes do polifenol P2, pois, foi substancialmente mais
potente em cânceres altamente agressivos e de prognósticos arrasadores como,
por exemplo, os de pulmão - H460 (IC50 = 7,91x10-6M) e mama triplo-negativo
- MDA-MB231 (IC50 = 8,90x10-6M), quando comparados aos respectivos
quimioterápicos de referência para o tratamento dos cânceres supracitados, a
saber: Cisplatina e Doxorrubicina (Tabela 1).
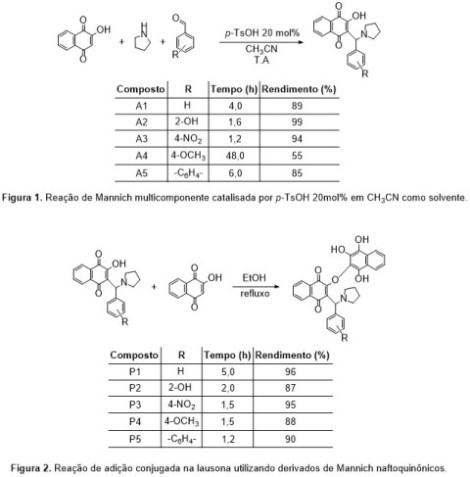
Representações das reações utilizando lausona: Mannich multicomponente catalisada por p-TsOH em CH3CN, e adição conjugada em EtOH, sob refluxo.
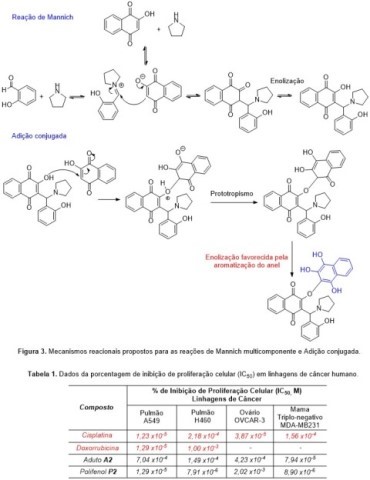
Representações da proposta mecanística para a formação dos polifenóis naftoquinônicos, e dos valores de citotoxicidade IC50 em linhagens de câncer.
Conclusões
Neste trabalho foram sintetizados cinco compostos polifenólicos pirrolidínico-naftoquinônicos P1-P5 derivados da lausona com ótimos rendimentos (87-96%) e baixos tempos reacionais (1,2-5,0h), a partir da reação de adição conjugada entre os adutos de Mannich A1-A5 e a lausona usando etanol como solvente, sob refluxo. Os adutos de Mannich A1-A5 por sua vez, foram obtidos a partir de metodologia sintética desenvolvida em nosso laboratório, já publicada na literatura, utilizando a reação de Mannich multicomponente na lausona, catalisada por p-TsOH (20 mol%) em CH3CN, com rendimentos variando de 55-99%, os quais são superiores aqueles obtidos utilizando a metodologia clássica da reação de Mannich. Os resultados referentes aos polifenóis se mostraram atrativos, com reprodução metodológica estendida a diferentes intermediários, representando uma maneira inovadora, simples e rápida de obtenção de polifenóis naftoquinônicos. Dentre os compostos sintetizados e submetidos ao teste de viabilidade celular para a avaliação do potencial anticâncer frente a linhagens de células de câncer humano de pulmão - A549 e H460; ovário – OVCAR-3 e mama triplo-negativo - MDA-MB231, o derivado polifenólico P2 mostrou os melhores resultados, principalmente frente a linhagens de câncer de pulmão - H-460 (IC50 = 7,91x10-6M) e mama triplo-negativo - MDA-MB231 (IC50 = 8,90x10-6M), apresentando valores de IC50 superiores aqueles referentes aos fármacos de controle: Cisplatina (H460, IC50 = 2,18 x10-4; MDA-MB231, IC50 = 1,56 x 10-4) e Doxorrubicina (H460, IC50 = 1,00 x10-3).
Agradecimentos
Os autores agradecem aos órgãos FAPES, CAPES e CNPq pelo apoio financeiro ao trabalho desenvolvido, e ao NCQP/DQUI/UFES pelo suporte técnico.
Referências
1.LI, A-N. et al. Resources and Biological Activities of Natural Polyphenols. Nutrients, 6, 6020-6047, 2014.
2.HO, W. E. et al. Artemisinins: Pharmacological actions beyond anti-malarial. Pharmacol. Ther., 142, 126–139, 2014.
3.DIAS, D. A.; URBAN, S.; ROESSNER, U. A Historical Overview of Natural Products in Drug Discovery. Metabolites, 2, 303-336, 2012.
4.a) PANDEY, K. B.; RIZVI, S. I. Plant polyphenols as dietary antioxidants in human health and disease. Oxidative Medicine and Cellular Longevity, 2, 270-278, 2009. b) HAN, X.; SHEN, T.; LOU, H. Dietary Polyphenols and Their Biological Significance. Int. J. Mol. Sci., 8, 950-988, 2007. c) GIOVANNINI, C.; MASELLA, R. Role of polyphenols in cell death control. Nutritional Neuroscience, 15, 134-149, 2012.
5.a) BARBOSA, I. R. et al. Cancer mortality in Brazil: Temporal Trends and Predictions for the Year 2030. Medicine, 94, 1-6, 2015. b) FERLAY, J. et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer, 136, E359–E386, 2015.
6.a) ARTS, I. C. W; HOLLMAN, P. C. H. Polyphenols and disease risk in epidemiologic studies. Am. J. Clin. Nutr., 81, 317S–25S, 2005. b) YANG, C. S. et al. Polyphenols As Inhibitors of Carcinogenesis. Environmental Health Perspectives, 105, 971-976, 1997. c) RODRÍGUEZ, M. L.; ESTRELA, J. M.; ORTEGA, A. L. Natural Polyphenols and Apoptosis Induction in Cancer Therapy. J. Carcinogene. Mutagene., S6, 2013. http://dx.doi.org/10.4172/2157-2518.S6-004. d) RAJESH, E. et al. Naturally occurring products in cancer therapy. Pharm. Bioall. Sci., 7, S181-S183, 2015.
7.DAI, J.; MUMPER, R. J. Plant Phenolics: Extraction, Analysis and Their Antioxidant and Anticancer Properties. Molecules, 15, 7313-7352, 2010.
8.BENITES, J. et al. Studies on quinones. Part 42: Synthesis of furylquinone and hydroquinones with antiproliferative activity against human tumor cell lines. Bioorg. Med. Chem., 16, 862–868, 2008.
9.a) WELLINGTON, K. W. Understanding cancer and the anticancer activities of naphthoquinones – a review. RSC Adv., 5, 20309-20338, 2015. b) LU, J-J. et al. Quinones Derived from Plant Secondary Metabolites as Anti-cancer Agents. Anti-Cancer Agents Med. Chem., 13, 456-463, 2013. c) VERMA, R. P. Anti-cancer activities of 1,4-naphthoquinones: a QSAR study. Anticancer Agents. Med. Chem., 6, 489-499, 2014. d) HUANG, Q. et al. Anti‐cancer properties of anthraquinones from rhubarb. Med. Res. Rev., 27, 609-630, 2007. e) YANG, F. et al. Doxorubicin, DNA torsion, and chromatin dynamics. Biochim. Biophys. Acta, 1845, 84–89, 2014.
10.AMARANTE-MENDES, G. P.; GREEN, D. R. The regulation of apoptotic cell death. Braz. J. Med. Biol., 32, 1053-1061, 1999.
11.FIOROT, R. G. et al. A simple and convenient method for synthesis of new aminonaphthoquinones derived from lawsone by catalytic multicomponent Mannich reaction. Tetrahedron Lett., 55, 4373–4377, 2014.
12.ALLOCHIO FILHO, J. F. et al. First synthesis of aminonaphthoquinones derived from lawsone in a colloidal dispersion system created by a Brønsted acid-surfactant-combined catalyst in water: An environmentally friendly protocol. Coll. Int. Sci. Commun., 4, 14–18, 2015.
13.DENIZOT, F; LANG, R. Rapid colorimetric assay for cell growth and survival: Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J. Immunol. Methods, 89, 271-277, 1986.
































