CÉLULA DE CAVIDADE: Desenvolvimento de uma Nova Metodologia para Síntese Emparelhada
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Galdino Pessoa, D. (UNIVERSIDADE FEDERAL DE PERNAMBUCO) ; Navarro, M. (UNIVERSIDADE FEDERAL DE PERNAMBUCO)
Resumo
Condições experimentais foram testadas para o desenvolvimento de uma célula eletroquímica de cavidade, utilizando macroeletrodos de pó de grafite. Este procedimento visou obter o produto de homoacoplamento do brometo de benzila no compartimento catódico e a bromação de olefinas no compartimento anódico, denominada síntese emparelhada sem o uso de solvente. Foram feitas eletrólises potenciométricas. No cátodo foram obtidos rendimentos que variaram 31-63% de dibenzil. Na reação anódica, ocorreu a redução de íons brometo, gerando Br2, seguida então de bromação da olefina presente no eletrodo. Obteve-se em média 80% de conversão para o produto dibromado. Com isso, a célula eletroquímica de cavidade testada permitiu a síntese eletroquímica simultânea de dibenzil e olefinas dibromadas.
Palavras chaves
Síntese emparelhada; Célula de cavidade; Eletrossíntese
Introdução
Químicos experimentais estão desenvolvendo rotas de síntese utilizando matérias-primas renováveis e seletivas, condições de síntese mais brandas, seguras, com economia energética e baixa toxicidade(CLARK, 1999). Reações eletroquímicas de redução e oxidação diretas são consideradas limpas devido ao uso de elétrons, evitando o desperdício de agentes redox gastos quimicamente. Além disso, evita-se problemas econômicos e ambientais associados ao processo de separação e isolamento do produto com o agente redox gasto(FRONTANA-URIBE et al., 2010; SCOTT, 2002). Areias e colaboradores desenvolveram uma célula de cavidade na qual foi permitida a realização da reação de acoplamento de haletos orgânicos em meio eletroquímico e na ausência de solventes. A partir desse trabalho, foram desenvolvidos outras sínteses orgânicas e inorgânicas utilizando a célula de cavidade, mostrando sua eficiência em diversas reações (DE SOUZA et al., 2010, 2013; PASSOS et al., 2016). Nos últimos anos, vem surgindo a preocupação com a formulação de metodologias que atendam à química verde com uma alta eficiência energética do sistema. Na eletrossíntese, tem sido desenvolvido um sistema que aproveita tanto a reação anódica (oxidação) quanto a catódica (redução), chamada de reação emparelhada. Com isso, o presente trabalho tem por objetivo desenvolver uma célula eletroquímica de cavidade a fim de realizar síntese emparelhada divergente, na qual as reações de oxidação e redução geram produtos diferentes. Essa nova metodologia apresenta vantagens comparadas com sínteses convencionais que são listadas como: Dupla cavidade, extinção do uso de solventes e aumentar a eficiência energética do sistema.
Material e métodos
As eletrólises potenciométricas foram realizadas numa cela de dupla cavidade desenvolvida pelo nosso grupo de pesquisa. O contato elétrico é feito através de um tarugo de grafite de diâmetro de 13 mm inserido em uma tampa de teflon formando uma cavidade de 0,3 mm de altura, à qual são adicionados 150 mg de pó de grafite, posteriormente prensado durante 10 minutos (peso de 3 Kg), e em seguida, adiciona-se 0,5 mmol de brometo de benzila, que penetra no eletrodo. O anodo é preparado da mesma forma que o catodo formando uma cavidade (h = 0,3 mm e d = 13mm). O material anódico é composto por 150 mg de pó de grafite e 1,5 mmol de KBr, misturados e prensados durante 10 minutos, em seguida, adiciona-se a olefina, que difunde dentro do material. Entre as cavidades catódica e anódica foram utilizados dois tipos de membranas: papeis de filtro em ambas cavidades ou membranas de troca iônica (no anodo catiônica e no catodo aniônica), ambas encharcadas com solução de eletrólito (KBr 0,1 mol L-1). As tampas de teflon são rosqueadas formando a cela eletroquímica. As eletrolises foram realizadas com potenciostato PGSTAT 30, submetidas a corrente constante de 10 mA passando 2,2 F mol-1. Ao final de cada experimento, as tampas são desconectadas. Ao catodo é conectado um extrator (figura 3) contendo 5 mL de clorofórmio, para retirada de todo o material. A extração do material anódico foi realizada removendo-o com uma espátula e colocando num funil de extração junto com 5mL de clorofórmio. Em seguida, as amostras passam por uma filtração simples e são levadas ao cromatógrafo gasoso.
Resultado e discussão
Inicialmente, foi realizado um teste de eletrólito, utilizando soluções
aquosa 0,1 mol L-1 de KBr e 0,1mol L-1 KOH. Na reação anódica foi utilizada
o ciclo-hexeno como substrato para bromação. Os resultados desse teste estão
apresentados na tabela 1, ensaios de 1 a 4.
Observa-se que, em média, ambos eletrólitos apresentaram a mesma resposta.
Na reação catódica também se mostraram similares, com taxa de conversão de
60-69% para a formação do dibenzil.
Diante dos resultados obtidos na otimização da célula de cavidade na síntese
emparelhada de eletrorredução do brometo de benzila no catodo e na bromação
oxidativa de olefinas no anodo, escolheu-se utilizar as condições de síntese
com o uso da solução aquosa 0,1 mol L-1 de KBr como eletrólito.
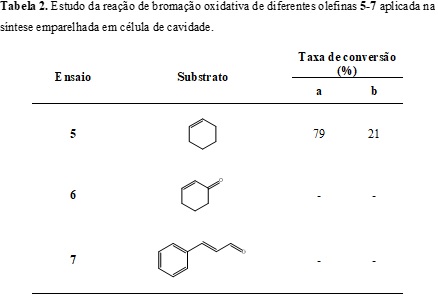
Definidas as condições de síntese emparelhada, experimentos foram realizados
variando a olefina utilizada para adição de bromo gerado eletroquimicamente
(Tabela 2).
Foi observado um bom rendimento na formação do 1,2-dibromo-ciclo-hexano
comparado às metodologias presentes na literatura que utilizam meio aquoso
(NAIR et al., 2001; SONG et al., 2015). No ensaio 6 não foram observados os
produtos de adição à dupla ligação devido à desativação da dupla ligação por
efeito de conjugação.
O produto observado no ensaio 6 foi um produto de acoplamento oxidativo de
alqueno com rendimento de 95%. No ensaio 7 não foi observado o consumo do
cinamaldeido.

Otimização da reação de oxidação.
Conclusões
Observamos que é possível aplicar a célula de cavidade em reações eletroquímicas de redução e oxidação simultâneas, alcançando produtos desejáveis que podem ser extraídos separadamente. A célula de cavidade apresenta vantagens frente às metodologias presentes na literatura, devido à ausência de solvente, além da minimização do uso de eletrólito e de anodo de sacrifício presentes em sistemas de eletrossíntese tradicionais, alta eficiência química e principalmente baixo impacto ambiental.
Agradecimentos
Os autores agradecem à FACEPE e CNPq.
Referências
CLARK, J. H. Green chemistry: challenges and opportunities. Green Chemistry, v. 1, n. 1, p. 1–8, 1999.
DE SOUZA, R. F. M. et al. Electrochemical coupling reactions of benzyl halides on a powder cathode and cavity cell. Electrochimica Acta, v. 56, n. 1, p. 575–579, 2010.
DE SOUZA, R. F. M. et al. Inversion of regioselectivity in the electrochemical prenylation of benzaldehyde on a graphite powder cathode. RSC Advances, v. 3, n. 18, p. 6526, 2013.
FRONTANA-URIBE, B. A. et al. Organic electrosynthesis: a promising green methodology in organic chemistry. Green Chemistry, v. 12, n. 12, p. 2099–2119, 2010.
NAIR, V. et al. An efficient bromination of alkenes using cerium(IV) ammonium nitrate (CAN) and potassium bromide. Tetrahedron, v. 57, n. 34, p. 7417–7422, ago. 2001.
PASSOS, S. G. B. et al. One-pot electrochemical synthesis of CdTe quantum dots in cavity cell. Electrochimica Acta, v. 190, p. 689–694, 2016.
SCOTT, K. Electrochemistry and Sustainability. In: Handbook of Green Chemistry and Technology. [s.l: s.n.]. p. 433–465.
SONG, S. et al. Efficient bromination of olefins, alkynes, and ketones with dimethyl sulfoxide and hydrobromic acid. Green Chem., v. 17, n. 6, p. 3285–3289, 2015.
































