Atividade anti-Mycobacterium tuberculosis de tiossemicarbazonas derivadas do (-)-canfeno.
ISBN 978-85-85905-21-7
Área
Química Orgânica
Autores
Vandresen, F. (UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ) ; Passos de Souza, M.R. (UNIVERSIDADE ESTADUAL DE MARINGÁ) ; Pietrowski Baldin, V. (UNIVERSIDADE ESTADUAL DE MARINGÁ) ; G. Alves-olher, V. (INSTITUTO FEDERAL DO PARANÁ) ; Bertin de Lima Scodro, R. (UNIVERSIDADE ESTADUAL DE MARINGÁ)
Resumo
Tiossemicarbazonas são substâncias de elevado interesse científico devido ao amplo espectro de atividades farmacológicas apresentadas, como antitumorais, antiparasitárias e antimicrobianas. Neste trabalho apresentamos a obtenção de 6 tiossemicarbazonas derivadas do (-)- canfeno e a avaliação da atividade anti-M. tuberculosis H37Rv. Os derivados 1, 2, 4 e 6, contendo grupos doadores de elétrons no anel aromático mostraram-se os mais ativos, com CIM entre 3,0 e 15,6 μg/mL. Com relação à seletividade dos compostos sintetizados, o derivado 4-tBu (2) mostrou-se o mais seletivo com SI=82,2, indicando ser um promissor candidato a ser utilizado na terapia antituberculose.
Palavras chaves
Tiossemicarbazonas; Tuberculose; (-)-canfeno
Introdução
Tiossemicarbazonas são substâncias de elevado interesse científico devido à facilidade de obtenção de derivados sintéticos e pelo amplo espectro de atividades farmacológicas apresentadas, destacando-se como antitumorais (Vandresen, 2014), antiparasitárias (Haragushi, 2010), antibacterianas (Beraldo, 2004), antifúngicas e antioxidantes. Apesar do grande interesse para a obtenção de tiossemicarbazonas, a maioria dos derivados descritos na literatura apresentam padrões de substituição diferenciados na posição imínica N-1 e são poucos os casos com substituição na posição N-4. Maia et al. (2010) observou que a presença de grupos volumosos ligados na posição N- 4 proporcionam uma substancial potencialização das atividades biológicas das tiossemicarbazonas principalmente por proporcionarem uma elevação do caráter hidrofóbico dos análogos. Nosso grupo de pesquisas tem focado na obtenção de derivados nitrogenados como as tiossemicarbazonas utilizando como precursores sintéticos mono-, sesqui- e diterpenos olefínicos. O protocolo sintético baseia-se na reação regio- e quimiosseletiva dos derivados terpênicos com ácido isotiociânico, levando a obtenção de isotiocianatos. Estes por sua vez são convertidos em tiossemicarbazidas a partir da reação de condensação com hidrazina. Por fim, a reação com diferentes oxo-derivados leva à formação das tiossemicarbazonas (Vandresen, 2014). Em trabalhos anteriores, obteve-se tiossemicarbazonas derivadas do R- e S- limoneno, α- bisabolol e ácido caurenoico. Nestes casos, os análogos obtidos apresentaram atividades antitumoral (Vandresen, 2014; Silva, 2010), anti-T. cruzi e antileishmania. Neste trabalho, apresentamos a síntese de tiossemicarbazonas derivadas do (-)-canfeno e a avaliação da atividade anti- M. tuberculosis.
Material e métodos
Para a síntese das tiossemicarbazonas derivadas do (-)-canfeno, utilizou-se 15mmol de tiossemicarbazida monoterpênica e quantidade equivalente de benzaldeído e derivados para-substituídos (4-terc-butil, 4-nitro, 4-hidróxi, 4-metóxi e 4-trifluormetil). A reação foi conduzida na ausência de solvente utilizando sílica-gel com 5% de ácido sulfúrico como suporte sólido. A reação foi mantida sob agitação constante por um período de 10 min. e após este tempo, adicionou-se EtOH absoluto e filtrou-se para eliminação da sílica. A reação foi acompanhada por por CCD. Os derivados foram obtidos com rendimentos entre 50 e 99%. Os derivados foram caracterizados através da análise dos dados espectroscópicos de IV, massas e RMN uni- e bidimensionais. A concentração inibidora mínima (CIM) dos derivados foi determinada utilizando a cepa padrão de M. tuberculosis H37Rv (ATCC 27294), pelo método colorimétrico REMA, em placa de microtitulação (Palomino et al.,2002). Os compostos foram diluídos em DMSO e foram realizadas diluições em série em meio Middlebrook 7H9 suplementado com ácido oleico, albumina bovina, dextrose e catalase (OADC). As concentrações dos derivados variaram de 250 a 1,9 µg/ml. A isoniazida foi utilizada como fármaco de referência nas concentrações de 1,0 a 0,007 µg/ml. Para todos os compostos foram utilizados 100 μl de inóculo bacteriano, padronizados a uma turbidez n. 1 de McFarland, diluído 1:20 em meio Middlebrook 7H9 suplementado com OADC. Após as diluições, as microplacas foram cobertas com tampas e seladas com fita de polietileno e incubadas 7 dias a 35C. As leituras das CIMs foram realizadas 24 horas após adição de 30 μl de resazurina a 0,01%. A avaliação da atividade citotóxica dos derivados foi avalida em triplicada de acordo com metodologia descrita por Mosmann.
Resultado e discussão
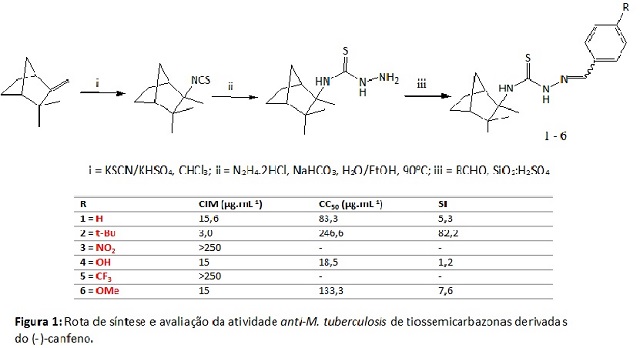
As tiossemicarbazonas (1-6) foram obtidas de acordo com protocolo sintético
descrito por Silva, 1993 e Vandresen, 2014 (Figura 1). Os derivados foram
caracterizados estruturalmente através das técnicas espectroscópicas de IV,
EM
e RMN. Nos espectros de IV destacam-se a presença das bandas em 3345-3140
cm-1
referente à estiramento da ligação N-H, 1539-1542 cm-1 referente à ligação
C=N
e 1231-1235 cm-1 referente a C=S. No espectro de RMN de 1H, observa-se a
presença de sinais de hidrogênios imínicos em δH 7,76-7,80 ppm (s), sinais
dos
hidrogênios do sistema aromático entre δH 6,98 e 8,26 ppm (dd), sinais de NH
em
δH 7,62-8,04 (sl) e 8,69-10,14 (sl), além dos sinais da unidade (-)-canfeno
entre δH 1,09-3,26 ppm. No espectro de RMN de 13C destaca-se a presença de
sinal do grupo tiocarbonílico em δC 175,0-175,4 ppm, além dos demais sinais.
Com relação à avaliação da atividade anti-M. tuberculosis H37Rv, os
derivados 1
e os derivados contendo grupos doadores de elétrons (4-tBu) 2, (4-OH) 4 e
(4-
OMe) 6 mostraram-se ativos com valores de CIM de 15,6, 3,0, 15 e 15 μg/mL,
respectivamente, enquanto que os derivados com grupos retiradores de
elétrons
(4-NO2) 3 e (4-CF3) 5 foram inativos (CIM>250 μg/mL). Em relação à
citotoxidade
(CC50), os derivados que apresentaram as menores toxicidades foram os
derivados
(4-tBu) 2 e (4-OMe) 6, com CC50 de 246,6 e 133,3 μg/mL, respectivamente. Já
o
análogo (4-OH) 4 apresentou-se com maior toxicidade de CC50=18,5μg/mL. Os
derivados 3 e 5 não foram citotoxicamente avaliados. De posse desses dados,
os
derivados que apresentaram melhor seletividade (SI), SI=CC50/CIM, apenas o
derivado 2 apresentou seletividade elevada (SI=82,2). Compostos com SI>10
são
considerados promissores como candidatos à fármacos para o tratamento de
tuberculose.
Conclusões
As tiossemicarbazonas foram obtidas com rendimentos satisfatórios utilizando metodologia de síntese utilizando suporte sólido sílica-gel:H2SO4. Com relação à avaliação da atividade antituberculose, os derivados contendo grupos doadores de elétrons (t-Bu, p-OH e p-OMe) apresentaram-se mais ativas frente à M. tuberculosis H37Rv comparadas aos derivados contendo grupos retiradores de elétrons. Em próximas etapas, pretende-se avaliar o sinergismo destas moléculas em conjunto com fármacos já utilizados na terapia contra tuberculose e verificar a CIM e a citotoxidade com variação do pH do meio.
Agradecimentos
Os autores agradem às instituições de ensino UEM, UTFPR e Unicentro e à CAPES.
Referências
BERALDO, H. Semicarbazonas e tiossemicarbazonas: o amplo perfil farmacológico e usos clínicos. Química Nova, n.27, 461-471. 2004.
HARAGUCHI, S.K.; SILVA, A.A.; VIDOTTI, G.J; DOS SANTOS, P.V.; GARCIA, F.P.; NAKAMURA, C.V.; SILVA, C.C. Antitrypanasomal activity of novel benzaldehyde-thiosemicarbazone derivatives from kaurenoic acid. Molecules, n.16, 1166-1180, 2011.
MAIA, P.I.S.; GRAMINHA, A.; PAVAN, F.R.; LEITE, C.Q.F.; BATISTA, A.A.; BACK, D.F.; LANG, E.S.; ELLENA, J.; LEMOS, S.S.; ARAUJO, H.S.S.; DEFLON, V.M. Palladium(II) complexes with thiosemicarbazones. Syntheses, characterization and cytotoxicity against breast cancer cells and Anti-Mycobacterium tuberculosis activity. Journal of the Brazilian Chemical Society, n.21, 1177-1186, 2010.
MOSMANN, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. n.65, p.55–63, 1983.
PALOMINO, J.C.; MARTIN, A.; CAMACHO, M.; GUERRA, H.; SWINGS, J.; PORTAELS, F. Resazurin microtiter assay plate: simple and inexpensive method for detection of drug resistance in Mycobacterium tuberculosis. Antimicrobial Agents and Chemotherapy. n.46, p.2720, 2002.
SILVA,C.C.; ALMAGRO, V.; MARSAIOLLI, A. J. A direct route to terpene isothiocyanates. Tetrahedron Letters. n.34, p.6717-6719, 1993.
SILVA, A.P.; MARTINI, V.; OLIVEIRA, C.M.A.; CUNHA, S.; CARVALHO, J.; RUIZ, A.L.T.G.; SILVA, C.C. Antitumor activity of (-)-α-bisabolol-based thiosemicarbazones against human tumor cell lines. European Journal of Medicinal Chemistry, v.45, p.2987-2993, 2010.
VANDRESEN, F.; ALMEIDA-BATISTA, S., FALZIROLLI, H., SILVA-GIARDINI, A.P.B., OLIVEIRA, D.N.; RUIZ, A.L.T.G; CARVALHO, J.E.; FOGLIO, J.E.; SILVA, C.C. Novel R-(þ)-limonene-based thiosemicarbazones and their antitumor activity against human tumor cell lines. European Journal of Medicinal Chemistry, n.79, 110-116, 2014.
































